1,2,3-三氮唑杂合体的抗菌活性
李觅 编译
(华烁科技股份有限公司, 武汉 430074)
1 前言
众所周知,绝大多数细菌对人体无害甚至有益,但少数细菌可引发严重疾病甚至死亡。革兰阳性菌(如金黄色葡萄球菌和肺炎链球菌)和革兰阴性菌(如大肠埃希菌和铜绿假单胞菌)是临床上常见的致病菌,严重威胁人类生命健康。抗生素是对付细菌感染的有效武器,但耐药菌的不断涌现和在世界范围内的广泛传播使得致病菌对抗生素的敏感性不断下降。据报道,每年死于耐药菌相关性疾病的患者高达70万。倘若这一趋势不能有效控制,到本世纪中叶死亡人数可能暴增至1000万。显然,耐药菌对各国医疗系统造成了沉重的负担。为扭转这一现状,亟需研发对药敏型和耐药型致病菌均有效的新型抗生素。
1,2,3-三氮唑(图1)可形成多种非共价键作用,是药物分子中的常见官能团。1,2,3-三氮唑衍生物具有抗结核、抗真菌、抗肿瘤和抗菌等多种生物活性,在药物化学领域占据重要位置。杂合体具有克服耐药性、拓展抗菌谱、降低毒性和增强疗效等潜在作用,且多个杂合体如Ro 23-9424和TD-1792已处于临床研究阶段,故杂合体引起了药物化学家的极大关注。显然,将1,2,3-三氮唑与其它具有抗菌活性的药效团杂合可能会获得对药敏型和耐药型致病菌均有活性的候选物。
本文将重点介绍包括1,2,3-三氮唑-唑、1,2,3-三氮唑-查耳酮、1,2,3-三氮唑-香豆素、1,2,3-三氮唑-β-内酰胺、1,2,3-三氮唑-多肽和1,2,3-三氮唑-糖杂合体在抗菌领域的最新研究进展,并探讨了构-效关系(SAR)以期指导科学家更合理的设计此类化合物。
2 1,2,3-三氮唑-唑杂合体
唑为五元氮杂芳香环,广泛存在于自然界及药物分子中。唑类化合物具有包括抗菌活性在内的多种生物活性,故将其与1,2,3-三氮唑杂合可能会获得抗菌活性更高的候选物。
2.1 1,2,3-三氮唑-咪唑杂合体
据统计,60 %~70 %的院内金黄色葡萄球菌感染由耐甲氧西林金黄色葡萄球菌(MRSA)引起。不幸的是,MRSA对包括β-内酰胺类、甘氨酰环素、氟喹诺酮类和噁唑烷酮类抗生素产生耐药性的速度极快,故研发对MRSA具有良好疗效的抗生素迫在眉睫。甲硝唑可用于治疗包括MRSA在内的各种细菌感染,而1,2,3-三氮唑对MRSA也具有潜在的疗效,故1,2,3-三氮唑-甲硝唑杂合体可能对MRSA具有更高的活性。基于此,Negi等研究了35个1,2,3-三氮唑-甲硝唑杂合体1~3(图2)对30株MRSA的体外活性,发现所合成的所有杂合体在浓度为64 μg/mL时对至少1株MRSA显示出抑制活性,且10个化合物在浓度为8 μg/mL依然具有良好活性,而对照药苯唑西林在此浓度并未显示出任何活性。不仅如此,所有杂合体在浓度为50 μmol/Lol/L时对THP-1细胞系未显示出任何毒性,安全性良好。SAR研究结果表明,醚连接的杂合体1的活性优于相应的胺基连接衍生物2。总体而言,苯环上含有卤素原子的杂合体活性优于相应的甲基、异丙基、叔丁基、醛基和硝基衍生物。其中,2,4-二氯杂合体对1l在浓度为4 μg/mL时对所测的9株MRSA具有优秀的活性。值得一提的是,该杂合体与苯唑西林具有协同作用,二者的混合物(1:1)对所测的30株MRSA均显示出强大的抑制作用,最小抑制浓度(MIC)为1~8 μg/mL,是杂合体1l与苯唑西林的≥4倍,极具进一步开发前景。

图1 1H-1,2,3-三氮唑及其互变异构体的化学结构
1,2,3-三氮唑-咪唑并[2,1-b]苯并噻唑杂合体4和5 (MIC: 1~128 μg/mL)对MSAR、金黄色葡萄球菌、枯草芽孢杆菌、藤黄微球菌、大肠埃希菌、痢疾杆菌、铜绿假单胞菌、沙门杆菌和变形杆菌具有潜在的活性,但绝大多数弱于对照药氯新霉素(MIC:8~32 μg/mL)和诺氟沙星(MIC: 1~16 μg/mL)。代表物4q (MIC: 1~16 μg/mL)不仅对所测所有革兰阳性菌和阴性菌的活性不亚于氯新霉素,对所测多种真菌的活性(MIC: 2~64 μg/mL)亦不次于氟康唑(MIC: 1~256 μg/mL),值得深入研究。
1,2,3-三氮唑-苯并咪唑杂合体6和7对临床分离MRSA、甲氧西林敏感性金黄色葡萄球菌(MSSA)和耐万古霉素屎肠球菌(VRE)及包括产超广谱β-内酰胺酶(ESBL)大肠埃希菌、肺炎克雷伯菌和铜绿假单胞菌在内的多种致病菌具有良好的活性,MIC<256 μg/mL。SAR显示,与无取代的杂合体6a~e (MIC: 16~256 μg/mL)相比,向脒结构单元引入异丙基所得的杂合体6f~j(MIC: 8~128 μg/mL)显示出更高的活性,而将脒环化所得的杂合体7 (MIC: 8~256 μg/mL)则对活性不利。
2.2 1,2,3-三氮唑-吡唑杂合体
吡唑是多种抗生素如磺胺苯吡唑的药效团,将其与1,2,3-三氮唑杂合也是开发新型抗菌药的有效策略。对1,2,3-三氮唑-吡唑杂合体8 (MIC: 2~512 μg/mL,图3)的体外抗革兰阳性菌(金黄色葡萄球菌和蜡样芽孢杆菌)和革兰阴性菌(大肠埃希菌和铜绿假单胞菌)活性研究结果显示,这类化合物具有潜在的活性。与无取代的杂合体8a (MIC: 8~32 μg/mL)相比,含有供电子基如甲基、甲氧基和羟基、吸电子基氟、溴及2-噻吩和1-萘基的杂合体(MIC: 16~512 μg/mL)的活性较低,但在苯环对位含有氯和硝基的杂合体8e (MIC: 4~16 μg/mL)和8g (MIC: 2~8 μg/mL)则显示出较高的活性。其中,杂合体8g的抗菌活性可与一线抗菌药环丙沙星(MIC:2~4 μg/mL)相媲美,具有进一步研究的潜力。

图2 1,2,3-三氮唑-咪唑杂合体1~7的化学结构
1,2,3-三氮唑-吡唑杂合体9 (MIC: 5.5~25 μg/mL)对大肠埃希菌、肺炎克雷伯菌、金黄色葡萄球菌和酿脓链球菌具有良好的活性。SAR研究结果显示,向R1位引入甲氧基(9e, MIC: 6.5~10.5 μg/mL)和羧基(9f,MIC: 5.5~9.5 μg/mL)对活性有利,但氯、溴和甲基对活性不利。向R2位引入供电子的甲基和吸电子的氯均会导致活性的降低,提示该位点不适合修饰。代表物9f的抗菌活性与一线抗菌药环丙沙星(MIC: 5.5~9.5 μg/mL)相当,可作为先导物进一步研究。
2.3 1,2,3-三氮唑-噁(二)唑/噻唑杂合体
对1,2,3-三氮唑-噁二唑杂合体10(图4)的抗菌SAR研究结果表明,与相应的醇衍生物10a~c (MIC: 4~8 μg/mL)相比,酯10d~f (MIC: 31.25~62.5 μg/mL)和醚10g,h (MIC: 31.25~125 μg/mL)的抗菌活性有所降低,且活性顺序为醇>酯>醚,但几乎所有杂合体的抗菌活性均弱于环丙沙星(MIC: ≥5 μg/mL)。1,2,3-三氮唑-噁唑杂合体11 (在浓度为1 mg/mL的抑菌圈:2.5~3.0 mmol/L)对枯草芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌和大肠埃希菌具有中等强度的活性,但弱于对照药氧氟沙星和诺氟沙星。
除杂合体12a,b (MIC: 4.5~20.2 μg/mL)之外的其它1,2,3-三氮唑-噻唑杂合体12对荧光假单胞菌、大肠埃希菌、枯草芽孢杆菌和金黄色葡萄球菌的活性均较弱,MIC>30 μg/mL。而苯并噻唑连接的1,2,3-三氮唑-硅醚13的抗菌活性在毫摩尔级,仍需进一步优化。
2.4 1,2,3-三氮唑-三氮唑杂合体
Aouad 等评价了一系列1,2,3-三氮唑-1,2,4-三氮唑杂合体14的抗菌和抗真菌活性,发现这类杂合体对所测的所有致病菌均具有潜在的活性,MIC为1~128 μg/mL,某些化合物的抗菌和抗真菌活性与环丙沙星(MIC: 1~8 μg/mL)和氟康唑(MIC: 1和4 μg/mL)相当或更优。SAR显示,R位为胺基的杂合体14e~g (MIC:1~64 μg/mL)活性优于相应的苯基衍生物14a~d (MIC:2~128 μg/mL)。连接子的长度与活性息息相关,且长链连接子优于短链连接子。代表物14g (MIC: 1~16 μg/mL)的抗菌和抗真菌活性可与环丙沙星和氟康唑相媲美,值得进一步研究。
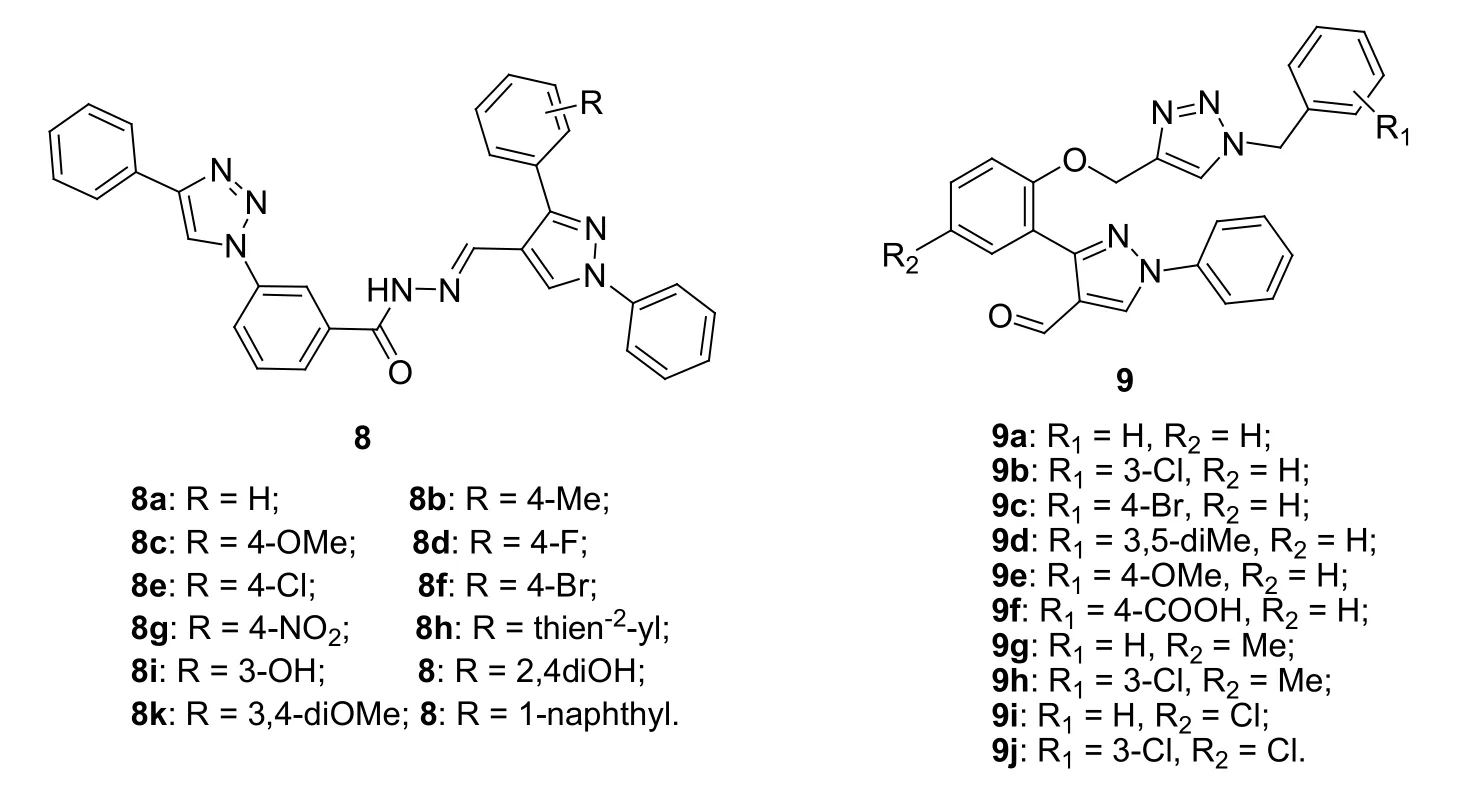
图3 1,2,3-三氮唑-吡唑杂合体8和9的化学结构

图4 1,2,3-三氮唑-噁(二)唑/噻唑杂合体10~13的化学结构
N-2位连有取代苯基的1,2,3-三氮唑二聚体15 (在浓度为5 mg/mL的抑菌圈: 8.3~25.2 mmol/L,图5)也具有潜在的抗菌和抗真菌活性。其中,二聚体15b(在浓度为5 mg/mL的抗菌和抗真菌抑菌圈分别为20.4~25.2 mmol/L和16.9~23.2 mmol/L)的抗菌活性与阿莫西林(在浓度为5 mg/mL时对枯草芽孢杆菌和金黄色葡萄球菌的抑菌圈分别为23.8和32.4 mmol/L)和庆大霉素(在浓度为5 mg/mL时大肠埃希菌和铜绿假单胞菌的抑菌圈分别为17.3和19.9 mmol/L)相当,抗真菌活性与两性霉素B (在浓度为5 mg/mL时的抑菌圈分别为19.7~28.7 mmol/L)相当,值得进一步开发。
研究显示,用醚连接子代替酰胺连接子可增强抗菌活性,如1,2,3-三氮唑二聚体16 (MIC:0.0199~0.4176 μmol/Lol/L)对枯草芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌和大肠埃希菌等均具有极高的活性。与无取代的化合物 16a (MIC:0.0928~0.3714 μmol/Lol/L)相比,苯基上连有硝基的二聚体16c (MIC: 0.0199~0.0398 μmol/L)的活性更高,但含有甲氧基的16b (MIC: 0.1671~0.4176 μmol/L)则活性有所降低,提示吸电子基对活性有利。进一步研究显示,这类二聚体可通过抑制II型拓扑异构酶即DNA促旋酶B亚基发挥功效。代表物16c的抗枯草芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌和大肠埃希菌活性是环丙沙星(MIC: 0.0377~0.1509 μmol/L)的2~5倍,值得深入开发。
1,2,3-三氮唑-三氮唑杂合体17~23也具有潜在的抗菌活性,如杂合体22a的MIC为3.12~12.5 μmol/L,但绝大多数杂合体活性远逊于对照药。
3 1,2,3-三氮唑-查耳酮杂合体
对1,2,3-三氮唑-查耳酮杂合体24和25(图6)的抗菌和抗真菌研究结果表明,这类杂合体具有极高的抗菌和抗真菌活性,MIC低至3.0~37 nmol/L。SAR显示,与无取代衍生物相比,向苯环引入吸电子基和供电子基均可提高抗菌和抗真菌活性,且溴和甲氧基对活性最优。杂合体24b (抗菌和抗真菌的MIC分别为3.4 nmol/L和3.4~6.8 nmol/L)的抗菌活性和抗真菌活性分别优于环丙沙星(MIC: 4.7 nmol/L)和氟康唑(MIC: 5.1~10.2 nmol/L)值得进一步研究。

图5 1,2,3-三氮唑-三氮唑杂合体14~23的化学结构
1,2,3-三氮唑-查耳酮杂合体26和27 (MIC:6.25~50 μg/mL)也具有潜在的抗菌活性,但远弱于对照药。与相应的单1,2,3-三氮唑杂合体28和29 (MIC:6.25~>100 μg/mL)相比,第二个1,2,3-三氮唑结构片段的引入(30, MIC: 6.25~>100 μg/mL)并不能改善这类化合物的活性。
4 1,2,3-三氮唑-香豆素杂合体
1,2,3-三氮唑-香豆素杂合体31~33 (MIC: 0.2~100 μg/mL,图7)具有潜在的抗大肠埃希菌、枯草芽孢杆菌、表皮葡萄球菌、铜绿假单胞菌、白色念珠菌和黑曲霉活性,其中代表物31f (MIC: 0.4, 1.6和1.6 μg/mL)的抗大肠埃希菌、表皮葡萄球菌和黑曲霉活性优于链霉素(MIC: 2 μg/mL)和氟康唑(MIC: 8 μg/mL),具有进一步研究的潜力。
1,2,3-三氮唑-香豆素杂合体34和35抗金黄色葡萄球菌、藤黄微球菌、蜡样芽孢杆菌、大肠埃希菌、荧光假单胞菌和贪食黄杆菌的MIC为2~128 μg/mL,活性弱于卡那霉素(MIC: 2 μg/mL)和氯霉素(MIC: 2 μg/mL),但某些化合物如35a (MIC: 2~8 μg/mL)的活性与阿莫西林(MIC: 2~16 μg/mL)相当或更优。有趣的是,几乎所有杂合体(MIC: 2~32 μg/mL)的抗真菌活性均与咪康唑 (MIC: 16 μg/mL)相当或更优。SAR显示,向苯环上引入硝基可增强抗菌活性。杂合体34的抗菌活性与衍生物35相当,提示连接方式对活性影响较小。
5 1,2,3-三氮唑-β-内酰胺杂合体
2-氮杂环丁酮是β-内酰胺类抗生素的常见结构单元,将其与1,2,3-三氮唑杂合可能能够克服金属β-内酰胺酶导致的耐药性。
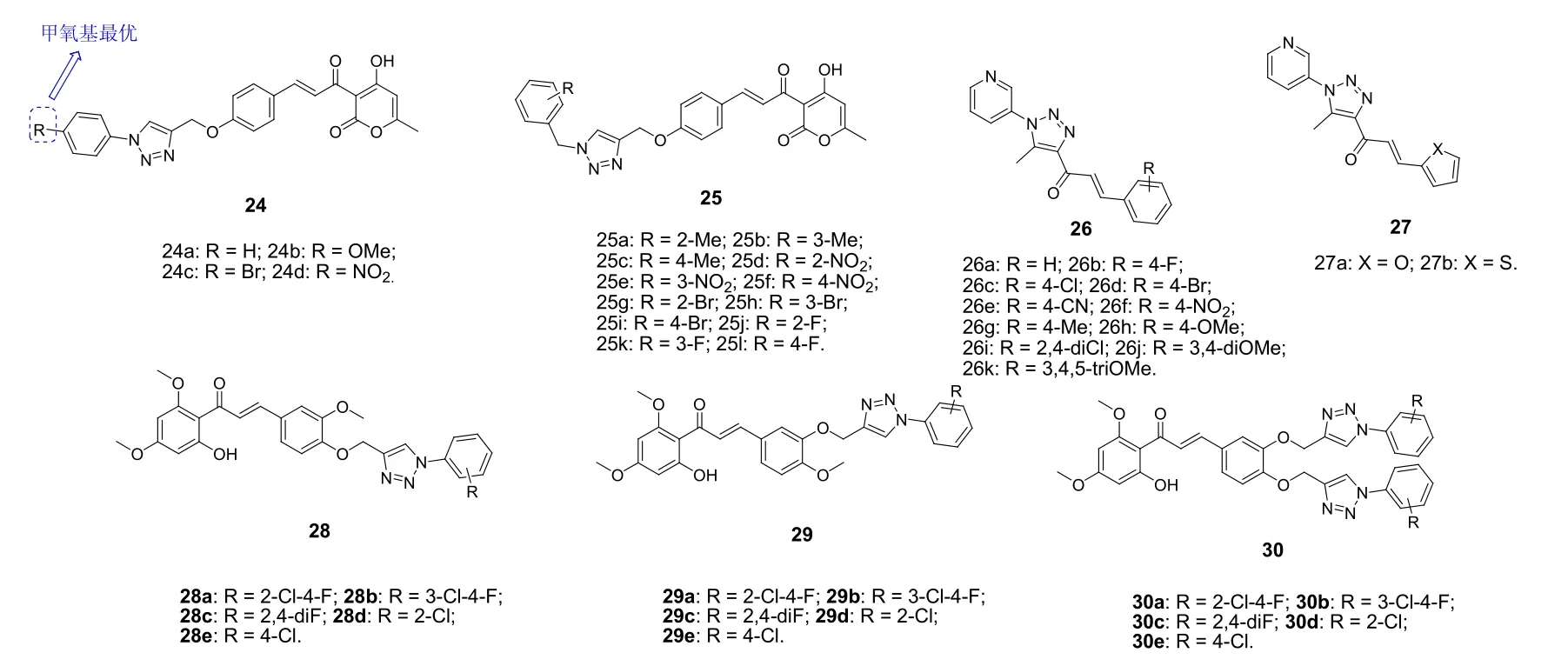
图6 1,2,3-三氮唑-查耳酮杂合体24~30的化学结构
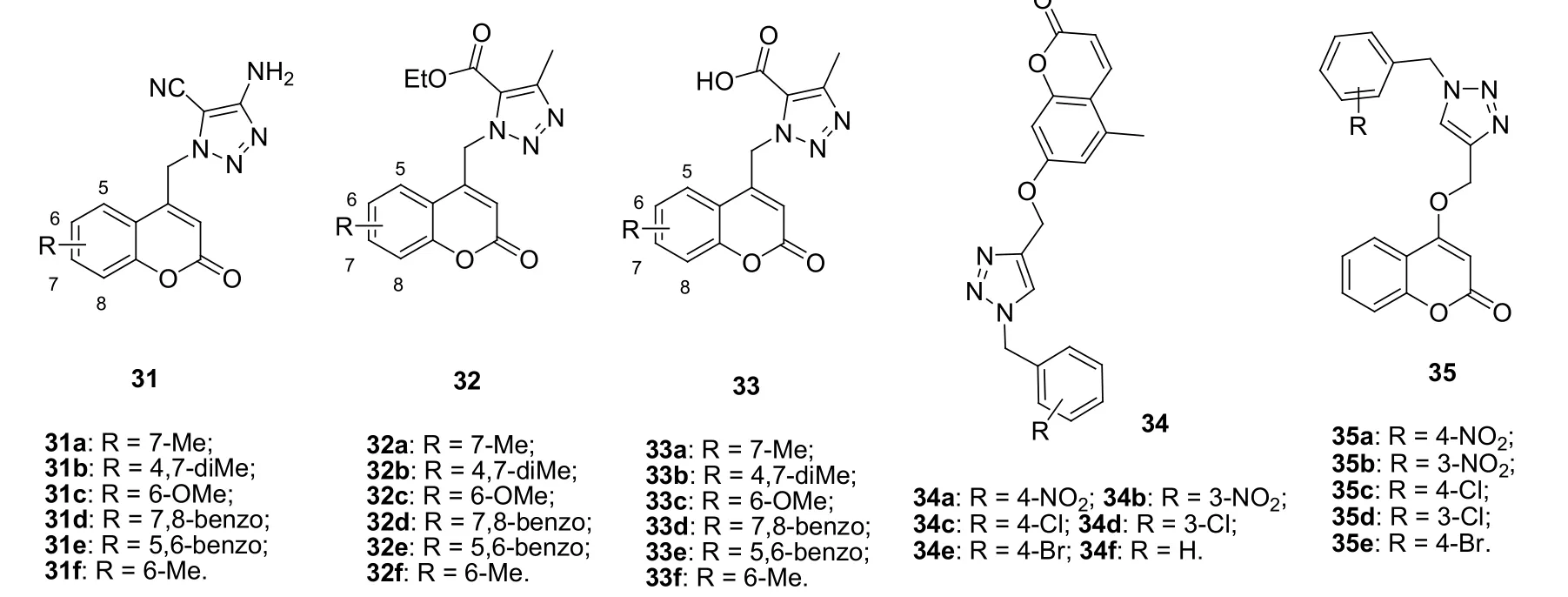
图7 1,2,3-三氮唑-香豆素杂合体31~35的化学结构
对1,2,3-三氮唑-β-内酰胺杂合体36(图8)的体外抗β-内酰胺酶表达的大肠埃希菌株活性研究结果表明,这类杂合体对所测的所有菌株均显示出良好的活性,MIC为≤0.06~32 μg/mL。SAR研究结果表明,向R1和R2位引入环丙基比引入环丁基或甲基有利。活性最高的杂合体36h (MIC: ≤0.06~1 μg/mL)对所测的另外88株肠杆菌科细菌的平均MIC为4 μg/mL,活性是对照药氨曲南(MIC: 32 μg/mL)和美罗培南(MIC:>64 μg/mL)的≥8倍,可作为先导物进一步优化。
6 1,2,3-三氮唑-多肽杂合体
Das等评价了一系列多肽杂合体37和38(图9)的抗菌活性,发现这类杂合体对金黄色葡萄球菌和枯草芽孢杆菌具有较高的活性,MIC为1.56~12.5 μg/mL,但对KB细胞的毒性较高(半抑制浓度/IC50: 2.9~18 μg/mL)。SAR显示,不含1,2,3-三氮唑的杂合体38b(MIC: 12.5 μg/mL)与含有1,2,3-三氮唑的杂合体37b(MIC: 12.5 μg/mL)的抗菌活性相当,提示1,2,3-三氮唑并非这类化合物具有高活性所必需的的基团。

图8 1,2,3-三氮唑-β-内酰胺杂合体36的化学结构
1,2,3-三氮唑-多肽杂合体39 (MIC: 1.6~>200 μg/mL)对大肠埃希菌、粪肠球菌和金黄色葡萄球菌也具有潜在的活性,但对哺乳动物细胞的毒性也较高,仍需进一步修饰。
7 1,2,3-三氮唑-糖杂合体
大多数1,2,3-三氮唑-糖杂合体对所测革兰阳性菌和阴性菌仅显示出弱到中等强度的活性,而某些杂合体则与对照药具有相当的抗菌活性,如1,2,3-三氮唑-糖杂合体40c (MIC: 1.56~6.25 μg/mL,图10)的抗枯草芽孢杆菌、大肠埃希菌、金黄色葡萄球菌、藤黄微球菌、普通变形杆菌和鼠伤寒沙门菌活性不亚于阿莫西林(MIC: 1.56~12.5 μg/mL)。杂合体41a,b(MIC: 8~16 μg/mL)多包括MRSA临床分离株、诱导耐药型金黄色葡萄球菌和固有耐药型金黄色葡萄球菌在内的多种敏感型和耐药型金黄色葡萄球菌还具有良好的活性,对绝大多数所测MRSA临床分离株和固有耐药型金黄色葡萄球菌的活性远高于对照药螺旋霉素(MIC: >256 μg/mL),具有治疗耐药金黄色葡萄球菌感染的潜力。
1,2,3-三氮唑-氨基糖苷杂合体42 (MIC: 1~≥2,000 μg/mL)的抗菌活性与新霉素 (MIC: 1~≥2,000 μg/mL)相当,而1,2,3-三氮唑连接的环丙沙星-氨基糖苷杂合体43 (MIC: 0.38~48 μg/mL)的活性这优于新霉素,提示环丙沙星的引入对活性有利。不仅如此,杂合体43还具有克服氨基糖苷类抗生素耐药机制的潜力,值得深入研究。
1,2,3-三氮唑连接的环丙沙星-卡那霉素A杂合体44 (MIC: 0.09~36 μg/mL)对包括耐药菌在内的革兰阳性菌和阴性菌具有良好的活性。尽管这类杂合体的抗革兰阴性菌活性弱于环丙沙星(MIC: 0.003~1 μg/mL),但优于卡那霉素A (MIC: 1.5~>384 μg/mL)。进一步研究显示,大肠埃希菌和枯草芽孢杆菌对这类杂合体产生耐药性的速度极为缓慢,故这类杂合体具有进一步研究价值。

图9 1,2,3-三氮唑-多肽杂合体37~39的化学结构
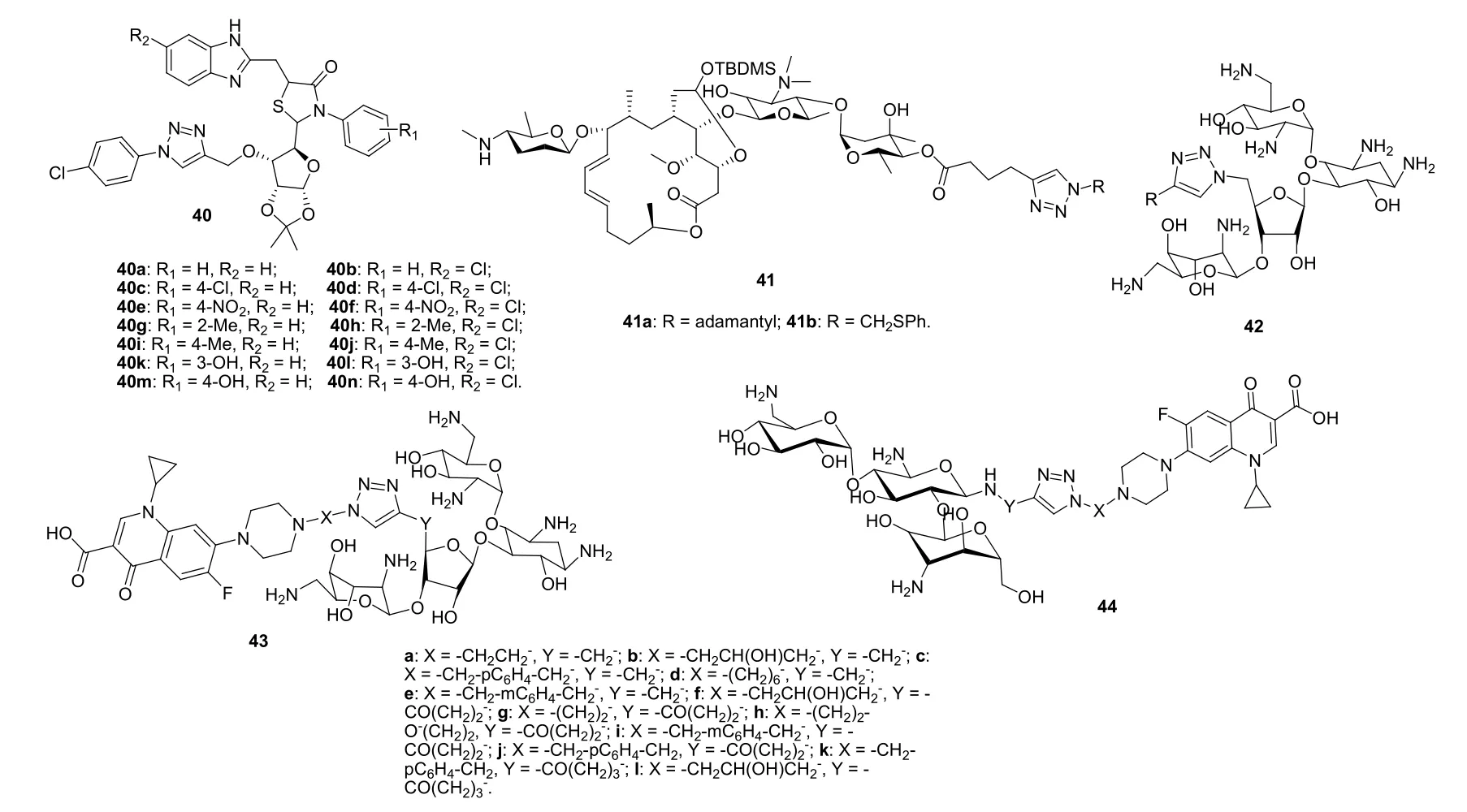
图10 1,2,3-三氮唑-糖杂合体40~44的化学结构
8 其它1,2,3-三氮唑杂合体
1,2,3-三氮唑-呋喃/噻吩杂合体也具有一定的抗菌活性,如杂合体S02030 (45,图11) 可抑制包括肺炎链球菌KPC-2和SHV-1在内的多种丝氨酸β-内酰胺酶,具有潜在的抗菌活性。
绝大多数1,2,3-三氮唑-吲哚/靛红杂合体的抗菌活性和MIC ≥100 μg/mL,但杂合体66a,b (MIC:1.56~6.25 μg/mL)的活性与氯霉素和庆大霉素(MIC:1.56~3.125 μg/mL) 相当。
除以上杂合体外,其它1,2,3-三氮唑杂合体也显示出一定的抗菌活性,但均弱于对照药,需进一步优化。
9 结束语
抗生素是治疗细菌感染的最常用武器,但是随着抗生素的长时间广泛使用,细菌已对抗生素产生了耐药性。因此,亟需开发新型抗生素。杂合体分子具有克服耐药性、拓展抗菌谱和减少毒副作用的潜力,引起了药物化学家的极大关注。1,2,3-三氮唑衍生物具有良好的抗菌活性,将 1,2,3-三氮唑与其它具有抗菌活性的药效团杂合是获得具有新作用机制的抗菌药候选物的有效途径。
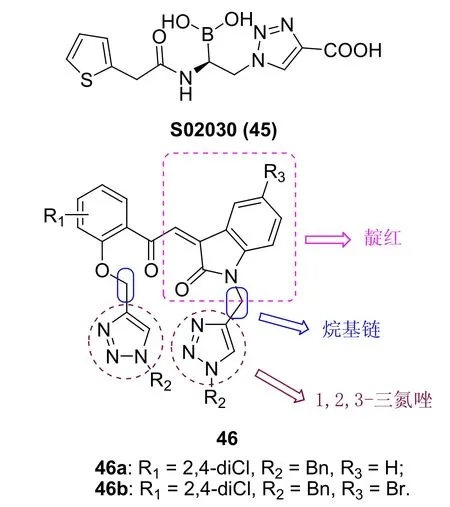
图11 1,2,3-三氮唑杂合体45和46的化学结构
本文综述了进20年来 1,2,3-三氮唑-唑、1,2,3-三氮唑-查耳酮、1,2,3-三氮唑-香豆素、1,2,3-三氮唑-β-内酰胺、1,2,3-三氮唑-多肽和1,2,3-三氮唑-糖杂合体在抗菌领域的最新研究进展,并探讨了构-效关系(SAR)以期指导药物化学家更合理的设计此类化合物。

