植物非特异性磷脂酶C的研究进展
帅良 孙健 段振华 李丽 何雪梅 李昌宝 廖玲燕
摘要:非特异性磷脂酶C(non-specific PLC,NPC)能够水解磷脂酸胆碱和磷脂酰乙醇胺生成二酰基甘油(diacylglycerol,DAG),虽然非特异性磷脂酶C没有PLC家族基因的C2、X、Y、EF等结构域,但它仍含有1个磷酸酯酶结构域,能够水解磷脂。近年来研究发现,非特异性磷脂酶C在植物逆境胁迫和信号转导的过程中起着重要的调节作用。因此本文对非特异性磷脂酶C的结构、生理功能及其作用机制进行概述,并对其研究前景进行了展望。
关键词:非特异性磷脂酶C;二酰基甘油;逆境胁迫;信号转导
中图分类号:S184 文献标志码: A
文章编号:1002-1302(2019)18-0030-08
收稿日期:2018-06-11
基金项目:公益性行业(农业)科研专项(编号:201303073);国家自然科学基金(编号:31560467、31160407、31660589);2014年国家中组部“万人计划”青年拔尖人才项目(编号:组厅字[2015]48号);“八桂学者”工程专项经费(编号:[2016]21);广西创新驱动发展专项资金(编号:桂科AA17204038、桂科AA17204042);广西农业科学院博士后基金(编号:桂农科博2018029);广西特聘专家专项经费(编号:厅发[2016]21号);广西果蔬保鲜与深加工人才小开放课题(编号:2016XGDSHFW02);现代食品加工新技术研究岗位创新人才培养示范基地建设(编号:桂科AD17195088)。
作者简介:帅 良(1986—),男,江西新干人,博士,讲师,主要从事农产品贮藏技术研究。Tel:(0771)3240232;E-mail:shuailiang1212@163.com。
通信作者:孙 健,博士,研究员,主要从事农产品贮藏与加工技术研究。Tel:(0771)3240692;E-mail:jiansun@gxaas.net。
磷脂酶(phospholipases)是一类能够水解磷脂的酶类,根据其水解磷脂位点的不同可将其分为磷脂酶A1(phospholipases A1,PLA1)、磷脂酶A2(PLA2)、磷脂酶C(PLC)和磷脂酶D(PLD)[1],它们均在植物生长发育、生物胁迫及非生物胁迫中起重要的调控作用。其中PLC介导的细胞信号通路是信号转导中最经典的通路之一,它能够水解磷脂生成1分子的二酰基甘油(diacylglycerol,DAG)和1个含有磷酸基团的小分子[2]。植物中的PLC根据水解底物和功能的不同可以分为3类:第1类为能够水解磷脂酸胆碱(phosphatidylcholine,PC)和磷脂酰乙醇胺(phosphatidylethanolamine,PE)并生成DAG的非特异性磷脂酶C(non-specific PLC,NPC);第2類为能够水解4,5二磷酸肌醇(phosphatidylinositol 4,5-bisphosphate,PIP2)生成三磷酸肌醇(inositol 1,4,5-trisphosphate,IP3)和DAG的磷酸肌醇特异性磷脂酶C(phosphoinositide-specifc PLC,PI-PLC);第3类为能够水解连接在内质网上的糖基磷脂酰肌醇锚蛋白的糖基磷脂酰肌醇特异性磷脂酶C(glycosylphosphatidylinositol PLC,GPI-PLC)[3]。NPC最先在产气荚膜梭菌中被发现[4]。1955年,在植物质体中发现了类似NPC的活性[5]。目前为止,已经从拟南芥[6]、水稻[7]、谷子[8]、陆地棉[9]等植物中克隆出NPC基因成员。近年来,大量研究结果表明,NPC类基因在植物处于干旱、高盐、低磷等非生物胁迫条件下时发挥重要的作用,并参与脱落酸(ABA)、油菜素内酯(BL)等激素信号传导途径[10]。本文结合近几年来国内外NPC功能、分类和结构的研究进展,综述其参与不同植物信号转导的方式,对NPC在植物中的作用机制及其行使的相关功能作一个简要总结。
1 NPC的结构特点
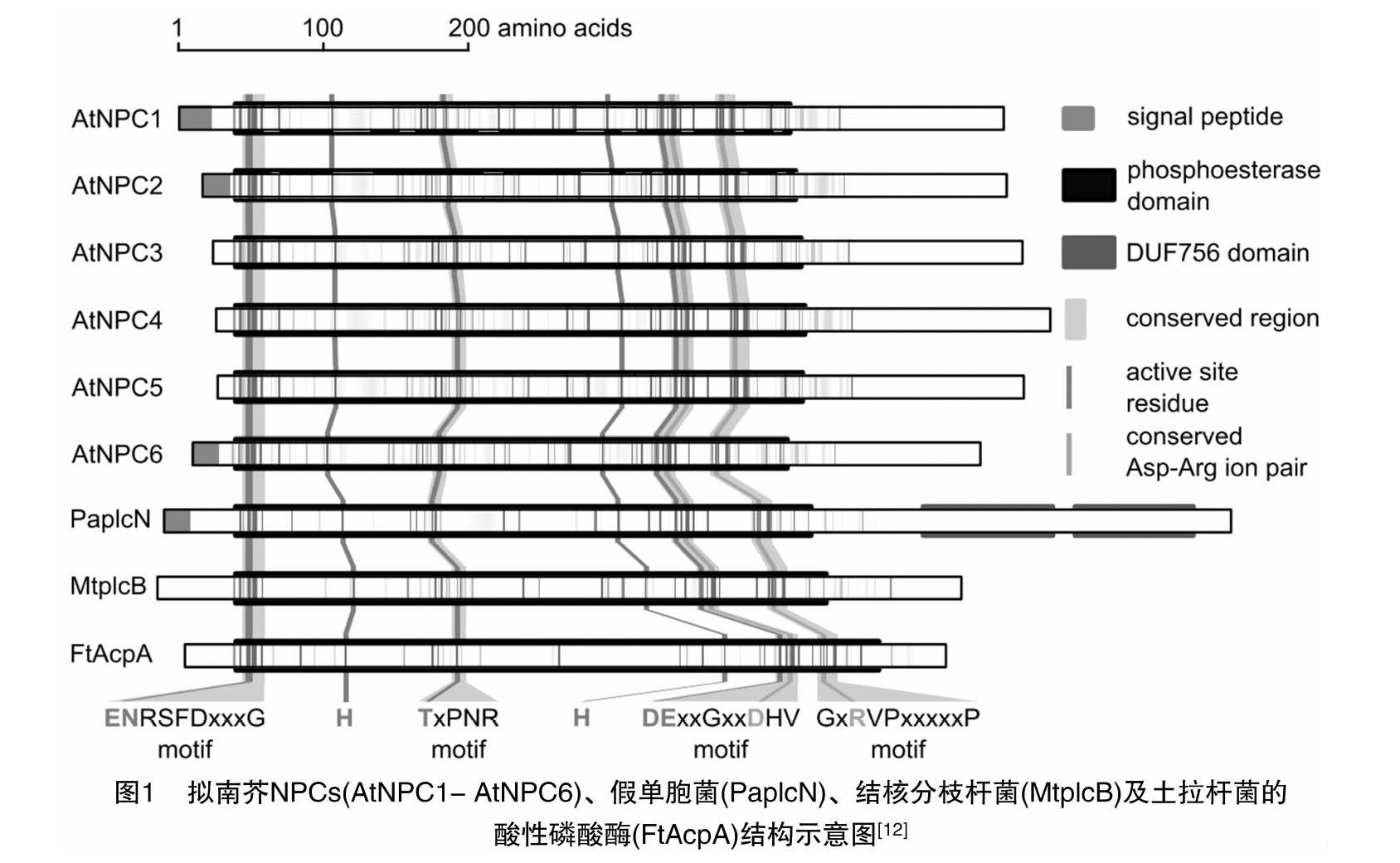
早期研究认为,植物NPC基因与其他已知的植物磷脂酶基因家族成员没有任何关系,随着研究的不断深入,多序列比对分析结果发现,拟南芥NPC与结核分支杆菌的PLC同源性相近,并且具有3个相似的结构域[11]。高等植物的基因组通常包含几个基因编码家族,NPCs蛋白一般是由510~540个氨基酸残基组成。NPC蛋白含有1个主要的磷酸酯酶域,具有典型的酯酶活性(图1)。NPC蛋白不像其他植物脂质信号转导蛋白一样含有C2、XY、EF、PH、PX、ENTH、FYVE等结构域。多数植物的NPCs蛋白在N端都含有1个信号肽,信号肽后面接着是1个短的可变区域和1个包含ENRSFDxxxG序列的高度保守结构域,这个保守区域在磷脂酸结构域的开头部位。但是这个D端的信号肽在拟南芥NPC3、NPC4和NPC5蛋白中并未发现。TxPNR和DExxGxxDHV 2个不变的结构域在NPC蛋白的中间部位,在磷脂酸结构域的尾部有1个GxRVPxxxxxP结构域。在蛋白质C端的50~100个氨基酸序列是NPC序列最分散的部分,不同的NPC亚族具有不同的长度和保守序列。这部分序列通过与其他蛋白相互作用和确定蛋白质的位置,使得不同的NPC亚型具有不同的功能[11](图1)。
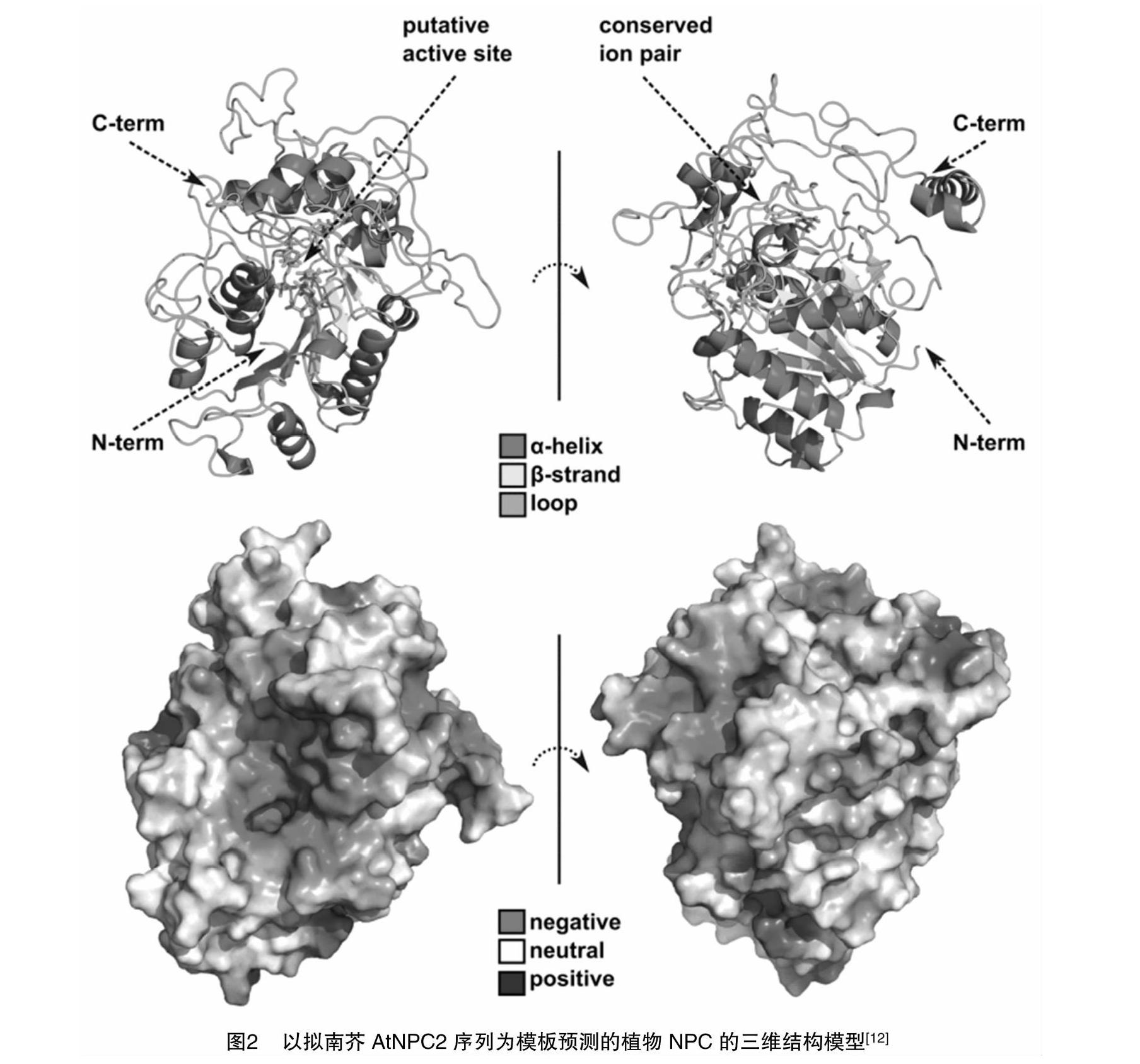
分析拟南芥AtNPC2蛋白的3D模型发现,它和土拉杆菌的酸性磷酸酶(AcpA)结构类似。植物PC-PLC的蛋白骨架是由β折叠和若干α螺旋组成的内涵蛋白构成(图2)。研究发现,构成土拉细菌AcpA活性部位的大多数氨基酸残基都是保守的,包括与未识别的金属阳离子结合的位点[13]。
AtNPC2蛋白预测模型发现,可变的C端包含1个帽子结构,这个结构保护了蛋白的活性中心,使得蛋白不能直接参与催化反应。这一发现与NPC蛋白序列分析结果一致。同时还发现,植物NPCs的活性位点形成了1个带强烈负电荷的口袋结构,该结构可能与磷脂基质的结合有关[13]。
2 NPC的生化特点和亚细胞定位
在大肠杆菌中重组表达拟南芥NPC4蛋白,体外活性测定发现NPC4蛋白对PC和PE均有水解活性,而对磷脂酸(PA)和PIP2的底物水解活性可以忽略不计[6,11]。Peters等研究发现,NPC4对磷脂酰丝氨酸(phosphatidylserine,PS)和磷脂酰甘油(phosphatidylglycerols,PG)具有一定的水解活性[6]。大肠杆菌重组表达拟南芥NPC5蛋白的研究发现,该蛋白能够将PC和PE水解为DAG,但其水解活性比NPC4低40倍以上[14]。然而,重组表达的拟南芥NPC3蛋白则表现出将溶血磷脂酸(lysobisphosphatidic acids,LPA)水解成单酰基甘油的磷脂酶活性,而对其他磷脂质不呈现水解活性[15]。体外测定拟南芥重组表达蛋白NPC1和NPC2活性发现,2个蛋白都具有NPC酶活性,都能够将PC水解为DAG[16-17]。至今未见拟南芥NPC6活性研究的报道。在烟草和矮牵牛中的研究发现,在人工培养的烟草细胞和矮牵牛提取物中能够鉴定出具有放射性标记的DAG,推测其主要由NPC水解具有放射性标记的PC而来[18-19]。
与其他依赖于Ca2+的磷脂酶不同,NPC4的活性与Ca2+浓度无关,但是加入EGTA能够轻微增加其活性,造成这一现象的原因可能是由于EGTA能够抑制2价阳离子的螯合作用[11]。NPC3水解溶血磷脂酸的活性能够被Triton X-100、NP-40和CHAPS等表面活性剂抑制,抑制程度与活性剂浓度大小呈正相关[15],同时还发现NPC3的活性大小与Mg2+、Ca2+和Mn2+等金属离子的浓度大小无关。植物体外NPC活性研究表明,在烟草悬浮细胞BY-2体系中高浓度Al3+(≥100 μmol/L AlCl3) 能够抑制PC被水解[20]。 同样在拟南芥中的研究也发现,Al3+能够降低由PC水解生成的DAG的量[21]。Al3+能够抑制NPC活性的主要原因是Al3+能够诱导拟南芥细胞膜的物理性质发生改变,从而影响细胞膜结合的NPC蛋白的活性[22]。在欧洲油菜中的研究发现,油菜类固醇激素24-EBR和鹽能够增加NPC和PLD的活性[23]。虽然在动物和细菌中有PC-PIC的直接抑制剂[24-25],但是植物中尚未发现NPCs的特异性抑制剂。
通常来讲,植物磷脂酶的亚细胞定位可以典型地分为细胞质中和细胞膜结合两大类[3,26]。试验人员已经在矮牵牛和烟草BY-2悬浮细胞的细胞膜上测定出NPC的活性[19-20]。研究人员在燕麦根的细胞膜上也发现了与拟南芥NPC4抗体起结合反应的磷脂酶,由此推测燕麦根上具有NPC蛋白[27]。利用NPC4的多克隆抗体对拟南芥叶片的亚细胞组分进行分析,结果发现拟南芥NPC4蛋白定位于细胞膜上[11],通过构建NPC4-GFP定位载体进一步验证了该结论[14]。NPC3是在拟南芥液泡蛋白质组的质谱鉴定中被发现的[28],由此可知拟南芥NPC3蛋白定位于细胞质中。但是,目前关于NPC3和NPC4的细胞定位决定因素至今仍不清楚。构建NPC5-GFP定位载体发现,拟南芥NPC5蛋白定位于细胞质中[14]。激光共聚焦显微镜分析显示,水稻NPC1和NPC3分别定位于细胞质和叶绿体上[29],而NPC2主要定位于拟南芥根系的高尔基体上[17]。
3 NPC的生理功能
大量研究表明,NPC参与植物对环境和生物刺激的各种代谢反应。在长期经受生物和非生物胁迫、磷酸盐缺乏和某些激素处理(生长素、细胞分裂素、ABA)的刺激条件下,植物NPC的活性和基因表达会发生改变。相反,当植物受到铝、油菜素内酯和诱导子等刺激后,植物体内NPC活性和DAG的含量会迅速发生改变。这些刺激反应比从头合成蛋白反应更快,只需要30~45 min[30]。依据NPC在信号转导过程中所起的作用,由此可将植物NPC列入到磷脂酶中。
3.1 NPC在非生物胁迫中的作用
磷脂信号在渗透和盐胁迫条件下的防御反应中起着重要作用。在低渗透作用的刺激下,盐生杜氏藻的细胞膜中快速积累了大量的由PC水解而成的DAG[31]。使用100 mmol/L的NaCl处理拟南芥后3~6 h,拟南芥根中NPC4表达量增加了12倍[32]。与野生型拟南芥相比,敲除npc4基因的突变体在含有150 mmol/L NaCl的培养基上播种时其萌发率显著降低[32]。在另一项研究中发现,npc4基因的突变体在盐和干旱胁迫条件下可以减少种子萌发率和整体生存能力。在盐胁迫和高渗条件下,与野生型植株表现不同的是,过表达的NPC4突变体具有较高的种子萌发率、较大的根长度和干质量[6]。在拟南芥的侧根发育中,NPC5介导了其对盐胁迫的反应。在盐胁迫处理条件下,NPC5的表达量大幅度提高[33]。综上所述,NPC在植物响应盐胁迫处理的过程中起着至关重要的作用。
铝中毒可以通过细胞膜去极化、破坏离子通道和钙离子稳态等途径迅速地抑制植物根生长[34-36]。在铝胁迫期间,磷脂酶和脂类中间体被认为是执行信号转导和代谢的主要角色[37]。通过对DAG形成和降解有关的代谢途径研究发现,使用铝处理的烟草悬浮BY-2细胞,NPC的活性决定了DAG积累量[20]。
同时研究还发现,NPCs在植物的耐热性中起重要作用。在37 ℃的热胁迫下处理拟南芥2 h后,NPC3的表达量增加了14.6倍[38]。与野生型相对比,拟南芥中过表达NPC1后其耐热性有了很大地提高,由此可知,NPC1参与植物对热胁迫的响应[16]。
3.2 NPC在生物胁迫中的作用
现已证实磷脂酶在植物的防御反应中起着重要作用,为脂质作用第二信使提供了重要依据[39-40]。Scherer等第1次证实NPC在植物防御反应中的信号转导中起作用[18]。在甜橙黄龙病的研究中发现,当甜橙感染黄龙病后,与拟南芥AtNPC5同源的甜橙NPC基因表达量增加了5倍,推测甜橙NPC基因在抗病过程中起作用[41]。拟南芥DNA微阵列数据显示,接种假单孢杆菌后NPC基因家族(尤其是NPC6)的表达量出现显著下降;而接种灰霉菌、白粉菌、丁香假单胞菌和晚疫病菌的植株NPC3和NPC4的表达量上升[6]。使用来自细菌的激发子flg22和HprZ处理拟南芥,结果发现NPC1和NPC4表达量有所改变,表明NPCs在应激过程和感知不同激发子能力时可能具有不同的功能。拟南芥接种丁香假单胞菌后NPC2表达水平出现显著下降,造成表达下降的主要原因是当遇到病原体攻击时,植物需要迅速重新排列它们的代谢通量并激活防御系统[17]。在白粉虱感染过程中,NPC3表达量升高,表明NPC3可能参与了对害虫的防御反应[12]。由此可知,植物NPC在抵御微生物和病虫害侵染的过程中起着重要作用。
NPC在防御反应中的主要作用是水解磷脂产生DAG,再通过DAG激酶(DAG kinase,DGK)转化生成PA或者其他脂质第二信使。在胡萝卜中的研究发现,DAG的合成能够快速激活起防御反应的植物抗毒素生成[42]。水稻中的研究表明,DAG和PA的产生还控制了活性氧的生成以及抗病激发子响应基因的表达,从而增强植物的抗病性[43]。使用N,N′,N″,N-四乙酰壳聚糖和flg22激活子处理番茄细胞,结果发现处理后能够显著提高细胞中PA的积累量,但其积累与PLD的活性无关,由此可知,DAG/DGK途径在特定的植物防御反应中起作用[44]。Zhang等研究表明,在拟南芥中DGK辅助DAG转化生成PA是植物对损伤响应的早期反应[45]。使用壳聚糖和木聚糖酶诱导子处理悬浮液培养的紫花苜蓿细胞[46]和木聚糖酶诱导处理番茄细胞[47]中都观察到了DAG/DGK途径的PA生成。此外,水稻防御反应的OsBIDK1基因在烟草中的表达增加了其对烟草花叶病毒和疫霉病的抗性,揭示DGK在脂质信号通路中起着重要的作用[48]。
3.3 NPC在激素调节中的作用
植物激素的主要功能是包括由PLC和PLD在内的众多信号转导物质介导而成的。目前,关于NPCs如何参与调控植物激素的功能依然不是很清楚。在烟草中的研究发现,使用表油菜素内酯(BL)处理BY-2细胞后可以快速诱导烟草细胞中NPC的活性增加[49]。拟南芥敲除npc3和npc4基因的突变体对BL的处理敏感性显著降低,同时BL响应基因TCH4和LRX2的表达量也发生了改变[49]。在NPC缺乏的植株中其对1-NAA生长素的敏感性是不变的,但在npc3基因的突变体植株中,参与生长素信号的IAA19和IAA20基因表达量显著降低。此外,半定量PCR检测发现,生长素、细胞分裂素和表油菜素内酯对NPCs的表达水平都有影响[49]。当使用玉米素处理3 h和表油菜素内酯处理24 h后拟南芥NPC4的表达水平升高,而其他NPC基因的表达水平只有轻微的变化[49]。经1-NAA或芸苔素内酯处理的拟南芥,其PNPC3 ∶GUS和PNPC4 ∶GUS基因的表达量在根尖、子叶、叶缘和花器官中显著增强,表达变化和生长素合成基因DR5 ∶GUS类似[50],由此可知,生长素、油菜素内酯和NPC相互作用从而影响拟南芥根细胞的生长。研究还发现,PNPC2 ∶GUS的表达方式与富含生长素的根区相关,但当使用IAA处理npc2突变体时,突变体在根系密度和长度上并没有发生异常[51]。
使用SA、MeJA和ACC等激素处理拟南芥发现,只有SA处理使得NPC2的表达水平出现下降[17],说明NPC2在相应SA处理的过程中起作用。使用ABA、SA和MeJA等激素处理拟南芥后,发现只有ABA处理能够诱导NPC4基因的表达发生变化,说明NPC4在响应ABA处理的过程中起着重要作用[52]。在种子中积累了较高水平ABA的拟南芥npc4突变株对ABA处理不敏感,从而导致种子萌发、生长和气孔运动异常[6]。使用ABA和盐胁迫同时处理的npc4突变体,结果发现ABA响应基因(ABI1、ABI2、RAB18、PP2CA、OST1、RD29B、ERA1和SOT12)的表达水平会发生较大的变化,从而重新唤起ABA信号途径[6,32]。拟南芥植株中过表达NPC4基因会使得种子对ABA的敏感性提高从而抑制种子萌发,并且能够提高其对盐胁迫和渗透胁迫的耐受性,由此可知,NPC在ABA介导植物应激反应中起着重要作用[32]。在正常条件下,NPC4参与了DAG的生成并促使气孔开放,在外界胁迫下,ABA水平提高从而诱导NPC4生成DAG,DAG在DGK的作用下被磷酸化为PA,PA进一步促进ABA的积累从而导致气孔关闭[6]。
3.4 NPC在脂质代谢中的作用
在植物中,NPC负责生成进入细胞代谢途径的DAG和磷脂胆碱。虽然研究发现,磷脂胆碱在植物脂质代谢中并不起十分重要的作用,但是DAG却是脂质代谢中的关键中间产物[12]。在植物体中,DAG可以从甘油-3-磷酸代谢途径中生成,也可以通过磷脂酶水解细胞膜磷脂获得[53]。由于DAG具有疏水性,植物体中生成的DAG通常会结合在细胞膜上,细胞膜上的酶系统被用来精确地控制其运转[54]。根据其来源和细胞位置的不同,DAG的脂肪酸组成可以发生变化并由明显不同的C18/C16和C18/C18构成。在植物中,DAG的主要功能是作为甘油脂代谢的前体物质。然而,不同细胞的DAG同时也参与了膜糖脂类、硫脂类、其他脂类的合成以及储存类三酰基甘油的生物合成。在内质网中,DAG主要作为PC和PE合成的底物;而在质体包膜中,DAG被转变为单酯基二酰基甘油(MGDG)和硫脂类物质[55-56]。DAG还可以通过2步转化为环二膦酸-二酰基甘油,这对光合作用和磷脂酰肌醇、磷脂酰甘油及双磷脂酰甘油的生物合成具有重要意义[57]。
有直接证据表明,在植物体中NPC能够影响DAG的生成和其他脂类的平衡。与野生型相比,拟南芥npc4突变体在叶片中积累DAG的量较少[6]。在磷酸盐缺乏的条件下,拟南芥npc4突变体的DAG生成量也显著减少[11]。然而,在正常的條件下,npc4突变体产生的DAG分子种类和其他脂质含量的总体分布并没有显著变化[6]。体外活性测定表明,NPC5的活性明显低于NPC4,然而在缺磷的条件下,叶片中NPC5主要负责生成DGDG[14]。在拟南芥npc5突变体中虽然半乳糖脂的脂肪酸组成有所变化,但是半乳糖脂的含量和主要膜磷脂的含量并没有改变[14]。
一些由DAG衍生的脂类似乎与植物激素的感知和抗逆性有关。当拟南芥突变体缺乏DGDG合成酶时,在使用DAG作底物时表现出较差的耐热性[58]。DAG衍生的SQDG脂类在植物的盐胁迫中起着至关重要的作用[59]。DAG也可以通过DGK转化为PA,进而参与茉莉酸的生物合成[60]。
此外,由NPC水解生成的磷酸胆碱可以产生游离胆碱,而游离胆碱的生成能够促进甜菜碱[61]和胆碱-邻硫酸盐[62]的生物合成。
3.5 NPC在信号转导中的作用
DAG在动物中的研究相对透彻,在动物细胞信号转导中主要作为第二信使分子激活蛋白激酶C(protein kinase C,PKC),再由PKC激活细胞信号转导的级联放大反应[63-64]。PKC广泛存在于动物细胞中,属于典型的丝氨酸/苏氨酸激酶家族,其在N端调控域中存在1个DAG/磷脂结合的C1位点,该位点能够被DAG分子强烈激活[65]。现在还没有直接证据表明植物蛋白激酶存在类似于动物PKC的C1位点。然而,在许多拟南芥蛋白中推测出富含半胱氨酸和组氨酸的DAG结合位点,这其中包括PKC-like(protein kinase C-like-IPR002219)、C1-like位点(C1-like domain-IPR011424)和DC1(plant-specific‘divergent C1domain-IPR004146)等蛋白[12]。还发现了DGKs和包含锌指及PHD锌指结构域的蛋白,这些蛋白通过与DNA、RNA或者其他蛋白相结合从而执行调节功能。另外,还从烟草中鉴定出识别胁迫响应蛋白NtDC1A和NtDC1B[66],从小麦种鉴定出胁迫响应蛋白TaCHP[67]。在大麦和马铃薯的组蛋白甲基转移酶的核苷酸序列中发现了DAG结合位点,这为DAG在基因调控和信号转导中的作用提供了可靠依据[12]。
大量研究表明,动物体中PKCs参与细胞内信号转导、免疫应答调节、转录、细胞增殖和分化等活动[65]。然而,在拟南芥或者其他植物中,尽管已经鉴定出许多与动物PKC在结构和生物特性上相似的植物激酶,但是目前还没有发现与PKC类似的同源序列。从大豆和水稻中分别克隆出编码PVPK-1和G11A的蛋白激酶分析发现,它们具有PKC催化位点的特性,但是与PKC的催化结构域不同[68]。玉米中参与硝酸还原酶基因表达的PKC型酶的活性受Ca2+、佛波酯(PMA)、磷脂或二酰基甘油合成类似物的调控[69]。早期的研究表明,在玉米中PMA在有PS和钙存在的情况下激活了PKC-like酶的活性[70]。从白菜中纯化的蛋白激酶在遇到Ca2+、二酰基甘油、磷脂或PMA时表现出典型的PKC酶特征[71],使用PMA处理芥菜能够激活芥菜中PKC-like蛋白激酶的活性[72]。
DAG在植物中的信号作用并不明显,现仍处于争论阶段[73]。到目前为止,尚未在植物细胞中发现DAG应答蛋白[74]。Munnik研究发现,DAG是PIP2水解产物,可以迅速被磷酸化为PA,而PA在植物信号过程中起着至关重要的作用[75]。在某些植物体系中,DAG也可能作为一种信号分子存在。在蚕豆中的研究表明,新合成的DAGs能够引发细胞离子流动,从而促使气孔细胞的开放,这暗示DAG可能作为ABA信号调节的补充[76]。拟南芥Atlpp2-2突变体植株的磷脂酶活性很低,植株对ABA响应受到破坏并且积累大量的PA,这时候的DAG主要由PA的去磷酸化生成[77]。在紫露草中的研究间接表明,DAG参与调节雄蕊毛细胞的周期性生长[78]。由此可知,DAG可以作为植物细胞中的信号分子,但这种信号级联的分子性质仍有待阐明。
Arisz等研究发现,由PI-PLC分解得到的DAG和由NPC分解得到的DAG在脂肪酸的组成上可能存在差异,这使得它们在调控植物代谢的过程中可能起着不同的作用[79]。由NPC水解磷脂生成的DAG在DGK的催化下生成PA。PA是重要的第二信使,在植物代谢调控过程中,与PA结合的调控蛋白和蛋白激酶的成员是最为重要的[80]。有研究表明,植物在受到干旱、盐和ABA等非生物胁迫后,PA生成量均有所增加,而PA可由NPC水解磷脂获得的DAG经DGK催化获得,由此可知,NPC能够通过信号转导途径间接参与植物抵抗外界非生物胁迫的过程[75]。DGKs属于保守的脂质激酶,其主要作用是负责ATP介导的DAG磷酸化[79]。DGKs在真核生物中普遍存在,DGK的主要作用是调节DAG磷酸化为PA,从而将脂质代谢与信号转导连接起来[81]。然而,到目前为止,关于植物DGKs的功能和性质依然不是很清楚。
在ABA信号转导过程中,由DGK介导的DAG转化为PA研究得较为清楚[6]。冷胁迫处理拟南芥细胞发现,DGK是细胞中产生PA的主要原因[82]。与动物信号系统类似,DGKs通常被认为是DAG信号调节器而不是PA信号的调节器,植物中的DGK在调节DAG时可能具有非PA形成的胞内互补功能,因此其在信号和脂类生物合成中都有作用[83]。研究表明,在转基因烟草中过表达水稻DGK基因OsBIDK1增强了转基因烟草的抗病性[48]。使用DGK抑制剂R59022处理被真菌诱导子诱导的豌豆上胚轴组织,结果发现R59022处理能够增加植物抗毒素的积累[84]。使用R59022处理拟南芥幼苗,发现能够抑制幼苗根的伸长和生长[85],由此可知,DGKs在植物的应激反应和发育过程中都发挥作用。虽然DAG主要由NPC水解PC而来,且PA被认为是最重要的脂质第二信使,但是DGKs确是协调两者调控功能的主要因素。
4 展望
近年来随着研究的深入,对植物NPC的研究越来越多,对其功能了解也越来越清楚,人们发现植物NPC在调节植物生长发育、应对生物和非生物胁迫及信号转导的过程中起着至关重要的作用。然而,目前对于NPC的研究主要集中在模式植物擬南芥和水稻中,且研究相对较少。作为NPC的主要水解产物DAG,在动物体内已经明确其为一种脂质信使,但其在植物信号中的功能依然是一个未解之谜。最近的研究发现,DAG能够直接参与植物的信号转导,而不需要转化成PA,这将直接激起人们对DAG功能研究的兴趣,这其中最大的挑战是DAG下游靶物质的鉴定。目前,关于NPC的基因结构、生化特性、细胞定位及其生理功能的研究已经取得了初步成效,后续的研究将主要针对其水解产物DAG在信号转导中的作用以及NPC的一些其他功能上。对NPC基因功能的深入研究将进一步揭示植物生长发育以及抵抗不同外源胁迫后的生理反应,不仅能够填补NPC基因在这个领域的空白,也能够为利用基因工程手段改良植物抗逆性提供优质候选基因。
参考文献:
[1]Wang G L,Ryu S,Wang X M. Plant phospholipases:an overview[J]. Methods in Molecular Biology,2012,861:123-137.
[2]Hong Y Y,Zhao J,Guo L,et al. Plant phospholipases D and C and their diverse functions in stress responses[J]. Progress in Lipid Research,2016,62:55-74.
[3]Wang X. Plant phospholipases[J]. Annual Review of Plant Physiology and Plant Molecular Biology,2001,52(4):211-231.
[4]Macfarlane M G,Knight B C. The biochemistry of bacterial toxins:the lecithinase activity of Cl.welchii toxins[J]. Biochemical Journal,1941,35(8/9):884-902.
[5]Kates M. Hydrolysis of lecithin by plant plastid enzymes[J]. Canadian Journal of Biochemistry and Physiology,1955,33(4):575-589.
[6]Peters C,Li M Y,Narasimhan R,et al. Nonspecific phospholipase C NPC4 promotes responses to abscisic acid and tolerance to hyperosmotic stress in Arabidopsis[J]. Plant Cell,2010,22(8):2642-2659.
[7]Chrastil J,Parrish F W. Phospholipases C and D in rice grains[J]. Journal of Agricultural & Food Chemistry,1987,35(4):624-627.
[8]胡利芹,薛飛洋,李微微,等. 谷子非特异性磷脂酶C基因SiNPC4的克隆及功能分析[J]. 作物学报,2015(7):1017-1026.
[9]Song J L,Zhou Y H,Zhang J R,et al. Structural,expression and evolutionary analysis of the non-specific phospholipase C gene family in Gossypium hirsutum[J]. BMC Genomics,2017,18:979.
[10]孙大千,董金晔,李 洋,等. 磷脂酰肌醇特异性磷脂酶C基因研究进展[J]. 生物技术,2017(1):92-97.
[11]Nakamura Y,Awai K,Masuda T,et al. A novelphosphatidylcholine-hydrolyzing phospholipase C induced by phosphate starvation in Arabidopsis[J]. Journal of Biological Chemistry,2005,280(9):7469-7476.
[12]Pokotylo I,Pejchar P,Potocky′ M,et al. The plant non-specific phospholipase C gene family. Novel competitors in lipid signalling[J]. Progress in Lipid Research,2013,52(1):62-79.
[13]Felts R L,Reilly T J,Tanner J J. Structure of Francisella tularensis AcpA:prototype of a unique superfamily of acid phosphatases and phospholipases C[J]. Journal of Biological Chemistry,2006,281(40):30289-30298.
[14]Gaude N,Nakamura Y,Scheible W R,et al. Phospholipase C5 (NPC5) is involved in galactolipid accumulation during phosphate limitation in leaves of Arabidopsis[J]. Plant Journal,2008,56(1):28-39.
[15]Reddy V S,Rao D K V,Rajasekharan R. Functional characterization of lysophosphatidic acid phosphatase from Arabidopsis thaliana[J]. Biochimica et Biophysica Acta(BBA)-Molecular and Cell Biology of Lipids,2010,1801(4):455-461.
[16]Krcˇková Z,Brouzdová J,Daněk M,et al. Arabidopsis non-specific phospholipase C1:characterization and its involvement in response to heat stress[J]. Frontiers in Plant Science,2015,6:928.
[17]Krcˇková Z,Kocourková D,Daněk M,et al. The Arabidopsis thaliana non-specific phospholipase C2 is involved in the response to Pseudomonas syringae attack[J]. Annals of Botany,2018,121(2):297-310.
[18]Scherer G F E,Paul R U,Holk A,et al. Down-regulation by elicitors of phosphatidylcholine-hydrolyzing phospholipase C andup-regulation of phospholipase A in plant cells[J]. Biochemical and Biophysical Research Communications,2002,293(2):766-770.
[19]Nakamura Y,Ohta H. The diacylglycerol forming pathways differ among floral organs of Petunia hybrida[J]. FEBS Letters,2007,581(28):5475-5479.
[20]Pejchar P,Potocky′ M,Novotná Z,et al. Aluminium ions inhibit the formation of diacylglycerol generated by phosphatidylcholine-hydrolysing phospholipase C in tobacco cells[J]. New Phytologist,2010,188(1):150-160.
[21]Pejchar P,Potocky′ M,Krcˇková Z,et al. Non-specific phospholipase C4 mediates response to aluminum toxicity in Arabidopsis thaliana[J]. Frontiers in Plant Science,2015,6:66.
[22]Pejchar P,Martinec J. Aluminum ions alter the function of non-specific phospholipase C through the changes in plasma membrane physical properties[J]. Plant Signaling & Behavior,2015,10(6):e1031938.
[23]Pokotylo I V,Kretynin S V,Khripach V A,et al. Influence of 24-epibrassinolide on lipid signalling and metabolism in Brassica napus[J]. Plant Growth Regulation,2014,73(1):9-17.
[24]Nofer J R,Junker R,Seedorf U,et al. D609-phosphatidylcholine-specific phospholipase C inhibitor attenuates thapsigargin-induced sodium influx in human lymphocytes[J]. Cellular Signalling,2000,12(5):289-296.
[25]Liffourrena A S,Massimelli M J,Forrellad M A,et al. Tetradecyltrimethylammonium inhibits Pseudomonas aeruginosa hemolytic phospholipase C induced by choline[J]. Current Microbiology,2007,55(6):530-536.
[26]Munnik T,Irvine R F,Musgrave A. Phospholipid signalling in plants[J]. Biochimica et Biophysica Acta-Lipids and Lipid Metabolism,1998,1389(3):222-272.
[27]Andersson M X,Larsson K E,Tjellstrm H,et al. Phosphate-limited oat. The plasma membrane and the tonoplast as major targets for phospholipid- to-glycolipid replacement and stimulation of phospholipases in the plasma membrane[J]. Journal of Biological Chemistry,2005,280(30):27578-27586.
[28]Carter C,Pan S Q,Zouhar J,et al. The vegetative vacuole proteorne of Arabidopsis thaliana reveals predicted and unexpected proteins[J]. Plant Cell,2004,16(12):3285-3303.
[29]Singh A,Kanwar P,Pandey A,et al. Comprehensive genomic analysis and expression profiling of phospholipase C gene family during abiotic stresses and development in rice[J]. PLoS One,2013,8(4):e62494.
[30]Calderon-Villalobos L I,Kuhnle C,Li H,et al. LucTrap vectors are tools to generate luciferase fusions for the quantification of transcript and protein abundance in vivo[J]. Plant Physiology,2006,141(1):3-14.
[31]Ha K S,Thompson G A. Diacylglycerol metabolism in the green Alga Dunaliella salina under osmotic stress:possible role of diacylglycerols in phospholipase C-mediated signal transduction[J]. Plant Physiology,1991,97(3):921-927.
[32]Daniela K,Zuzana K,Prˇemysl P,et al. The phosphatidylcholine-hydrolysing phospholipase C NPC4 plays a role in response of Arabidopsis roots to salt stress[J]. Journal of Experimental Botany,2011,62(11):3753-3763.
[33]Peters C,Kim S C,Devaiah S,et al. Non-specific phospholipase C5 and diacylglycerol promote lateral root development under mild salt stress in Arabidopsis[J]. Plant Cell and Environment,2014,37(9):2002-2013.
[34]Illésˇ P,Ovecˇka M,Pavlovkin J,et al. Aluminium toxicity in plants:internalization of aluminium into cells of the transition zone in Arabidopsis root apices related to changes in plasma membrane potential,endosomal behaviour,and nitric oxide production[J]. Journal of Experimental Botany,2006,57(15):4201-4213.
[35]Matsumoto H. Cell biology of aluminum toxicity and tolerance in higher plants[J]. International Review of Cytology,2000,200:1-46.
[36]Rengel Z,Zhang W H. Role of dynamics of intracellular calcium in aluminium-toxicity syndrome[J]. New Phytologist,2010,159(2):295-314.
[37]Ramos-Díaz A,Brito-Argáez L,Munnik T A,et al. Aluminum inhibits phosphatidic acid formation by blocking the phospholipase C pathway[J]. Planta,2007,225(2):393-401.
[38]Charng Y Y,Liu H C,Liu N Y,et al. A heat-inducible transcription factor,HsfA2,is required for extension of acquired thermotolerance in Arabidopsis[J]. Plant Physiology,2007,143(1):251-262.
[39]Canonne J,Froidurenicolas S,Rivas S. Phospholipases in action during plant defense signaling[J]. Plant Signaling & Behavior,2011,6(1):13-18.
[40]Laxalt A M,Munnik T. Phospholipid signalling in plant defence[J]. Current Opinion in Plant Biology,2002,5(4):332-338.
[41]Albrecht U,Bowman K D. Gene expression in Citrus sinensis(L.)Osbeck following infection with the bacterial pathogen Candidatus Liberibacter asiaticus causing Huanglongbing in Florida[J]. Plant Science,2008,175(3):291-306.
[57]Haselier A,Akbari H,Weth A,et al. Two closely related genes of Arabidopsis encode plastidial cytidinediphosphate diacylglycerol synthases essential for photoautotrophic growth[J]. Plant Physiology,2010,153(3):1372-1384.
[58]Chen J P,Burke J J,Xin Z,et al. Characterization of the Arabidopsis thermosensitive mutant atts02 reveals an important role for galactolipids in thermotolerance[J]. Plant Cell and Environment,2006,29(7):1437-1448.
[59]Ramani B,Zorn H,Papenbrock J. Quantification and fatty acid profiles of sulfolipids in two halophytes and a glycophyte grown under different salt concentrations[J]. Zeitschrift Fur Naturforschung,2004,59(11/12):835-842.
[60]Bonaventure G,Schuck S,Baldwin I T. Revealing complexity and specificity in the activation of lipase-mediated oxylipin biosynthesis:a specific role of the Nicotiana attenuata GLA1 lipase in the activation of jasmonic acid biosynthesis in leaves and roots[J]. Plant Cell and Environment,2011,34(9):1507-1520.
[61]McNeil S D,Nuccio M L,Ziemak M J,et al. Enhanced synthesis of choline and glycine betaine in transgenic tobacco plants that overexpress phosphoethanolamine N-methyltransferase[J]. Proceedings of the National Academy of Sciences of the United States of America,2001,98(17):10001-10005.
[62]Rivoal J,Hanson A D. Choline-O-sulfate biosynthesis in plants (identification and partial characterization of a salinity-inducible choline sulfotransferase from species of limonium (Plumbaginaceae)[J]. Plant Physiology,1994,106(3):1187-1193.
[63]Yu Y,Halet G,Lai F A,et al. Regulation of diacylglycerol production and protein kinase C stimulation during sperm‐and PLCζ‐mediated mouse egg activation[J]. Biology of the Cell,2012,100(11):633-643.
[64]Halet G. PKC signaling at fertilization in mammalian eggs[J]. Biochimica et Biophysica Acta-Molecular Cell Research,2004,1742(1/2/3):185-189.
[65]Griner E M,Kazanietz M G. Protein kinase C and other diacylglycerol effectors in cancer[J]. Nature Reviews Cancer,2007,7(4):281-294.
[66]Shinya T,Gális I,Narisawa T,et al. Comprehensive analysis of glucan elicitor-regulated gene expression in tobacco BY-2 cells reveals a novel MYB transcription factor involved in the regulation of phenylpropanoid metabolism[J]. Plant and Cell Physiology,2007,48(10):1404-1413.
[67]Li C,Lv J,Zhao X,et al. TaCHP:a wheat zinc finger protein gene down-regulated by abscisic acid and salinity stress plays a positive role in stress tolerance[J]. Plant Physiology,2010,154(1):211-221.
[68]Lawton M A,Yamamoto R T,Hanks S K,et al. Molecular cloning of plant transcripts encoding protein kinase homologs[J]. Proceedings of the National Academy of Sciences of the United States of America,1989,86(9):3140-3144.
[69]Chandok M R,Sopory S K. ZmcPKC70,a protein kinase C-type enzyme from maize.Biochemical characterization,regulation by phorbol 12-myristate 13-acetate and its possible involvement in nitrate reductase gene expression[J]. Journal of Biological Chemistry,1998,273(30):19235-19242.
[70]Chandok M R,Sopory S K. Identification of phorbol myristate acetate stimulated kinase in Zea mays[J]. Journal of Plant Biochemistry & Biotechnology,1996,5(1):7-11.
[71]Nanmori T,Taguchi W,Kinugasa M,et al. Purificationand characterization of protein kinase C from a higher plant,Brassica campestris L.[J]. Biochemical & Biophysical Research Communications,1994,203(1):311-318.
[72]Deswal R,Chowdhary G K,Sopory S K. Purification and characterization of a PMA-stimulated kinase and identification of PMA-induced phosphorylation of a polypeptide that is dephosphorylated by low temperature in Brassica juncea[J]. Biochemical & Biophysical Research Communications,2004,322(2):420-427.
[73]Dong W,Lv H J,Xia G M,et al. Does diacylglycerol serve as a signaling molecule in plants?[J]. Plant Signaling & Behavior,2012,7(4):472-475.
[74]Almena M,Mérida I. Shaping up the membrane:diacylglycerol coordinates spatial orientation of signaling[J]. Trends in Biochemical Sciences,2011,36(11):593-603.
[75]Munnik T. Phosphatidic acid:an emerging plant lipid second messenger[J]. Trends in Plant Science,2001,6(5):227-233.
[76]Lee Y,Assmann S M. Diacylglycerols induce both ion pumping in patch-clamped guard-cell protoplasts and opening of intact stomata[J]. Proceedings of the National Academy of Sciences of the United States of America,1991,88(6):2127-2131.
[77]Paradis S,Villasuso A L,Aguayo S S,et al. Arabidopsis thaliana lipid phosphate phosphatase 2 is involved in abscisic acid signalling in leaves[J]. Plant Physiology and Biochemistry,2011,49(3):357-362.
[78]Larsen P M,Chen T L L,Wolniak S M. Neomycin reversibly disrupts mitotic progression in stamen hair cells of Tradescantia[J]. Journal of Cell Science,1991,98(2):159-168.
[79]Arisz S A,Testerink C,Munnik T. Plant PA signaling via diacylglycerol kinase[J]. Biochimica et Biophysica Acta(BBA)-Molecular and Cell Biology of Lipids,2009,1791(9):869-875.
[80]Testerink C,Munnik T. Molecular,cellular,and physiological responses to phosphatidic acid formation in plants[J]. Journal of Experimental Botany,2011,62(7):2349-2361.
[81]Merida I,Avila-Flores A,Merino E. Diacylglycerol kinases:at the hub of cell signalling[J]. Biochemical Journal,2008,409(1):1-18.
[82]Vaultier M N,Cantrel C,Vergnolle C,et al. Desaturase mutants reveal that membrane rigidification acts as a cold perception mechanism upstream of the diacylglycerol kinase pathway in Arabidopsis cells[J]. FEBS Letters,2006,580(17):4218-4223.
[83]Goto K,Hozumi Y,Nakano T,et al. Lipid messenger,diacylglycerol,and its regulator,diacylglycerol kinase,in cells,organs,and animals:history and perspective[J]. Tohoku Journal of Experimental Medicine,2008,214(3):199-212.
[84]Toyoda K,Kawahara T,Ichinose Y,et al. Potentiation of phytoalexin accumulation in elicitor-treated epicotyls of pea (Pisum sativum) by a diacylglycerol kinase inhibitor[J]. Journal of Phytopathology,2000,148(11/12):633-636.
[85]Gómez-Merino F C,Arana-Ceballos F A,Trejo-Téllez L I,et al. Arabidopsis AtDGK7,the smallest member of plant diacylglycerol kinases(DGKs),displays unique biochemical features and saturates at low substrate concentration:the DGK inhibitor R59022 differentially affects AtDGK2 and AtDGK7 activity in vitro and alter plant growth and development[J]. Journal of Biological Chemistry,2005,280(41):34888-34899.

