脉冲电磁场对模拟高原环境小鼠肝脏氧化应激的影响
翟明明,刘娟,罗二平,汤池
空军军医大学生物医学工程系,陕西西安710032
前言
在适应高海拔地区的低压低氧、寒冷以及太阳辐射增加等极端环境过程中,来自低海拔的个体会在代偿范围内发生多种代谢变化,但持续的缺氧会最终导致组织细胞缺氧损伤。越来越多的研究结果表明高海拔地区发生氧化应激(Oxidative Stress,OS)损伤严重,血浆和尿液等过氧化反应标志物活性升高明显,例如硫代巴比妥酸反应性物质、羟基壬烯醛、8-羟化脱氧鸟苷等[1-3]。过量的活性氧自由基产生易导致癌症、心肺疾病、肝脏疾病等[4-5]。高海拔地区因氧分压低而造成的组织缺氧会诱发肝脏氧自由基代谢紊乱,抗氧化剂超氧化物歧化酶(Superoxide Dismutase,SOD)活性降低,丙二醛(Methane Dicarboxylic Aldehyde,MDA)含量显著上升等,造成OS损伤[6]。目前文献报道研究多集中在高原脑、心、肺损伤等方面,而针对高原氧分压降低导致的肝脏损伤防治的研究相对匮乏。
脉冲电磁场(Pulsed Electromagnetic Field,PEMF)作为一种安全非侵入式物理干预手段,已经被用作药物治疗的替代方式,用于多种疾病的治疗研究。PEMF可以显著促进小鼠骨髓间充质干细胞的增殖和成骨分化[7]。PEMF可以降低活性氧自由基水平,增强成骨细胞的抗OS反应[8]。此外,PEMF还可以提高db/db小鼠血清SOD活性,降低MDA含量,改善肝脏OS[9]。然而,在低压低氧环境下诱发的肝脏OS反应,是否可以使用PEMF进行有效干预改善,尚不得而知。
本研究基于低压低氧舱模拟高原环境,建立缺氧性小鼠肝脏损伤动物模型,探究模拟高原低氧环境下PEMF对肝脏OS的影响,为将PEMF用于高原缺氧性肝脏损伤防治研究提供实验依据。
1 材料与方法
1.1 实验动物
动物实验获得空军军医大学动物伦理委员会批准。雄性SPF级小鼠15只,购自空军军医大学动物实验中心。动物在标准环境下饲养:12 h/12 h明暗交替,温度调节(22±1)℃,自由摄食、水。
1.2 主要仪器和试剂
二奎琳甲酸(Bicinchoninic Acid,BCA)蛋白定量试剂盒购自Thermo Scientific公司。抗体均购自Santa公司。ELISA试剂盒购自武汉华美生物工程有限公司。甘油三酯(Triglyceride,TG)、MDA、还原谷胱甘肽(Reduced Glutathione,GSH)/氧化型谷胱甘肽(Oxidized GSH,GSSG)定量试剂盒,以及肝脏过氧化氢酶(Catalase,CAT)、SOD和谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)活性检测试剂盒等均购自南京建成生物工程有限公司。
1.3 PEMF发生装置
如图1所示,PEMF发生系统主要由两部分构成:一部分为脉冲电磁发生器,另一部分为赫姆霍兹线圈(线圈直径20 cm,内绕80匝直径1 mm铜线,两个线圈的中心距离为10 cm)。该低强度PEMF发生装置通过电源电路供给强度调节电路和脉冲发生器,为整机提供电源,产生的脉冲信号经过开关功放电路至输出电路,另配有显示电路、保护电路和报警电路。该PEMF可以产生频率一定、强度可调的开放环路输出波形,通过赫姆霍兹线圈后,在线圈的中心部分形成场强相对均匀的PEMF,使用高斯计对线圈内部的磁场强度进行测定,磁场强度范围为0~30×10-4T连续可调(由陕西省产品质量监督检验所采用的数字特拉斯仪测定,陕检HY9501002号)。本实验选用输出为15.38 Hz的准脉冲群,脉冲群的刺激波形为5 ms延时(其中脉冲群为脉冲宽度0.2 ms,脉冲等待0.02 ms;之后60 ms的激发等待。脉冲上升0.3 μs,脉冲下降2.0 μs)。
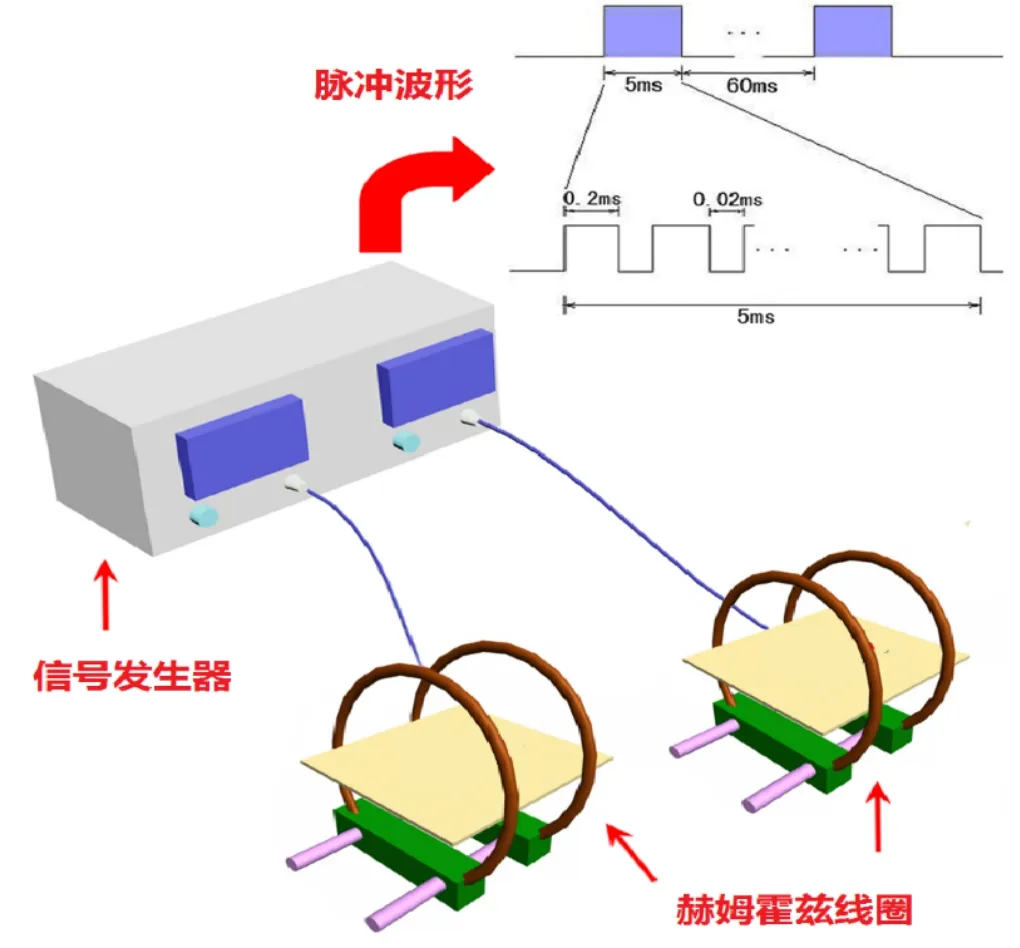
图1 PEMF发生装置原理图Fig.1 Schematic diagram of pulsed electromagnetic field generator
1.4 低压低氧动物肝脏OS模型建立及分组
标准小鼠常规饲养适应3 d后,将小鼠随机分为平原对照组(Control组)、低压低氧组(HH组)及PEMF干预组(PEMF组),每组5只。其中Control组置于当地海拔高度约400 m处(西安),将HH组与PEMF组置于低压低氧舱内。为了避免海拔的急剧改变对动物造成的影响,以10 m/s的速度控制海拔的上升和下降,模拟上升至6 000 m。PEMF组施加2 mT磁场干预,每天干预2 h。HH组不做任何处理,只暴露于低压低氧环境。缺氧处理5 d后,将小鼠处死,迅速解剖分离肝脏组织备用。实验过程中无小鼠死亡。
1.5 生化检测
为了测定MDA和抗氧化酶活性,肝脏样本用0.9%生理盐水在冰浴中按照100 mg:0.9 mL的比例进行匀浆处理;然后570 g离心10 min,按照试剂盒说明书收集上清液并进行检测。
对于GSH、GSSG的检测,同样将肝脏样本置于冰浴中,根据试剂说明按照200 mg:0.8 mL比例进行匀浆;然后1 120 g离心10 min,收集上清液并按照说明书进行检测。
1.6 蛋白印迹
肝脏组织样本使用RIPA裂解液在冰上进行裂解30 min,然后进行20 000 g离心,取上清,使用BCA蛋白检测试剂盒进行定量。蛋白样品加入上样缓冲液后,95℃加热5 min进行变性处理,然后按照常规SDS-PAGE方法进行检测。蛋白条带采用Quantity One软件进行定量。β-actin作为内参蛋白。
1.7 数据处理与统计学分析
实验数据以均数±标准差表示,用SPSS软件进行分析。方差齐性检验采用Levene检验。组间差异比较采用单因素方差分析(F检验)及SNK-q检验,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 PEMF对肝脏OS的影响
为了探究PEMF是否可以降低低氧诱发的肝脏OS水平,本研究检测了肝脏的MDA、GSH和GSSG水平,如图2所示。与HH组相比较,PEMF组的MDA和GSSG水平显著降低,而GSH水平显著上升。
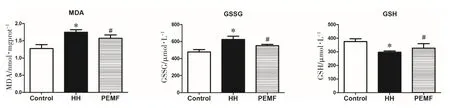
图2 PEMF对肝脏OS的影响Fig.2 Effects of pulsed electromagnetic fields on hepatic oxidative stress
2.2 PEMF对肝脏抗氧化酶活性的影响
本研究还对肝脏CAT、SOD以及GSH-Px这3种抗氧化酶活性进行了检测。结果显示,与HH组比较,PEMF组的CAT活性无统计学差异,SOD活性有上升趋势,GSH-Px活性显著上升(P<0.05),如图3所示。
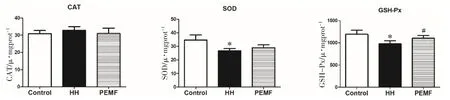
图3 PEMF对肝脏抗氧化酶活性的影响Fig.3 Effects of pulsed electromagnetic field on hepatic antioxidant enzyme activity
2.3 PEMF影响肝脏OS的机制
为了进一步探究PEMF改善模拟高原环境下小鼠肝脏损伤的分子机制,本研究对CAT、SOD1、SOD2和GSH-Px的蛋白表达水平进行了检测。与HH组比较,PEMF组GSH-Px蛋白表达水平显著提高,CAT、SOD1和SOD2蛋白表达水平无显著变化,如图4所示。
3 讨论
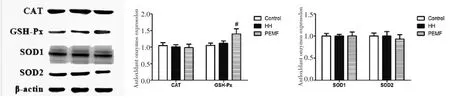
图4 PEMF对CAT、GSH-Px、SOD1和SOD2蛋白表达水平的影响Fig.4 Effects of pulsed electromagnetic fields on expression levels of CAT,GSH-Px,SOD1 and SOD2
高海拔地区具有低压低氧等显著气候特征,平原机体进入高原后可以通过自身代偿适应缺氧刺激,但持续缺氧最终会导致细胞、组织器官等代偿超出自身能力范围,造成线粒体、溶酶体等缺氧损伤。现有文献研究表明,高原住民体内的氧自由基存在一定程度上的紊乱,主要表现为SOD活性下降,而MDA活性升高,并且这一现象与海拔呈正相关,这可能是由于高原低压低氧等特殊环境因素的影响,致使机体内氧自由基产生增多,抗氧化剂SOD的消耗增加,大量氧自由基的长期刺激作用于细胞,最终造成组织细胞的损伤[4]。Irarrázaval等[10]发现急进高原海拔4 000 m,暴露于低压低氧环境易诱发急性高原反应,动脉血氧饱和度下降显著,暴露24 h后检测血清OS标志物结果显示,MDA活性显著升高,GSH-Px活性显著降低。Hefti等[11]将二烯酸等作为OS标记物,通过对海拔490、3 530、4 590和6 210 m的志愿者血液样本进行研究,发现二烯酸等OS标志物显著上升,并且与海拔高度呈正相关,表明低压低氧会导致机体的OS发生。肝脏作为机体最重要的代谢器官,具有特殊的血供,形成肝内的氧分压梯度代谢,使得肝脏对缺氧极为敏感[12]。既往的实验研究表明,高原病患者的肝功存在异常,并且与氧自由基存在密切关系[13-15]。OS损伤是大多数疾病的病理生理基础,低压低氧致使肝脏氧化-抗氧化系统的失衡,从而造成肝脏损伤。本研究中,通过模拟海拔6 000 m低压低氧环境,对肝脏OS标志物及抗氧化酶活性检测发现,HH组肝脏MDA、GSSG活性显著升高,而GSH活性显著降低,预示OS损伤的发生;SOD、GSH-Px活性降低,肝内抗氧化稳态发生失衡。这一结果与Nakanishi等[16]研究结果基本一致。
电磁场作为一种非电离、非侵入式的安全干预手段已被FDA所批准。但是电磁场干预所引起的生物效应根据电磁场的频率、场强、波形以及刺激时长等参数的不同,会导致完全不同的结果[17]。Zhang等[18]对不同波形电磁场作用于成骨细胞进行研究,结果显示矩形波电磁场可以有效增加成骨细胞增殖,但降低碱性磷酸酶活性;三角波电磁场可有效提高成骨细胞矿化结节的生成;然而正弦波电磁场显著抑制成骨细胞增殖,虽然致使碱性磷酸酶的活性升高,但成骨细胞矿化结节形成受到显著抑制;PEMF既促进成骨细胞增殖,又增强了成骨细胞矿化结节形成。Seyed等[19]发现100 μT和500 μT极低频电磁场会导致大鼠体内MDA活性增强。但Wang等[20]的研究结果却恰恰相反,PEMF可以提高CAT、SOD活性,通过调节改善炎症和OS来促进受伤脊髓功能恢复。崔红等[9]将PEMF作用于db/db小鼠进行干预,结果显示PEMF组肝脏MDA活性显著降低,GSH含量显著升高。本研究将PEMF作用于低压低氧环境下的小鼠,研究结果显示PEMF组降低了低压低氧诱发的肝脏OS标志物MDA的活性,降低了GSSG活性,但GSH活性升高,这预示着PEMF对OS平衡的调节。这一结果与Li等[21]研究结果相反,可能是由所用电磁场频率等参数的不同,电磁场的生物作用效果的窗口效应所导致。
为进一步探究PEMF改善肝脏OS的潜在机制,本研究对抗氧化酶蛋白表达进行了检测,结果显示GSH-Px蛋白表达上升,与其活性增强相对应;CAT、SOD1和SOD2蛋白表达均无显著差异。Demirtas等[22]研究发现,GSH-Px和对氧磷酶活性可以通过单独摄入一定剂量的褪黑素,以保护大鼠肝脏氧化损伤。GSH-Px作为重要的生理抗氧化剂,保护细胞免受活性氧诱导的氧化损伤[23-24]。本实验中GSH-Px蛋白响应PEMF刺激,表达上升,参与PEMF对OS进行调控。综上所述,PEMF会改善小鼠肝脏在模拟高原环境下的OS反应,增强GSH-Px抗氧化活性。下一步,课题组将从细胞水平对PEMF调控低压低氧诱发的OS的机制进行探究。

