大鼠肠淋巴液引流方法的改进
陈 杰,陈 淼
(遵义医科大学附属医院 重症医学科,贵州 遵义 563099)
研究证实,肠道作为全身炎症的源头[1],是多器官功能衰竭的发动机[2]。当肠道受到严重感染或炎症[3-4]、休克、创伤[5]以及烧伤[6-7]等致病因素作用后会发生缺血再灌注损伤(ischemia reperfusion injury,IRI),肠壁通透性增加,大量肠源性活性物质进入循环引起远隔器官损伤,甚至导致全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)及多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)。尽管肠缺血再灌注导致MODS的机制尚未明确,但通过肠淋巴管结扎和淋巴液引流可以阻断“肠-淋巴”途径,并能减轻IRI导致的局部炎性反应和远隔组织的损伤[8-10]。将失血性休克后肠系膜淋巴液经静脉注射至大鼠体内,可引起大鼠多器官功能损伤[11]。这些研究证实“肠-淋巴”途径在肠缺血再灌注后导致远隔器官损伤的病理生理过程中扮演重要的角色。因此,对肠淋巴液进行深入研究具有重要的意义。但动物模型肠淋巴液的获取难度大,在一定程度上限制了对肠淋巴液的深入研究。我们采用文献[12-13]的方法进行大鼠肠淋巴液引流,结果发现,肠淋巴干置管操作难度大,肠淋巴液引流成功率较低。因此,我们对文献中的方法进行改进,建立了一种操作简便、成功率高的大鼠肠淋巴液引流方法,现将操作方法介绍如下。
1 材料与方法
1.1 动物 SPF级雄性SD大鼠60只,体重500±50g,购于长沙天勤生物技术有限公司。随机分为文献组30只,改进组30只。大鼠适应性喂养7 d,术前自由进食及饮水。
1.2 实验材料 医用胶水(3M公司,美国);Elisa(检测LPS、TNF-α、IL-6、IL-4、IL-10)试剂盒(上海江莱生物科技有限公司);20G静脉留置针(洪达医疗器械有限公司);硅胶管(内外径分别为0.5 mm/1.0 mm,上海道冠橡塑五金有限公司);EP管(海门市瑞博实验器材厂);1%戊巴比妥钠(上海嶅稞实业有限公司)。
1.3 术前准备 所有手术器械、EP管(2 mL)、硅胶管(内外径分别为0.5 mm/1.0 mm)、移液枪头等均预先灭菌、去热原处理,EP管管盖预先钻一小孔,无菌状态下将静脉留置针延长管沿远端剪断,去掉单手夹,将延长管远端由小孔插入EP管内约5 mm,硅胶导管一端预先剪一45°斜面。
1.4 手术操作 两组开始部分相同的手术操作:经大鼠腹腔注射1%戊巴比妥钠(50 mg/kg)麻醉,麻醉显效后,大鼠腹部剃毛,取仰卧位固定于手术台上,腹部消毒铺巾后,行腹部正中切口,长约4 cm,将全肠道及网膜组织向大鼠左侧掀起,暴露肠系膜上动脉及肠淋巴干,在近下腔静脉处剪开浆膜。
文献组:钝性分离肠系膜上动脉及肠淋巴干。轻提大鼠肠淋巴干,用眼科剪轻剪一小口,待少量淋巴液流出的同时,用眼科镊夹住硅胶导管,将45°斜面置于开口处,然后顺着淋巴管走向缓慢往里送,待导管进入淋巴干管腔,有淋巴液流出时,用少量医用胶涂抹于右肾旁浆膜处,固定导管,以防脱出,缝合腹部切口。
改进组:以静脉留置针作穿刺针,肠淋巴干远端为穿刺点,顺着淋巴管走向缓慢将穿刺针置入肠淋巴干内,见有淋巴液进入穿刺针导管内,置入穿刺针约4 mm后保持穿刺针导管位置相对固定,缓慢拔出钢针,滴少许医用胶于穿刺点处固定穿刺针,以防脱出,缝合腹部切口,大鼠取左侧卧位便于淋巴液引流。穿刺置管后,以能持续引流出淡乳白色或乳白色的淋巴液作为评价引流成功的标准。
1.5 标本采集 引流肠淋巴液180 min,4℃、10 000×g离心10 min,取上清液,-80℃保存,待检。
1.6 检测指标 记录180 min淋巴液引流量,采用双抗体一步夹心法酶联免疫吸附实验(Elisa)检测两组淋巴液中LPS、TNF-α、IL-6、IL-4、IL-10水平。
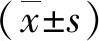
2 结果
文献组与改进组完成引流操作所用时间相近,约需20 min,两组均可由单人完成操作。改进组引流成功率(93.3%)高于文献组(73.3%),差异有统计学意义(P=0.04)。两组180 min淋巴液引流量相近,差异无统计学意义(P=0.44)(两组淋巴液引流情况见表1)。文献组与改进组淋巴液中LPS、TNF-α、IL-6、IL-4、IL-10水平相近,两组差异无统计学意义(P值均大于0.05)(两组淋巴液中活性物质水平见表2)。
表1两组淋巴液引流情况(n=30)

组别成功例数失败例数成功率引流量(mL)文献22873.3%1.67±0.25改进28293.3%∗1.72±0.16#
*:成功率与文献组比较,χ2=4.32,P=0.04;#:引流量与文献组比较,t=0.79,P=0.44。
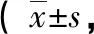
组别LPS(EU/mL)TNF-α(pg/mL)IL-6(pg/mL)IL-4(pg/mL)IL-10(pg/mL)文献6.32±1.3135.89±3.8621.13±3.3017.43±4.3516.84±3.42改进5.99±1.6336.02±4.4320.57±2.4516.77±3.8617.46±4.02t0.790.110.680.570.58P0.430.910.500.570.57
3 讨论
肠淋巴液在肠缺血再灌注后导致远隔器官损伤的病理过程中所起的重要作用受到越来越多研究者的重视。调节肠缺血再灌注后肠系膜淋巴的生物活性可减少全身炎症和终末器官损伤[14]。大鼠是作为研究肠淋巴液较好的实验动物,但大鼠肠淋巴干管壁薄,仅为数层上皮细胞构成,穿刺时很容易造成管壁损伤,导致淋巴液获取失败,所以大鼠肠淋巴液的获取一直以来都是一个难点。笔者在实验前查阅国内外相关文献,发现关于大鼠肠淋巴液获取方法的研究较少。目前仍以使用硅胶管行肠淋巴管穿刺置管为主[12-13]。笔者在实验前期采用该方法进行肠淋巴干穿刺置管引流,实验过程发现实际操作难度大,淋巴液引流成功率较低,经过反复实验,仍难提高成功率,按照文献的方法,笔者与同课题组人员经过反复练习,成功率仅能达到73.3%(22/30)。故在文献方法的基础上反复实验,做了如下改进:①将文献中的硅胶管改为静脉留置针作为穿刺针及引流管,因硅胶管质地较软,置管前需将淋巴管剪一小口,实际操作中很难把握所剪小口的大小。剪口太小,置管困难,剪口太大,置管后会出现淋巴液外漏。②在肠淋巴管剪口后,淋巴管内的淋巴液会很快流出,导致淋巴管塌陷,因肠淋巴干管壁非常薄,淋巴管塌陷后会增加置管难度。而选用静脉留置针作为穿刺针,不需要将淋巴管剪开,充分暴露出淋巴管后直接穿刺置管,淋巴管内因有淋巴液而变得比较充盈,穿刺操作简单,且穿刺孔与针管相匹配,不会出现淋巴液外漏现象。另外,若淋巴管内淋巴液较少,淋巴管充盈不佳,可用无创动脉夹夹闭肠淋巴干近心端,数分钟后,淋巴管便会变得充盈,使淋巴管穿刺变得更容易,穿刺成功后松开动脉夹,对淋巴管不会造成损伤,对后续实验无影响。③肠淋巴干置管后,将大鼠置于左侧卧位,有利于淋巴液引流。④文献中所选实验大鼠体重为300±20g,本课题组所选大鼠体重为500±50g。因大鼠肠淋巴干较细,体重小的大鼠与体重大的大鼠相比,肠淋巴干更细,穿刺置管难度更大,穿刺成功率更低,故选择体重较大的大鼠更有利于实验。⑤在既往的大部分文献中,大鼠术前禁食6~12 h,不禁饮,在本实验中,我们尝试不对大鼠禁食,大鼠术前均自由进食及饮水。实验证实,进食并未影响手术操作,也未导致大鼠呕吐、窒息,反而可能使大鼠肠道血循环更丰富,肠淋巴液生成更多,单位时间内肠淋巴液引流量更多。按照改进的方法,穿刺成功率明显提高,达到93.3%(28/30)。30只大鼠仅有2只穿刺失败,其中一只穿刺后未引流出淋巴液,可能是穿刺针管尖端贴壁,导致堵塞,另一只因穿刺后穿刺针管固定不牢,导致穿刺针管滑脱,其余28只老鼠均成功穿刺置管,持续引流出淋巴液。
本课题组后期将研究肠缺血再灌注后肠淋巴液导致远隔器官损伤的机制,故在肠淋巴液引流成功后选择观察180 min肠淋巴液引流量及检测淋巴液中活性物质(LPS、TNF-α、IL-6、IL-4、IL-10)的水平,结果显示,引流成功后,两组大鼠180 min肠淋巴液引流量相近(P=0.44),两组淋巴液中活性物质的水平均无明显差异(P值均大于0.05),表明引流方法改进后对大鼠淋巴液引流量及淋巴液中活性物质的水平无明显影响。
经改进方法后,操作更简便、肠淋巴液引流成功率更高,有利于大鼠肠淋巴液引流模型的建立及后续实验。
- 遵义医科大学学报的其它文章
- PAX1甲基化与蛋白检测在宫颈鳞癌及上皮内病变中的应用价值分析
- Phylogenetic characteristics and population genetic diversity of 15 autosomal STR loci in Tujia population of Guizhou of China
- IL-6与GATA-6在肺动脉高压大鼠肺组织中的表达及意义
- Effects of icariside II on hepatic cytochrome P450 expression in mice
- 过表达Nrf2对氧化应激状态下骨髓间充质干细胞凋亡的保护作用
- 九香虫水提液对锰中毒大鼠睾丸损伤的抗凋亡作用

