PARMS在水稻基因编辑后代基因分型中的应用研究
律文堂 尹静静 阴筱 徐国鑫 吴小宾 李效尊 吴修


摘要:基因编辑技术为植物基因功能研究和作物遗传改良提供了有效途径。目前基因编辑植株基因分型多采用PCR/RE法、PAGE检测法、Sanger测序法等手段,但这些方法存在操作复杂、耗时长或成本高等问题。PARMS技术(penta-primer amplification refractory mutation system,五引物扩增受阻突变体系)是最新开发出的基于荧光检测的SNP基因分型方法,具有操作简便、耗时短、成本低的优势。本研究利用PARMS技术对水稻CRISPR/Cas9基因编辑植株进行了基因分型,鉴定结果与PAGE检测和Sanger测序法一致,证明PARMS技术可用于水稻基因编辑植株后代基因分型,也为其它作物基因编辑后代基因分型技术选择提供了参考。
关键词:水稻;基因编辑;基因分型;五引物扩增受阻突变体系(PARMS)
中图分类号:S511.035.3文献标识号:A文章编号:1001-4942(2019)10-0008-06
Application of PARMS Technology in Genotyping of
Rice Gene Edited Progeny
Lü Wentang, Yin Jingjing, Yin Xiao, Xu Guoxin, Wu Xiaobin, Li Xiaozun, Wu Xiu
(Shandong Rice Research Institute/ Hydrobiology Research Center, Shandong Academy of Agricultural Sciences, Jinan 250100, China)
Abstract Gene editing technology provides an effective method for plant gene function research and crop genetic improvement. At present, genotyping of gene edited plants often adopts PCR/RE, PAGE or Sanger sequencing methods, which have disadvantages such as complicated operation, long time consuming or high cost. PARMS (Penta-primer amplification refractory mutation system) technology is a newly developed SNP genotyping method based on fluorescence detection, which has the advantages of simple operation, short time consuming and low cost. In this study, the rice CRISPR/Cas9 gene edited plants were genotyped by PARMS and the results were consistent with that detected by PAGE and Sanger sequencing methods, which proved that PARMS technology could be used for genotyping of rice gene edited progeny. This study also provided a reference for the selection of genotyping techniques of other crops.
Keywords Rice; Gene editing; Genotyping; Penta-primer amplification refractory mutation system (PARMS)
突变体是研究基因功能和进行作物新品种选育的重要材料,获得突变体的传统办法主要依靠自然突变、物理或化学诱变及T-DNA随机插入等手段,但这些手段存在突变效率低、突变位点随机等缺陷。基因编辑技术可以在特定的位点引入核苷酸变异,能够实现基因定点编辑从而高效地获得目标突变体,其快速发展与应用为植物功能基因研究和作物遺传改良提供了重要的技术支撑[1]。CRISPR/Cas9技术由于具有载体构建过程简单、编辑效率高等优点,已成为当前主流的基因编辑技术,在拟南芥、水稻、玉米、小麦、烟草等植物基因编辑研究中被广泛应用[2-4]。
从基因编辑植株后代中获得靶基因纯合突变体是遗传和育种研究中的重要环节,其筛选工作量往往较大。目前鉴定基因编辑纯合体的主要方法有PCR/RE法(polymerase chain reaction / restriction enzyme assay)、PAGE检测法、Sanger测序法、高通量测序法、HRM法(high-resolution melting analysis)、ACT-PCR法(annealing at critical temperature PCR)等[5,6],其中PCR/RE、PAGE和Sanger测序法最为常用,但存在操作复杂、耗时长或成本高等缺点。
PARMS技术(penta-primer amplification refractory mutation system,五引物扩增受阻突变体系)是基于ARMS技术(tetra-primer amplification refractory mutation system,四引物扩增受阻突变体系)[7]开发的一种SNP基因分型技术,该技术利用五条引物(一对通用荧光引物、一对等位基因特异引物和一条反向共用引物)对SNP或短Indel位点进行等位基因特异性扩增,通过荧光扫描进行基因分型[8]。与PCR/RE、PAGE等需要电泳进行基因分型的传统方法相比,PARMS等基于荧光检测的基因分型方法具有操作简便、耗时短和成本低等优势,并且SNP及短Indel位点均能检测。CRISPR/Cas9技术利用序列特异性核酸酶在靶基因PAM序列(protospacer-adjacent motif)上游3 bp位置上产生一个切割位点,随后进行非同源末端连接修复,产生随机的短Indel突变[5],基因编辑位点的突变形式大部分情况下是1 bp的插入,小部分为短片段缺失[1,3,9]。因此,理论上PARMS技术可以用于基于CRISPR/Cas9技术基因编辑后代的基因分型和纯合体鉴定,但目前尚未有该技术应用于基因编辑植株基因分型的报道。
3 讨论与结论
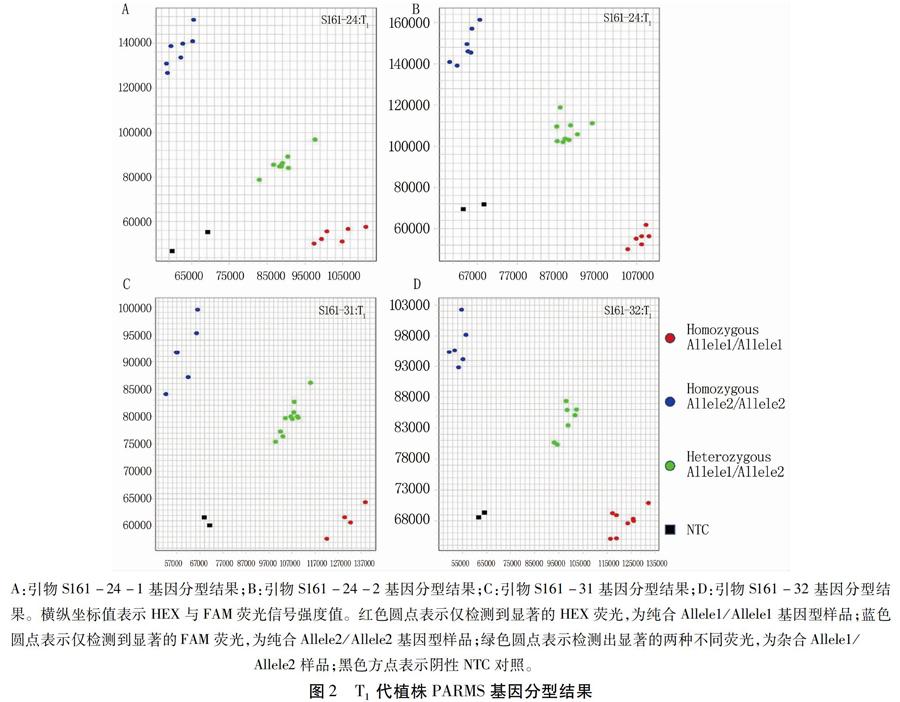
本研究结果表明PARMS技术可用于水稻CRISPR/Cas9基因编辑后代的基因分型,为水稻基因编辑纯合体鉴定提供了一种操作简便、耗时短和成本低的方案。
利用基因编辑技术对二倍体植物进行基因编辑后,植株多产生简单突变。为了获知靶点的突变情况,用特异引物对包含靶点序列的DNA片段扩增后测序,测序峰图可直接通过在线工具DSDecode解码[10]。该方法可以简化基因编辑T0代株系的检测流程,不用再进行繁琐的TA克隆测序,提高了T0代基因分型效率。基因编辑T1等后代植株基因分型是筛选基因编辑纯合突变体的手段,传统的PCR/RE法、Sanger测序法等存在操作复杂、耗时长或成本高等不足。特别是随着从多位点敲除的基因编辑株系后代中筛选多基因纯合突变单株,筛选工作量及成本较单基因敲除将呈指数级增长,更加需求高效低成本的基因分型技术。PARMS技术可以把基因编辑位点处产生的短Indel转化为SNP来检测,针对每个检测位点仅需要合成三条普通引物,且扩增程序只需在普通PCR仪上进行,PCR产物经荧光信号值扫描即可实现基因分型[8]。将DSDecode解码技术与PARMS技术结合,提高了基因编辑后代的鉴定效率,降低了试验成本,为作物遗传和分子育种研究中基因编辑材料的鉴定提供了一种新的技术选择。
参 考 文 献:
[1]刘耀光,李构思,张雅玲,等. CRISPR/Cas植物基因组编辑技术研究进展[J]. 华南农业大学学报, 2019, 40(5):38-49.
[2]Belhaj K, Chaparro-Garcia A, Kamoun S, et al. Editing plant genomes with CRISPR/Cas9[J]. Current Opinion in Biotechnology, 2015, 32:76-84.
[3]Ma X, Zhang Q, Zhu Q, et al. A robust CRISPR/Cas9 system for convenient, high-efficiency multiplex genome editing in monocot and dicot plants[J]. Molecular Plant, 2015,8(8):1274-1284.
[4]Yang B, Bi H, Zhou H, et al. Demonstration of CRISPR/Cas9/sgRNA-mediated targeted gene modification in Arabidopsis, tobacco, sorghum and rice[J]. Nucleic Acids Research, 2013,41(20):e188.
[5]Cong L, Ran F A, Cox D, et al. Multiplex genome engineering using CRISPR/Cas systems[J]. Science,2013,339 (6121):819-823.
[6]Hua Y, Wang C, Huang J, et al. A simple and efficient method for CRISPR/Cas9-induced mutant screening[J]. Journal of Genetics and Genomics, 2017,44(4):207-213.
[7]Ye S, Dhillon S, Ke X, et al. An efficient procedure for genotyping single nucleotide polymorphisms[J]. Nucleic Acids Research, 2001, 29(17):e88.
[8]Zhang B, Zhao N, Liu Y, et al. Novel molecular markers for high-throughput sex characterization of Cynoglossus semilaevis[J]. Aquaculture, 2019: 734331.
[9]Feng Z, Mao Y, Xu N, et al. Multigeneration analysis reveals the inheritance, specificity, and patterns of CRISPR/Cas-induced gene modifications in Arabidopsis[J]. Proceedings of the National Academy of Sciences, 2014,111(12):4632-4637.
[10]Liu W, Xie X, Ma X, et al. DSDecode: A web-based tool for decoding of sequencing chromatograms for genotyping of targeted mutations[J]. Molecular Plant, 2015,8(9):1431-1433.
收稿日期:2019-08-10
基金項目:国家自然科学基金项目(31601650);山东省农业科学院青年英才培养计划项目;山东省农业科学院农业科技创新工程项目(CXGC2018E16);杂交水稻国家重点实验室(武汉大学)开放课题基金项目(KF201902)
作者简介:律文堂(1982—),男,博士,助理研究员,研究方向为分子遗传学。E-mail:lvwentang2015@163.com
通讯作者:李效尊(1979—),男,博士,副研究员,研究方向为水生植物栽培与育种。E-mail:xiaozunli@163.com
吴修(1965—),男,研究员,研究方向为作物栽培与育种。E-mail:wuxiu9090@163.com

