黑龙江生态条件下马铃薯不同叶位叶片光合特性
钱创建 李庆全 南相日 张微 张丽娟 牛志敏 夏善勇 解艳华 盛万民
摘要:为黑龙江生态环境下马铃薯高光效育种研究提供光合生理参数,利用GFS-3000和MINI-PAMA-Ⅱ对马铃薯新品种克新23号不同生育时期不同叶位叶片的光合特性分布规律进行了研究。结果表明,克新23号单株叶片鲜质量、干质量和叶面积随生育进程逐渐增加,块茎膨大期达到最大值。块茎膨大期克新23号上部叶位叶片的SPAD值最大,中部和下部叶位叶片的SPAD值较上部叶位叶片降低3.52%和9.50%。现蕾期和开花期Pn、Tr和Gs的最大值均出现在上部叶位叶片上,块茎膨大期Pn、Tr和Gs的最大值出现在植株中部叶位叶片,说明叶片Pn的高低也受非气孔因素限制。同时,结合Pn和不同叶位叶片叶绿素荧光特性的分布规律,选择PSⅡ实际光合量子产量Y(Ⅱ)和 PSⅡ 电子传递速率(ETR)来作为快速评价马铃薯光合潜能的指标是可行的。
关键词:高光效育种;光合特性;马铃薯;叶位
中图分类号:S532.01 文献标志码: A
文章编号:1002-1302(2019)19-0089-06
收稿日期:2018-07-12
基金项目:黑龙江省农业科学院博士后科研及管理经费项目。
作者简介:钱创建(1982—),男,湖北荆门人,博士,主要从事马铃薯遗传育种研究。E-mail:qianchjian366@163.com。
通信作者:盛万民,博士,研究员,主要从事马铃薯遗传育种及良种繁育研究。E-mail:shengwanmin@163.com。
由于全球人口的增长及土地利用方式的转变,预计到2050年世界粮食生产量至少还要增加50%[1],这势必对主要粮食作物(如水稻、小麦等)产量的增加提出了更高的要求。然而,自20世纪60年代以来靠株型形态改良和水肥投入的增加来维持作物产量的手段已无法满足粮食的可持续发展。作物生物量的形成对产量的增加是一个重要的限制因子,Murchie等认为,通过增强作物叶片和冠层光合作用,提高光能转化生物量的效率,才能适合于未来“精准农业”的发展[1]。关于作物叶片光合速率与产量的关系,一直存在很多争议[2-4],甚至有的研究表明光合作用还限制了作物的产量[5-6],Long等认为,这可能是植物光合作用以外的其他遗传学方面因素造成的,并指出,现阶段提高作物产量潜力主要途径是提高光能转化生物量的效率,即提高植物叶片的净光合速率[7]。
马铃薯在缓解世界粮食安全和解决贫困国家及地区的食物资源中具有重要的作用[8]。中國是世界上马铃薯生产第一大国和消费大国,产量占世界总产量的1/4左右[9],为实现主粮种类多样化、营养多元化、提升粮食安全水平,2015年1月农业部正式启动了马铃薯主粮化战略。黑龙江省地处我国高寒特殊地区,具有马铃薯生育季节光照时间长、强度高、昼夜温差大利于光合作用及干物质积累等特点,在我国马铃薯科研、生产与加工方面均具有重要的地位,为中国马铃薯事业发展做出了显著贡献[10],但由于品种遗传基础狭窄、光合效率低(低于1%),导致黑龙江省马铃薯平均单产水平低(<25 t/hm2)、淀粉含量低(<13.53%)、适于加工品种种植比例较低等诸多问题。前人尽管对马铃薯的光合作用研究较多[11-16],但是大都是针对各自不同区域、不同品种之间的比较,缺乏普遍性,深入研究马铃薯的光合作用相较于其他作物来说相对较少[17-22]。
因此,本研究针对黑龙江省的特殊生态区域性,通过对适宜该地区的早熟、高产、抗病、鲜食马铃薯新品种克新23号的光合作用规律进行较为详实的分析,阐明该地区马铃薯各时期不同叶位叶片光合特性变化趋势,以期为马铃薯光合作用生理机制提供全面认识,进一步为马铃薯的高光效育种提供参考。
1 材料与方法
1.1 试验地概括
本试验于2017年在黑龙江省农业科学院国家现代农业示范区(45°41′N,126°37′E)进行,位于松嫩平原东部,典型的中温带大陆性季风气候,春季多风、降水量少,夏季温暖多雨,冬季寒冷降水量较少,干燥,海拔约200 m以下,日温、年温差大,最高温度41 ℃,最低温度-40 ℃,年平均气温3.5 ℃,积温2 556 ℃,无霜期136 d左右,年降水量533 mm,主要集中在6—8月,占全年的80%以上。该地区属于一年一熟制。试验地土壤为黑钙土,地势平坦,土层深厚。土壤有机质含量为31.4 g/kg、碱解氮含量为127.4 mg/kg、有效磷含量为 15.6 mg/kg、速效钾含量为167 mg/kg,pH值为6.8。
1.2 试验材料与设计
马铃薯品种为普通栽培品种克新23号(2n=4x=48),以克新4号为母本、奥拉(Aula)为父本,经有性杂交系统选育而成。该品种表现早熟,生育期仅70 d左右,具有抗PVY、中抗PVX病毒病、高产等优点,且营养丰富,淀粉含量为11.8%~14.4%,维生素C含量为每100 g鲜薯9.64~20.53 mg,粗蛋白含量为1.70%~2.62%[23]。
试验采用垄作栽培,种植密度为50 000株/hm2,小区行长8.0 m,行距为0.8 m,株距为0.25 m。于5月4日起垄播种,播种前选取单芽薯块点播,用种量为2 250 kg/hm2。播种前施有机肥15 t/hm2,播种时施复合肥(磷酸二铵) 1 050 kg/hm2,拔节时追施尿素4 500 kg/hm2,田间管理同大田生产。
1.3 测定项目与方法
1.3.1 SPAD值测定 随机选取3株有代表性的植株标记,使用日产SPAD-502叶绿素仪在苗期、现蕾期、开花期晴朗无云天气上午09:00—11:00测定马铃薯植株上部(上数倒数第3~4张叶,Up)、中部(上数倒数第7~8张叶,Middle)、下部(上数倒数第10~11张叶,Lower)复叶相对叶绿素含量[24-25]。每一侧生小叶及顶小叶测定7~8个不同点,取其平均值[16,21]。
1.3.2 光合参数的测定 各时期选择晴天08:30—11:30采用GFS-3000(Heinz Walz GmbH,Effeltrich,Germany)便携式光合作用-荧光测量系统对选取植株不同部位复叶的顶小叶进行测定。每张叶片重复3次,测定3株,取平均值。叶室采用人工光源,光量子通量设为1000 μmol/(m2·s),温度同外界25~30 ℃,相对湿度65%~70%[26]。
1.3.3 叶绿素荧光动力学参数测定 采用叶绿素荧光仪MINI-PAM-II(Heinz Walz GmbH,Effeltrich,Germany)与光合作用测定同步进行[27-28],测定前充分暗适应30 min。测定的荧光参数主要有初始荧光(Fo)、最大荧光(Fm)、光系统Ⅱ(PSⅡ)最大光合量子产量(Fv/Fm)、PSⅡ实际光合量子产量[Y(Ⅱ)]、PSⅡ电子传递速率(ETR)、光化学淬灭系数(qP)和非光化学淬灭系数(qN)。
1.3.4 叶面积(LA)测定 待各时期所有指标测定完成后,收集植株所有叶片,采用便携式激光叶面积分析仪CI-203(CID Biosciences Inc.,Camas USA)测定整株叶片面积,重复 4~5 次[29-30]。
1.3.5 叶片鲜质量和干质量测定 待样株叶面积测定完成后,迅速常规法测定叶片鲜质量,然后将叶片分株放在105 ℃杀青30 min,80 ℃烘干至恒质量,测定干质量[30]。
1.4 数据统计与分析
采用Microsoft Excel 2010整理数据、IBM SPSS 20.0(IBM Corp.,Armonk,NY,USA)统计分析软件处理数据,所有数据以平均值±标准误差表示。所有平均数之间的比较进行方差分析(ANOVA)(LSD,P<0.05)。采用OriginPro 8.0绘图。
2 结果与分析
2.1 不同生育时期克新23号叶片鲜质量和干质量的变化
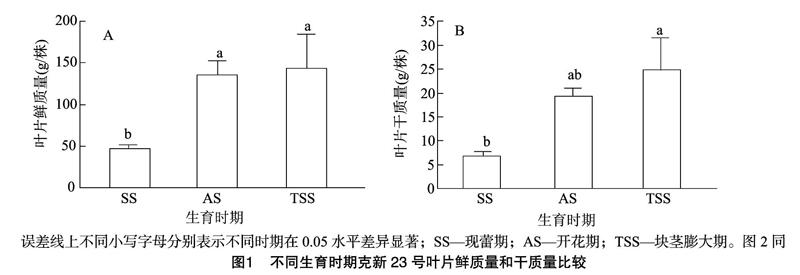
克新23号叶片鲜质量随生育时期进程逐渐增加(P≤005),开花期之后,叶片鲜质量基本不再增加(P>0.05)(图1-A)。开花期和块茎膨大期整株叶片鲜质量分别是现蕾期叶片鲜质量的2.9倍和3.1倍。整个生育进程中,叶片干质量的变化与叶片鲜质量变化趋势相似(图1),开花期和块茎膨大期整株叶片干质量分别是现蕾期叶片干质量的2.8倍和3.7倍。
2.2 不同生育时期克新23号叶面积的变化
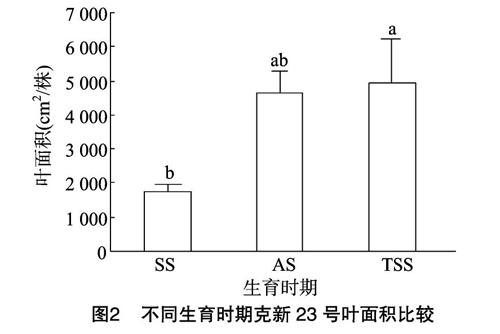
由图2可知,克新23号生育后期单株叶面积变化不大,开花期和块茎膨大期差异不显著(P>0.05)。现蕾期单株叶面积为1747.84 cm2/株,仅为开花期和块茎膨大期的379%和35.6%。
2.3 不同生育时期克新23号叶片SPAD值的变化
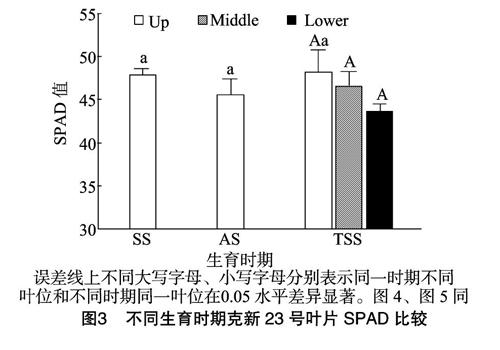
SPAD值可以代表作物叶绿素相对含量,在其他作物上有较为广泛的应用[31]。从图3可以看出,克新23号植株上部叶位叶片(Up)的SPAD值在整个生育时期呈现“V”形变化,块茎膨大期SPAD值最大。块茎膨大期马铃薯植株不同叶位叶片的SPAD值自上而下逐渐降低,植株中部叶位叶片(Middle)和下部叶位叶片(Lower)的SPAD值较上部叶位叶片的SPAD值分别降低了3.52%和9.50%。
2.4 不同生育时期克新23号叶片光合作用参数的变化
从图4-A可以看出,不同生育时期克新23号各部位葉片净光合速率(Pn)呈现不同趋势,现蕾期植株中部叶片Pn最低,上部叶片最大,下部叶片次之,上部叶片、下部叶片分别较中部叶片高489%和37.8%; 开花期Pn从植株上部至下部依次降低;块茎膨大期植株中部叶Pn最大,分别是植株上部叶和下部叶的2.0倍和2.8倍。
克新23号植株叶片的胞间CO2(Ci)浓度在现蕾期表现为中部叶位最大(图4-B),分别较上部叶位和下部叶位高14.4%和32.8%;开花期Ci表现为随植株叶位自上至下依次降低;块茎膨大期植株下部叶位Ci最大,较上部叶位和中部叶位分别高出21.4%和95.3%。
克新23号植株不同部位叶片蒸腾速率(Tr)在现蕾期和开花期均表现为随着叶位的降低呈下降的趋势(图4-C),块茎膨大期中部叶位的Tr最大,分别是上部叶位和下部叶位的1.3倍和1.7倍;叶片气孔导度(Gs)变化趋势同Tr(图4-D)。
2.5 不同生育时期克新23号叶片叶绿素荧光参数的变化
由图5-A可知,克新23号植株叶片Fv/Fm在各生育时期均随叶位的下降逐渐上升,下部叶片Fv/Fm分别较上部叶片中部叶片的Fv/Fm升高了8.8%、0.5%,16.1%、1.7%和10.6%、47%。克新23号植株叶片Y(Ⅱ)在开花期不同叶位间的表现趋势同Fv/Fm表现一致(图5-B),上部叶片最低,中部叶片次之,下部叶片最高,现蕾期和块茎膨大期则表现为随叶位下降而降低。植株各时期不同叶位叶片ETR在叶位间的表现趋势与Y(Ⅱ)的表现一致(图5-C),即开花期上部叶片ETR最低,中部叶片次之,下部叶片最高,现蕾期和块茎膨大期则表现为随叶位下降而降低。不同生育时期植株叶片qP在叶位间的表现趋势相同,自上而下逐渐降低(图5-D)。qN在不同生育时期各叶位间的表现较为复杂(图5-E),现蕾期中部叶片的qN最大,开花期上部叶片最大,块茎膨大期时下部叶片的qN最大。
2.6 克新23号发育过程各叶位光合贡献率
现蕾期克新23号植株不同部位叶片的光合贡献率差异不明显(P>0.05),此时期叶片光合贡献率表现为上部叶位>下部叶位>中部叶位;开花期各部位叶片的光合贡献率差异显著(P≤0.05),上部叶位>中部叶位>下部叶位;块茎膨大期叶片光合贡献率表现为中部叶位>上部叶位>下部叶位(P≤0.05)(表1)。
相同部位叶片的光合贡献率随生育期的进程也有所不同(表1)。上部叶位的叶片光合贡献率最大值出现在开花期,分别比现蕾期和块茎膨大期高出12.44%和46.19%;中部叶位叶片的光合贡献率在块茎膨大期最高,是现蕾期和开花期叶片光合贡献率的2.21倍和1.81倍(P≤0.05);克新23号植株下部叶位叶片的光合贡献率随生育期进程逐渐降低,且达到显著水平(P≤0.05)。
2.7 克新23号叶片位置与生育时期对光合特性的双因素方差分析
叶片位置和生育时期两因素对克新23号植株光合特性进行了双因子方差分析表明,叶位和生育时期的交互作用对净光合速率及光合贡献率有显著影响。叶位对光合贡献率及Fv/Fm有显著影响,生育时期仅对净光合速率指标具有显著影响(表2)。
3 讨论与结论
3.1 克新23号发育进程植株叶片鲜质量、干质量和叶面积变化
植物叶片性状与植株生物量密切相关,叶片是植物进行光合作用和蒸腾作用的主要器官,其面积和鲜质量、干质量大小反映了生长环境对营养生长的影响程度,是植物生理生化、遗传育种和栽培等方面研究经常考虑的重要内容[32-34]。准确掌握马铃薯叶面积与质量状况对合理控制田间栽培、获取优质高产马铃薯具有重要的意义。彭运生等研究表明,在扬花、出雌穗以前,玉米叶片鲜质量随着时间进程而增加,扬花、出雌蕊时鲜质量变化最大,之后又开始下降[35]。克新23号马铃薯品种在本研究中呈现相似的规律,单株叶片鲜质量、干质量和叶面积均随生长发育逐渐增加,生育后期(块茎膨大期)趋于稳定,差异不显著(P>0.05),最大值出现在开花期和块茎膨大期,说明这个时期块茎等库器官急需消耗营养物质来满足生长发育,此时叶片作为光合同化的主要源器官,只有提供最大量的光合作用产物,才能达到植株的最优化生长发育。同时叶片鲜质量、干质量和叶面积三者的变化规律相似,这与刘金环等的叶面积与叶片的鲜质量、干质量呈显著的正相关结论[32]一致。
3.2 克新23号发育进程中各叶位叶片光合特性与叶绿素荧光参数差异
光合作用是作物产量形成的原动力,研究作物光合特性对发挥光合生产潜力,提高产量具有重要意义[36]。植物叶片净光合速率受叶片自身和环境因素共同影响,不同叶位叶片叶肉细胞叶绿体超微结构不同,基粒片层数目、基质片层和基质随叶位的上升而增加,穗位叶最多,穗位叶的叶绿素含量和光合强度也高于其他叶位,这是被认为叶位间光合特性差异的内部因素[37]。从环境因素考虑,净光合速率主要受环境中有效辐射的影响,上部叶位处于较好的通风透光条件下,净光合速率普遍大于下位叶[38]。禾本科作物(玉米、水稻等)具有特殊的功能叶,与其他叶位叶片的叶宽、叶长、角度都有所不同,通常通过测定剑叶和穗位叶光合特性和性状来研究位叶对产量的作用[37,39],而马铃薯植株各叶位叶片形态差异较小,也未见有功能叶之说,所以本研究用马铃薯植株主茎上从下往上不同部位叶片来研究其光合特性。叶绿素含量的高低是反应光合作用强弱的一个主要指标[40],影响着马铃薯块茎品质和产量的形成[41-42]。SPAD值不仅与马铃薯叶片的全氮含量具有一定的正相关,还与叶绿素含量具有正相关,叶片SPAD值可以用来预测产量[43-45]。本试验研究表明,整个生育期中,克新23号植株上部叶片SPAD值最大值出现在块茎膨大期,同时下部叶位的SPAD值较上部和中部均小,这与肖关丽等对现蕾期马铃薯植株不同叶位的SPAD值测定规律[31]相似。关于不同叶位叶片的叶绿体超微结构的研究有待进一步进行。
叶片是组成马铃薯光合机构的主要部分,是形成产量的最活跃因素,再整个生育时期,叶片的形成与解体在不断进行[46]。本研究说明在不同生育时期,各位叶光合特性均有差异,并且同一叶位在各时期的也有明显变化。现蕾期,克新23号植株主茎叶片展开基本完毕,侧枝开始迅速伸长,叶面积显著增大,上部叶位叶片的Pn、Tr和Gs均最高,光合产物主要用于建造自身光合机构,然而此时期的Ci值并不高,说明现蕾期主茎上部叶片较高的Pn可能受非气孔因素所限,提高非气孔因素可能会提高叶片Pn[47]。此时期叶片光合贡献率也表现相似趋势,上部叶位>下部叶位>中部叶位。这与肖关丽等的研究结果[31]相似,此时期可能是侧枝叶片还没有迅速长出,没有遮盖,叶片透光透气性好,温度较高,并处于适龄期,生长代谢旺盛,利于光合作用的正常进行。在开花期,克新23号植株主茎叶片的Pn、Tr、Ci和Gs均表现为上部叶位>中部叶位>下部叶位,与光合贡献率表现出的规律一致。在块茎膨大期,主茎叶片已开始枯黄,侧枝叶面积达到最大值,所以主茎不同叶位叶片光合性能均较现蕾期和开花期低,而且这个时期中部叶片的光合性能相对较高。此时叶片叶龄较大,组织老化,开始衰老,叶片光合生理功能衰退,酶活性降低,致使叶片细胞内Ci积累。
叶绿素荧光参数可以反映PSⅡ的光合原初反应及光合机构内部状态[48]。本研究表明,克新23号植株叶片的 Fv/Fm 在各时期均表现为下部叶位最大,但是Y(Ⅱ)、ETR和qP在现蕾期上部叶位的数值最大,结合现蕾期Pn的表现,说明高效的光合作用不仅需要PSⅡ的光合潜能大,还需要有较高的实际光能转化效率、较高的PSⅡ相对电子传递速率及较高的PSⅡ反应中心开放度,因此现蕾期可以考虑采用Pn、Y(Ⅱ)、ETR和qP 4个指标的大小来代表植株光能转化能力,同时可选其进行光合荧光特性的横向比较。开花期植株下部叶位叶片的Fv/Fm、Y(Ⅱ)和ETR值最大,與Pn值表现相反,说明开花期上部叶位叶片较高的Pn值并没有受PSⅡ的限制,且即使拥有较完善的PSⅡ反应系统,Pn也未必达到最大值(下部叶),可能除了PSⅡ外,其他因素(如环境的适应性)对光合作用影响也很大。同时,考虑到Fv/Fm、Y(Ⅱ)和ETR表现的一致性,因此开花期可以考虑采用Fv/Fm、Y(Ⅱ)和ETR 3个指标的大小来代表植株光能转化能力,鉴于块茎膨大期植株地上部分处于逐渐衰亡期、干物质分配转运期及各项生理指标的复杂性,可参考前面时期指标的筛选来衡量其光合能力的大小。综上所述,对马铃薯光合潜能的快速评价,选择Y(Ⅱ)和ETR来作为指标是可行的,同时叶位和生育时期对其进行双因素方差分析也表明其是稳定可靠的(P>005)。
参考文献:
[1]Murchie E H,Pinto M,Horton P. Agriculture and the new challenges for photosynthesis research[J]. New Phytologist,2009,181(3):532-552.
[2]Evans L T,Dunstone R L. Some physiological aspects of evolution in wheat[J]. Australian Journal of Biological Sciences,1970,23(23):725-742.
[3]Sinclair T R,Purcell L C,Sneller C H. Crop transformation and the challenge to increase yield potential[J]. Trends in Plant Science,2004,9(2):70-75.
[4]Sheehy J E,Ferrer A B,Mitchell P L,et al. How the rice crop works and why it needs a new engine[C]// Charting new pathways to C4 rice. World Scientific, 2012:3-26.
[5]Evans L T. Crop evolution,adaptation and yield[M]. Cambridge:Cambridge University Press,1993:162.
[6]Evans L T. Greater crop production:whence and whither?[M]//Feeding a world population of more than eight billion people—a challenge to science. New York:Oxford University Press,1998:89-97.
[7]Long S P,Zhu X G,Naidu S L,et al. Can improvement in photosynthesis increase crop yields?[J]. Plant,Cell & Environment,2006,29(3):315-330.
[8]喻 艷. 马铃薯与茄子原生质体融合创制新资源研究[D]. 武汉:华中农业大学,2013.
[9]徐建飞,金黎平. 马铃薯遗传育种研究:现状与展望[J]. 中国农业科学,2017,50(6):990-1015.
[10]张丽娟,李庆全,牛志敏,等. 2014年黑龙江省马铃薯产业回顾及发展建议[C]//马铃薯产业与现代可持续农业(2015).黑龙江:中国作物学会马铃薯专业委员会,2015:60-63.
[11]何长征,刘明月,宋勇,等. 马铃薯叶片光合特性研究[J]. 湖南农业大学学报(自然科学版),2005,31(5):518-520.
[12]卢育华,刘金龙,李志英,等. 马铃薯光合作用的研究[J]. 山东农业大学学报(自然科学版),1997,28(2):141-145.
[13]栾运芳,王建林. 脱毒与未脱毒马铃薯叶片光合特性的比较研究[J]. 中国农业科学,2002,35(2):222-224.
[14]孙国琴,门福义,刘梦芸,等. 马铃薯丰产植株光合产物日变规律的研究(一)——干物率及其日变化[J]. 中国马铃薯,1991,5(3):129-133.
[15]张 伟,高世铭,王亚宏,等. 不同形态氮素比对马铃薯氮素分布、光合参数及产量的影响[J]. 甘肃农业大学学报,2009,44(6):39-43.
[16]张贵合,郭华春. 马铃薯不同品种(系)的光合特性比较与聚类分析[J]. 作物学报,2017,43(7):1067-1076.
[17]张文安. SPAD-501型叶绿素仪在测定水稻叶绿素含量中的应用[J]. 贵州农业科学,1991(4):37-40.
[18]王亚飞. SPAD值用于小麦氮肥追施诊断的研究[D]. 扬州:扬州大学,2008.
[19]童淑媛,杜震宇,徐洪文,等. 不同株型玉米叶片净光合速率差异研究[J]. 东北农业大学学报,2011,42(4):42-47.
[20]周治国,孟亚利,陈兵林,等. 麦棉两熟共生期对棉苗叶片光合性能的影响[J]. 中国农业科学,2004,37(6):825-831.
[21]罗 俊,张 华,陈由强,等. 能源甘蔗不同叶位叶片形态、光合气体交换及其与产量关系[J]. 应用与环境生物学报,2006,12(6):754-760.
[22]凌丽俐,彭良志,王男麒,等. 缺镁胁迫对纽荷尔脐橙叶绿素荧光特性的影响[J]. 生态学报,2013,33(1):71-78.
[23]盛万民,牛志敏,李凤云,等. 马铃薯新品种克新23号选育[J]. 中国马铃薯,2012,26(2):126-127.
[24]孙 芳,芶久兰,孙锐锋,等. 贵州气候条件下马铃薯的光合特征[J]. 贵州农业科学,2012,40(2):48-50.
[25]黄承建,赵思毅,王龙昌,等. 马铃薯/玉米套作对马铃薯品种光合特性及产量的影响[J]. 作物学报,2013,39(2):330-342.
[26]Fedoseeva G P,Voronin P Y,Bagautdinova R I. Leaf photosynthesis and tuber crop productivity in topinambourplants[J]. Russian Journal of Plant Physiology,2015,62(2):224-228.
[27]吕洪飞,皮二旭,王岚岚,等. 遮阴处理的白英光合作用和叶绿素荧光特性研究[J]. 浙江师范大学学报(自然科学版),2009,32(1):1-6.
[28]张元帅,冯 伟,张海艳,等. 遮阴和施氮对冬小麦旗叶光合特性及产量的影响[J]. 中国生态农业学报,2016,29(9):1177-1184.
[29]郝丽红,宋焕芝,于晓南. 6个芍药品种的光合生理特性及耐阴性分析[J]. 西北林学院学报,2016,31(1):31-35.
[30]姚允聪,王绍辉,孔 云. 弱光条件下桃叶片结构及光合特性与叶绿体超微结构变化[J]. 中国农业科学,2007,40(4):855-863.
[31]肖关丽,郭华春. 不同温光条件下马铃薯不同叶位叶SPAD值变化规律研究[J]. 中国马铃薯,2007,21(3):146-148.
[32]刘金环,曾德慧,Lee D K. 科尔沁沙地东南部地区主要植物叶片性状及其相互关系[J]. 生态学杂志,2006,25(8):921-925.
[33]马 驿,张 煦,李岚涛,等. 油菜叶面积和叶鲜质量估计研究[J]. 中国农学通报,2015,31(30):106-113.
[34]李秀启,李晓琳,李颜,等. 黄瓜叶面积测量方法的评价[J]. 长江蔬菜,2008(12):71-73.
[35]彭运生,齐孟文. 用XQ-0Ⅰ型鲜质量水分仪测定植物活体叶片鲜质量和内部含水量变化[J]. 中国农业大学学报,1986,12(4):417-422.
[36]官玲亮,吴 卫,郑有良,等. 红花蕾期不同叶位叶的光合特性及与产量的相关性[J]. 作物学报,2007,33(8):1352-1359.
[37]王群瑛,胡昌浩. 玉米不同叶位叶片叶绿体超微结构与光合性能的研究[J]. 植物学报,1988,30(2):146-150.
[38]陶奇波,白梦杰,孙秋瑾,等. 无芒隐子草种子发育过程中不同位置叶片的光合速率及重量与种子产量的相关性[J]. 草地学报,2017,25(3):516-522,528.
[39]于洪兰,王伯伦,王 术,等. 不同叶位叶片对水稻籽粒充实的影响[J]. 种子,2009(2):1-5.
[40]刘晓冰. 日本的作物生理研究[J]. 世界农业,1996(2):23-24.
[41]张宝林,高聚林,刘克礼. 马铃薯在不同密度及施肥处理下叶片叶绿素含量的变化[J]. 中国马铃薯,2003,17(3):137-140.
[42]苏云松,郭华春,陈伊里. 马铃薯叶片SPAD值与叶绿素含量及产量的相关性研究[J]. 西南农业学报,2007,20(4):690-693.
[43]Vos J,Bom M. Hand-held chlorophyll meter:a promising tool to assess the nitrogen status of potato foliage[J]. Potato Research,1993,36(4):301-308.
[44]Gianquinto G,Goffart J P,Olivier M,et al. The use of hand-held chlorophyll meters as a tool to assess the nitrogen status and to guide nitrogen fertilization of potato crop[J]. Potato Research,2004,47(1/2):35-80.
[45]Uddling J,Gelang-Alfredsson J,Piikki K,et al. Evaluating the relationship between leaf chlorophyll concentration and SPAD-502 chlorophyll meter readings[J]. Photosynthesis Research,2007,91(1):37-46.
[46]黑龍江省农业科学院马铃薯研究所.中国马铃薯栽培学[M]. 北京:中国农业出版社,1994.
[47]Qian C,Zhang W,Zhong X,et al. Comparative studies on the photosynthetic characteristics of two maize (Zea mays L.) near-isogenic lines differing in their susceptibility to low light intensity[J]. Emir J Food Agric,2017,29(4):300-311.
[48]朱延姝,张福珍,樊金娟,等. 玉米幼苗不同叶位叶片叶绿素含量和荧光参数特性研究[J]. 西南农业学报,2012,25(2):412-415.

