鲍芹根际乳酸菌的筛选及耐受性和抗氧化能力评价
于金慧 刘云鹏 徐贵祎 马德源 乌日娜 武俊瑞 黄超 张娟 尤升波 毕玉平


摘要:為筛选既有优良果蔬发酵特性又有利于人体肠道微生态平衡的功能性果蔬发酵专用益生菌,本研究以新鲜鲍芹根为试材,结合传统方法和分子生物学方法对其根际分离得到的乳酸菌进行鉴定,对筛选出产酸能力强、生长旺盛的菌株进行耐受性和抗氧化能力评价。经鉴定,分离得到的两株乳酸菌分别为植物乳杆菌(产酸能力强、生长旺盛)和戊糖片球菌。对植物乳杆菌进行人工模拟耐受性评价发现,该菌在pH值为2.5、3.5、4.5的人工胃液中处理3 h后菌量仍保持在106 CFU/mL以上;人工肠液培养2、3 h的存活率分别为155.9%、191.9%,4 h后菌种数量开始下降,存活率仍为35.7%;随盐浓度增加,该菌的存活率下降,但7.5 mg/mL的胆盐溶液和70 mg/mL钠盐溶液中菌量仍能维持在106 CFU/mL以上。抗氧化能力试验表明,该菌发酵上清液的DPPH自由基清除率可达91.8%,固形物醇提液的亚铁离子螯合能力比发酵上清液的高出13.7个百分点。综上,植物乳杆菌具有较好的耐受性和抗氧化能力,后期可用于益生菌相关产品的研发。
关键词:鲍芹;乳酸菌;植物乳杆菌;分离纯化;鉴定;耐受性;抗氧化能力
中图分类号:S636.3:TS201.3文献标识号:A文章编号:1001-4942(2019)11-0074-07
Screening and Evaluation of Tolerance and Antioxidant
Capacity of Lactobacillus in Baoqin Rhizosphere
Yu Jinhui1, Liu Yunpeng1,2, Xu Guiyi3, Ma Deyuan1, Wu Rina4, Wu Junrui4,
Huang Chao1, Zhang Juan5, You Shengbo1, Bi Yuping1
(1. Biotechnology Research Center, Shandong Academy of Agricultural Sciences, Jinan 250100, China;
2. College of Life Sciences, Shandong Normal University, Jinan 250014, China;
3. School of Medicine and Life Sciences, University of Jinan-Shandong Academy of Medical Sciences, Jinan 250200, China;
4. College of Food Science, Shenyang Agricultural University, Shenyang 110866, China;
5. Shandong Institute for Product Quality Supervision and Inspection, Jinan 250100, China)
Abstract In order to screen out the special probiotics for functional fruit and vegetable fermentation, which not only have excellent fermentation characteristics, but also are benefit to the intestinal microecological balance of human body, the fresh Baoqin roots were used as the test material in this study, and the acid-producing bacteria isolated from its rhizosphere were identified by traditional methods and molecular biological methods, and the strains with strong acid production ability and vigorous growth were screened out for tolerance and antioxidant ability evaluation. The two bacteria were identified as Lactobacillus plantans and Gluconococcus glutinosa. The tolerance test showed that the amount of Lactobacillus plantatus remained above 106 CFU/mL treated in simulated gastric fluid with pH value as 2.5, 3.5 and 4.5 respectively after 3 hours. The survival rate of simulated intestinal fluid cultured for 2 hours and 3 hours was 155.9% and 191.9%, respectively. After 4 hours, the number of bacteria began to decline and the survival rate was still 35.7%. With the increase of salt concentration, the survival rate of bacteria decreased, but the bacteria content in 7.5 mg/mL bile salt solution and 70 mg/mL sodium salt solution could still maintain above 106 CFU/mL. The antioxidant evaluation results showed that the DPPH radical scavenging rate of the fermentation supernatant could reach 91.8%, and the chelating ability of ferrous ions in the thallus alcohol extract was 13.7 percentage points higher than that in the fermentation supernatant. In conclusion, the isolated strain had better tolerance and antioxidant ability, which could be used for the research and development of probiotics related products.
Keywords Baoqin; Lactic acid bacteria; Lactobacillus plantarum; Separation and purification; Identification; Tolerance; Antioxidant capacity
益生菌是指通过摄取适当的量对食用者身体健康能发挥有效作用的活菌,具有促进营养物质吸收、改善肠道功能、降低三高、提高免疫力、抗肿瘤等功效[1-4],是当今生命科学领域研究的热点。我国卫健委规定的可用于保健食品和功能食品的益生菌菌种名单中绝大多数为乳酸菌类,而乳酸菌也是目前商业化应用的主要益生菌。自然界中发现并分离的乳酸菌种属近30个,其中较大的乳酸菌种属有乳杆菌属、肠球菌属、乳球菌属、链球菌属、片球菌属等[5]。
益生菌发酵果蔬产品将益生菌与果蔬原料相结合,具有二者的双重优势,无论在研究还是应用方面均取得较好的成效[6,7]。然而,南昌大学的谢明勇[8]指出用于果蔬发酵的乳酸菌多为牛奶发酵菌株,较少采用植物乳杆菌等植物来源乳酸菌。由于牛奶发酵菌株利用果蔬产酸的能力有限且耐酸性较差,难以有效地发酵果蔬原料使之产生良好的风味和营养物质,致使现有乳酸菌发酵果蔬产品风味不够纯正。因此,筛选既有优良果蔬发酵特性又有利于人体肠道微生态平衡的功能性果蔬发酵专用益生菌株势在必行。
本研究拟从新鲜鲍芹根际分离乳酸菌,并进行纯化、鉴定和分析,筛选产酸能力较强的菌株,再通过人工模拟胃肠道环境对其进行耐受性和抗氧化能力评价,以期为该菌株的生产应用提供参考。
1 材料与方法
1.1 试验材料
新鲜鲍菜根,采自济南市章丘区鲍家村。
1.2 主要试剂
葡萄糖、柠檬酸氢二胺、磷酸氢二钾、磷酸二氢钾、硫酸镁、硫酸锰、无水硫酸钠、亚硝酸钠、三氯化铝、钼酸铵、乙酸钠等均为分析纯,购自国药集团化学试剂有限公司;琼脂粉,购自北京索莱宝科技有限公司;蛋白胨、牛肉膏、酵母膏,购自北京奥博星生物技术有限公司;牛胆盐、胃蛋白酶(1∶12 000)、胰蛋白酶(1∶250),购自大连美仑生物技术有限公司。
1.3 培养基配制
LB培养基:蛋白胨6.0 g,酵母浸粉5.0 g,氯化钠10.0 g,蒸馏水定容至1 L。高压灭菌锅115℃灭菌20 min。
MRS培养基:牛肉膏10.0 g,酵母膏5.0 g,柠檬酸氢二铵2.0 g,葡萄糖20.0 g,乙酸钠5.0 g,磷酸氢二钾2.0 g,硫酸镁0.58 g,硫酸锰0.25 g,蛋白胨10.0 g,固体培养基另加琼脂粉18 g,蒸馏水定容至1 L,高压灭菌锅115℃灭菌20 min。
含胆盐MRS培养基:分别添加0.00、0.06、0.20、0.40、0.60、1.00、1.50 g的牛胆盐于200 mL MRS液体培养基,使其质量浓度分别为 0、0.3、1.0、3.0、5.0、7.5 mg/mL,115℃高壓蒸汽灭菌20 min。
含高盐MRS培养基:分别添加0、2、4、6、8、10、12、14 g的氯化钠于200 mL MRS液体培养基中,使其质量浓度分别为 0、10、20、30、40、50、60、70 mg/mL,115℃高压蒸汽灭菌20 min。
人工胃液:量取一定体积的浓盐酸,蒸馏水稀释,将pH值分别调至1.5、2.5、3.5、4.5。分别加入胃蛋白酶将浓度调至10 mg/mL,使用0.22 μm滤膜过滤除菌备用。
人工肠液:将3.4 g磷酸氢二钾(K2HPO4·3H2O)充分溶于250 mL蒸馏水中,用0.4 g/mL NaOH溶液调至pH= 6.8,稀释至500 mL后加入胰蛋白酶,使胰蛋白酶溶液浓度为10 mg/mL,充分溶解后使用0.22 μm滤膜过滤除菌备用。
1.4 菌株的分离纯化与鉴定
将未经清洗的新鲜鲍芹根切成小块,放入三角瓶(已灭菌且含有钢珠)中,加无菌水100 mL,200 r/min振摇30 min。于超净工作台将上述溶液分别稀释103、104、105、106倍,取100 μL涂布于MRS平板。37 ℃恒温培养48 h后挑取表面光滑的单一菌落,划线法纯化培养3代后进行后续试验。
采用革兰氏染色和过氧化氢酶试验[9]对菌株进行初步判断,后用乳酸菌通用引物(A27F:5′-AGCGGATCACTTCACACAGGACTACGGCTACCTTGTTACGA-3′;A1495R:5′-GACTCGGTCCTAGTTTGAGAAGCACTGAGGCTCTTGAGACG-3′)进行16S rDNA验证。具体检测和比对工作委托北京擎科新业生物技术有限公司完成。
1.5 菌株的耐受性分析
1.5.1 对人工胃液的耐受性 取二次活化的菌种,3 000 r/min离心5 min,弃掉上清液,用无菌水重悬。接种至不同pH值(1.5、2.5、3.5、4.5)的人工胃液中,接种密度约为107 CFU/mL,37℃静止培养0、1、2、3 h时取样,梯度稀释后涂布至MRS平板,37℃培养48 h后计数。
1.5.2 对人工肠液的耐受性 操作步骤同1.5.1,接种至人工肠液中,并于培养0、1、2、3、4 h时取样计数。
1.5.3 对胆盐的耐受性 操作步骤同1.5.1,接种至不同胆盐浓度的MRS液体培养基中,于 37℃振荡培养24 h,梯度稀释后涂布至MRS平板,37℃培养48 h后计数。
1.5.4 对高盐的耐受性 操作步骤同1.5.1,接种至不同高盐浓度的MRS液体培养基中,于 37℃振荡培养24 h,梯度稀释后涂布至MRS平板,37℃培养48 h后计数。
1.6 菌株的抗氧化活性
菌种上清液及醇提液制备:取经二次接种于MRS培养基且生长至48 h的菌液,3 000 r/min离心5 min,取上清液4℃保存备用。剩下的菌体沉淀于45℃烘至恒重,研钵中研磨粉碎,过60目筛,称取0.40 g菌粉,加入70%乙醇20 mL浸提12 h,超声提取1 h,3 000 r/min离心5 min,所得上清液为醇提液(20 mg/mL),4℃保存备用。
DPPH自由基清除能力[10]:分别取菌种上清液和菌体醇提液各1 mL置于不同的 10 mL螺纹试管,再加入0.008 mmol/L DPPH溶液3.0 mL,室温下暗反应30 min,以无水乙醇为空白对照标零,于517 nm处测定吸光度值。计算公式:
DPPH自由基清除率(%)=[A0-(As-Ac)/A0]×100 。
式中,A0:蒸餾水1.0 mL+DPPH溶液3.0 mL的吸光度;As:样品溶液1.0 mL+DPPH溶液3.0 mL的吸光度;Ac:样品溶液1.0 mL+无水乙醇3.0 mL的吸光度。
亚铁离子螯合能力[10]:各取菌种上清液和菌体醇提液1 mL分别于3.7 mL蒸馏水混合均匀,后加入2 mmol/L的FeCl2样品0.1 mL、5 mmol/L的菲洛嗪溶液0.2 mL,25℃水浴反应10 min,562 nm处测定吸光度值,以EDTA-Na2作为阳性对照。计算公式:
Fe2+螯合率=1-(A1-A2)/A0×100% 。
式中,A0:1 mL蒸馏水代替样品溶液后的吸光度;A1:样品溶液反应后的吸光度;A2:0.1 mL的蒸馏水代替FeCl2溶液后的吸光度。
1.7 数据处理
采用Microsoft Excel 2010进行数据处理和作图,SPSS 16.0软件进行单因素方差分析(Oneway-ANOVA)和Duncans多重比较分析(P<0.05)。
2 结果与分析
2.1 菌种分离与鉴定
2.1.1 菌种分离 从涂布MRS平板中选取溶钙圈较大、表面光滑且呈乳白色的菌落,通过平板划线分离法反复进行划线分离纯化(图1),得到分离菌种1和2。
2.1.2 菌种鉴定 革兰氏染色和过氧化氢酶试验证实(图2),两株菌均为革兰氏阳性菌,过氧化氢酶阴性。通过16S rDNA扩增,并在NCBI中进行Blast序列比对,明确1株为植物乳杆菌(Lactobacillus plantarum),命名为Lactobacillus plantarum BQG,1株为戊糖片球菌(Pediococcus pentosaceus),命名为Pediococcus pentosaceus BQG。其中L. plantarum BQG的生长速度快、活力旺盛,相同条件下产酸较多,因此对该菌株进行耐受性评价,以期用于益生菌产品开发。
2.2 乳酸菌的耐受性评价
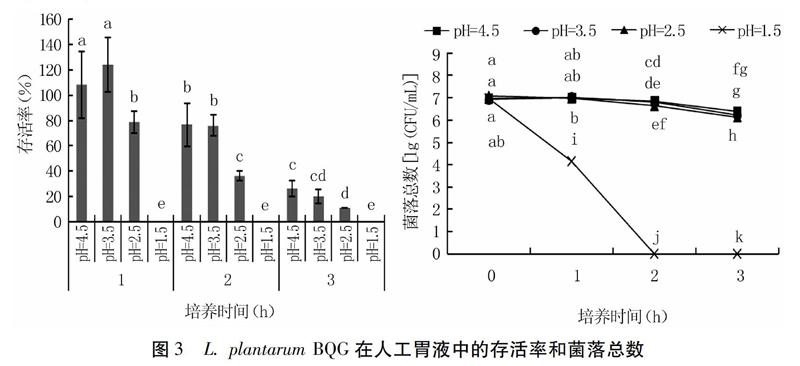
2.2.1 对人工胃液的耐受性 由图3可以看出,人工胃液pH值分别为2.5、3.5、4.5时,L. plantarum BQG的存活率较高,菌量均高于106 CFU/mL。其中,培养1 h的L. plantarum BQG数量在pH=4.5和pH=3.5的环境下有所增加,相对接种0 h增幅分别为108.4%和124.1%;2 h时,菌量开始下降,pH=4.5和pH=3.5时的存活率分别为76.8%和76.0%;培养3 h后,L. plantarum BQG在pH=2.5的环境下仍能保持11.0%的存活率。然而,当人工胃液pH值为1.5时,菌种数量在0~2 h内直线下降,2 h以上则全部死亡,说明该菌不适宜在强酸环境下生存。
2.2.2 对人工肠液的耐受性 由图4可知,人工肠液中培养1~3 h时,随时间的延长,植物乳杆菌数量逐渐增加,培养3 h的存活率高达191.9%;4 h后,菌种数量开始下降,存活率降至35.7%,但菌种数量仍维持在107 CFU/mL左右。表明该菌具备较强的肠液耐受性。
2.2.3 对胆盐的耐受性 由图5可以看出,植物乳杆菌在0.3 mg/mL的胆盐浓度下存活率为89.2%,在1.0 mg/mL时则下降至22.7%,大于3.0 mg/mL时,菌株的存活率维持在5.0%左右。随着胆盐浓度的升高,该菌数量整体先呈下降趋势,后趋于平稳,菌量保持在106 CFU/mL以上。说明该菌的耐胆盐能力较好。
2.2.4 对高盐的耐受性 由图6可以看出,当盐浓度为10、20 mg/mL时,植物乳杆菌的存活率分别为121.1%、114.9%,说明一定浓度的钠盐对该菌的生长具有促进作用;当盐浓度超过50 mg/mL时,该菌的存活率下降幅度较大,至盐浓度为70 mg/mL时,存活率仅为3.0%。该菌数量在0~40 mg/mL盐浓度范围内虽整体呈下降趋势,但变化不大,菌落数量均维持在107 CFU/mL以上,至盐浓度为70 mg/mL时,菌量也高于106 CFU/mL。
2.3 乳酸菌的抗氧化作用评价
由图7可以看出,植物乳杆菌的发酵上清液与固形物醇提液都有一定的抗氧化能力。其中,发酵上清液的DPPH自由基清除能力较强,清除率可以达到91.8%;而固形物醇提液的亚铁离子螯合率比发酵上清液的高出13.7个百分点。
3 讨论与结论
目前,益生菌广泛应用于医疗健康、食品工业、动物健康养殖和农业种植等领域,而我国益生菌产业最核心的菌株资源长期依赖进口。近年来,我国学者在筛选具有自主知识产权的菌种方面取得很大进步,如内蒙古农业大学张和平团队已建成我国最大的具有自主知识产权的乳酸菌菌种资源库。但是益生菌最大的应用领域为乳制品,果蔬发酵专用益生菌的种类较少[11],难以保证人体对果蔬发酵制品风味和营养的需求[12]。因此,筛选果蔬发酵专用优良菌株并建立相应的资源库对于农产品的高附加值开发利用具有重要意义。
本试验从鲍芹根际分离得到两株产酸菌,经鉴定,分别为植物乳杆菌(L. plantarum BQG)和戊糖片球菌(P. pentosaceus BQG),其中L. plantarum BQG具有较好的产酸和繁殖能力。对其进行耐受性评价后发现,该菌在pH值为2.5、3.5、4.5的人工胃液中处理3 h后数量仍保持在106 CFU/mL以上。一般情况下,空腹状态胃酸pH值在0.9~1.8,而进食后pH值会上升至3左右[12]。因此,该菌株具备一定的耐受胃中酸性环境的能力,若开发该菌作为商品化益生菌菌剂则适合在餐后服用。肠液环境复杂,对菌群的生长繁殖影响较大,因此,益生菌的肠液耐受性强弱决定了其能否在肠液中存活,而一定数量的活菌是发挥益生功能的关键。L. plantarum BQG在人工肠液培养2、3 h的存活率分别为155.9%和191.9%,4 h后该菌数量开始下降,存活率仍达35.7%,说明该菌具有很强的肠液耐受性。此外,判断该菌株能否在肠道中生存繁殖,还要评价其耐高盐能力。肝脏分泌出的胆汁酸与甘氨酸或者牛磺酸发生化学反应生成的胆盐会随着胆汁进入小肠内,发生胆盐的肠-肝循環[13],在这一过程中,部分胆盐留存于肠道内会影响益生菌活力。较高的肠道离子浓度会造成肠道微生物发生质壁分离,菌株失水死亡。而离子浓度过低时,某些无细胞壁的菌株会发生溶胀现象,细胞破裂死亡[14]。人体胃肠道中胆盐浓度质量约为3 mg/mL,NaCl的质量浓度约在10~40 mg/mL范围内[12],L. plantarum BQG在7.5 mg/mL的胆盐溶液和70 mg/mL钠盐溶液中菌量均能维持在106 CFU/mL以上,说明该菌具有较强的耐胆盐和耐高盐特性。抗氧化能力试验表明,该菌发酵上清液的DPPH自由基清除率可达91.8%,固形物醇提液的亚铁离子螯合率比发酵上清液的高出13.7个百分点。
综合分析可知,本次试验分离得到的植物乳杆菌具有较强的体外环境耐受能力,还具有较高的抗氧化活性,后期可用于益生菌相关产品的研发。此外,后续试验还需深入研究该菌的益生功能,并对其发酵的果蔬制品进行风味和营养评价,以期为该菌的生产应用提供依据。
参 考 文 献:
[1]Cocetta V, Catanzaro D, Borgonetti V, et al. A fixed combination of probiotics and herbal extracts attenuates intestinal barrier dysfunction from inflammatory stress in an in vitro model using Caco-2 cells[J]. Recent Pat. Food Nutr. Agric., 2019, 10(1): 62-69.
[2]Upadrasta A, Madempudi R S. Probiotics and blood pressure: current insights[J]. Integr. Blood Press Control,2016,9:33-42.
[3]Sales-Campos H, Soares S C, Oliveira C. An introduction of the role of probiotics in human infections and autoimmune diseases[J]. Crit. Rev. Microbiol., 2019,45(4):413-432.
[4]Nazir Y, Hussain S A, Abdul H A, et al. Probiotics and their potential preventive and therapeutic role for cancer, high serum cholesterol, and allergic and HIV diseases[J]. BioMed Res. Int., 2018, 2018: 3428437.
[5]张开屏. 植物乳杆菌的鉴定及生物学特性的研究[D]. 呼和浩特:内蒙古农业大学, 2008.
[6]Septembre-Malaterre A, Remize F, Poucheret P. Fruits and vegetables, as a source of nutritional compounds and phytochemicals: changes in bioactive compounds during lactic fermentation[J]. Food Res. Int., 2018, 104: 86-99.
[7]丁楠,何美珊,戈子龙,等. 果蔬发酵制品的功效及应用研究进展[J]. 食品工业科技,2019,40(7):332-336.
[8]谢明勇,熊涛,关倩倩. 益生菌发酵果蔬关键技术研究进展[J]. 中国食品学报,2014,14(10):1-9.
[9]朱旭芬. 现代微生物学实验技术[M]. 杭州:浙江大学出版社, 2011.
[10]Yu J, Wang Y, Sun J, et al. Antioxidant activity of alcohol aqueous extracts of Crypthecodinium cohnii and Schizochytrium sp[J]. Journal of Zhejiang University-SCIENCE B (Biomedicine & Biotechnology),2017,18(9):797-806.
[11]卢晓黎,尼海峰. 发酵蔬菜功能菌研究与应用进展[J]. 中国食品学报,2012,12(2):1-6.
[12]王今雨,满朝新,杨相宜,等. 植物乳杆菌NDC 75017的降胆固醇作用[J]. 食品科学,2013,34(3):243-247.
[13]皮宇,高侃,朱伟云. 机体胆汁酸肠-肝轴的研究进展[J]. 生理科学进展,2017,48(3):161-166.
[14]孟丽,唐善虎,杨蓉生,等. 干酪乳杆菌在模拟人体消化道环境及高盐环境中生长活力的研究[J]. 食品研究与开发,2009,30(4):46-49.
收稿日期:2019-06-21
基金项目:山东省现代农业产业技术体系建设专项 (SDAIT-26-09);山东省农业科学院重大科技成果培育项目(2015CGPY07);山东省科技发展计划项目(2012GNC11016);山东省农业科学院青年科研基金项目(2015YQN32);国家国际科技合作专项(2012DFA30450)
作者简介:于金慧(1985—),女,山东济宁人,博士,助理研究员,主要从事微生物资源利用、功能性成分及其生物活性研究。E-mail:faith_2002@163.com
通讯作者:尤升波(1973—),男,山东临沂人,硕士,研究员,主要从事微生物资源利用及乳酸菌功能饮品研发。E-mail:18663700369@126.com
毕玉平(1961—),男,山东青州人,博士,研究员,主要从事微藻培养及次生代谢产物积累及活性研究。E-mail:yupingbi@vip.sina.com

