数字油滴PCR 法与ARMS 法检测结直肠癌BRAF 基因突变中应用价值
姜燕平 荀延萍 傅佳仪 张仕蓉 赵妍妍 马胜林
1.浙江大学医学院附属杭州市第一人民医院转化医学研究中心,浙江杭州 310006;2.浙江大学医学院附属杭州市第一人民医院肿瘤科,浙江杭州 310006
结直肠癌是全球第二大常见癌症[1]。与发达国家比较,中国患者病死率与死亡率较高[2-3]。改善结直肠癌患者治疗效果的基石之一是找到肿瘤相关的基因突变[4]。丝/苏氨酸特异性激酶(BRAF)在丝裂原活化蛋白激酶途径的激活中起重要作用,有助于细胞生长,增殖和分化。BRAF V600E 突变是其主要突变类型,可以调节磷酸化使BRAF 活性提高近10 倍[5]。研究发现[6],患有BRAF V600E 突变的结直肠癌患者的中位生存期比未突变的结直肠癌患者短10~16 个月。因此,选择适当的BRAF 基因突变的检测方法对结直肠癌的诊断和预后有重要意义。扩增阻碍突变系统(ARMS)被认为是一种经济、简便的检测方法,在临床实践中得到了广泛的应用[7-8]。近年来,数字油滴聚合酶链式反应法(ddPCR)发展迅速,且与ARMS 法比较,是一种不依赖于CT 值且不受扩增效率影响的绝对定量技术[9]。本研究采用ddPCR 法和ARMS 法分析比较结直肠癌患者BRAF 基因突变的检测结果,以期为结直肠癌的诊断治疗提供参考。
1 资料与方法
1.1 一般资料
收集2018 年4 月—2019 年7 月浙江大学医学院杭州市第一人民医院诊治的结直肠癌患者手术标本162 例(伦理号:2018-15-02)。纳入标准:接受手术治疗,且病理学确诊为结直肠癌。排除标准:①术前接受放化疗或免疫治疗;②合并其他恶性肿瘤;③术前有明确的远处转移,术后3 个月内出现远处转移;④骨髓功能异常或凝血功能异常;⑤严重的心、脑、肝和肾功能障碍;⑥资料不完整。患者年龄18~95 岁,平均(52.31±12.36)岁;男101 例,女61 例;发病部位:直肠62 例,乙状结肠46 例,横结肠29 例,升结肠16 例,盲肠9 例;乳头状腺癌82 例,高分化腺癌62 例,低分化腺癌18 例;隆起型75 例,浸润型62 例,溃疡型25 例;Ⅰ~Ⅱ期93 例,Ⅲ~Ⅳ期69 例。
1.2 观察指标及检测方法
分析ARMS 法和ddPCR 法结直肠癌患者BRAF V600E 突变检测阳性率及一致性;分析BRAF V600E突变与结直肠癌患者临床病理特征的关系。
ARMS 法:穿刺样本的石蜡包埋组织切片要求≥3 mm 厚度,肿瘤细胞数≥200 个。取3 块石蜡切片,使用QIAampDNAFFPETissueKit 试剂盒(德国QIAGEN 公司,货号:56404)提取DNA。采用BRAF 基因突变检测试剂盒(北京雅康博生物科技有限公司,生产批号:20171203) 结合实时荧光定量PCR 仪(Life Technologies Holdings Pte Ltd.,7500) 检 测BRAF V600E 的突变情况。具体步骤:将提取的核酸稀释至10 ng/mL,取20 mL 用于试验产品检测,反应程序:95℃10 min、95℃15 s、60 s 循环40 次。采集各样本的Ct,突变位点存在扩增,且Ct 值≤35,该样本突变型;Ct 值>38 或无扩增,该样本为野生型。
ddPCR 法:采用上海源奇生物医药科技有限公司提供的人BRAF 基因突变检测试剂盒(生产批号:20180125)结合ddPCR 微滴阀读仪(上海伯乐生命医学产品有限公司,QX-200)进行检测。具体步骤:石蜡切片进行组织DNA 的提取同ARMS,取6 mL,2000 r/min离心10 s,加至PCR 预混液的PCR 管,反应体系总体积20 mL,进样ddPCR 微滴阀读仪,样本落在“ch1+ch2-”区的点且突变比例为1%,该样本突变型,否则为野生型。
高通量测序分析:当ARMS 法与ddPCR 法存在歧义时,采用高通量测序,对PCR 产物在质控后纯化,在MiSeq 基因测序仪(美国Illumina 公司)进行测序,以高通量测序数据分析系统进行分析。
1.3 统计学方法
采用SPSS 19.0 软件进行统计学分析,计量资料以均数±标准差(±s)表示,计数资料以例数表示。通过χ2检验评价ARMS 法和ddPCR 法在评估结直肠癌的BRAF 基因突变的一致性及人BRAF V600E 突变与结直肠癌患者临床病理特征的关系。采用正态近似法计算一致性的置信区间。以P <0.05 为差异有统计学意义。
2 结果
2.1 BRAF V600E 突变检测结果
在162 例结直肠癌患者标本中,ARMS 法检测BRAF V600E 突变阳性率为8.64%(14/162),ddPCR法检测BRAF V600E 突变阳性率为9.26%(15/162)。对ARMS 法检测BRAF V600E 突变存在歧义的1 例进行高通量测序,ddPCR 法与高通量测序的结果一致。对应ddPCR 法,ARMS 法的敏感性为100%(14/14)、特异性为99.32%(147/148)、准确性为99.38%(161/162)、假阴性率为6.67%(1/15)、阳性符合率为93.33%(14/15)和阴性符合率为99.32%(147/148)。ARMS 法和ddPCR 法检测一致性为99.38%(161/162,95%CI:0.963~0.999)。见表1、图1~2。
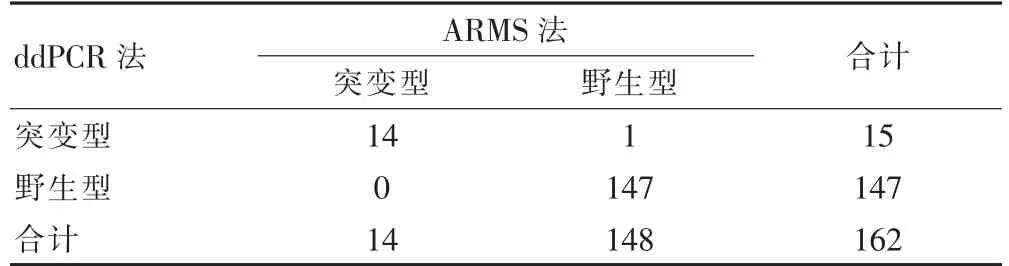
表1 BRAF V600E 突变检测结果(n)
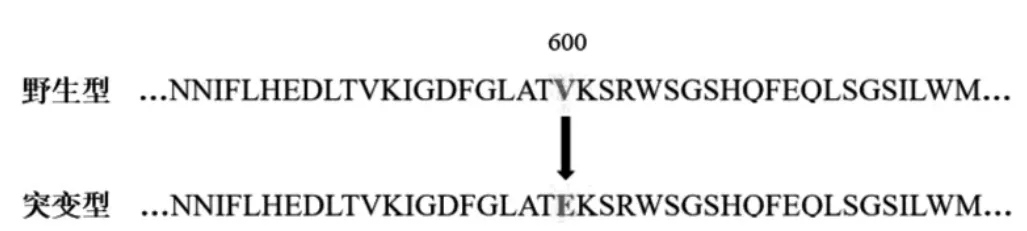
图1 人BRAF V600E 突变

图2 高通量测序人BRAF V600E 突变
2.2 人BRAF V600E 突变与临床病理特征的关系
不同性别、部位、病理分型结直肠癌患者BRAF V600E突变分布比较,差异无统计学意义(P >0.05)。年龄越高、组织学类型低分化、Ⅲ~Ⅳ期患者BRAF V600E 突变分布越高,差异有统计学意义(P <0.05)。见表2。
3 讨论
ARMS 检测基因突变的基本原理在于,PCR 扩增引物是否延续与引物3′端的碱基与模板配对有关,不能配对则不能延伸,因此设计合适的引物即可用于区分突变与正常的DNA 序列。在本研究中,PCR 扩增时只扩增BRAF,无突变序列不扩增,PCR 产物未含未突变的等位基因片段,灵敏度较高,如张莹等[10]采用ARMS 法从60 例结直肠癌患者手术切除组织中检出3 例BRAF V600E 突变。但报道也显示,ARMS 存在假阴性。如本研究结果显示,ARMS 检测BRAF V600E突变存在1 例假阴性,因此需要通过加大DNA 模版量、更换试剂盒、更换操作人员等克服假阴性的缺陷。
Kary 等于1985 年创立了PCR 来对核酸进行定量分析[11]。尽管此方法具有很高的灵敏度,但许多不准确的因素可能会影响对转录本数量的评估[12]。新一代的实时荧光定量PCR(qPCR),可以通过将qPCR 的荧光输出曲线与不同的已知初始DNA 拷贝数生成的标准曲线进行比较从而确定DNA 模板的初始含量[13]。相较于普通PCR,qPCR 的检测结果更为准确[14]。Vogelstein 等[15]于1999 年发展了ddPCR,在结直肠癌患者中成功检测出具有高度敏感性的Ras 突变。ddPCR 的关键是将PCR 混合物与必要的荧光团分为数千个单独的PCR 反应单元,每个单元都经历与常规PCR 相同的热循环[16-17]。与qPCR 比较,ddPCR 不依赖于CT 值,因此不受扩增效率影响,扩增结束后通过直接计数或泊松分布公式来计算每个反应单元的平均浓度,能够将误差控制在5%以内,具有高精度、高准确性,无需标准曲线的绝对定量以及出色的重现性和一致性的优点[18]。另外有研究发现,ddPCR 对不同类型的抑制剂比qPCR 可能具有更高的耐受性,可防止核酸提取过程中带入的杂质(如离子去污剂、乙醇、异丙醇等)检测结果的影响[19-20]。
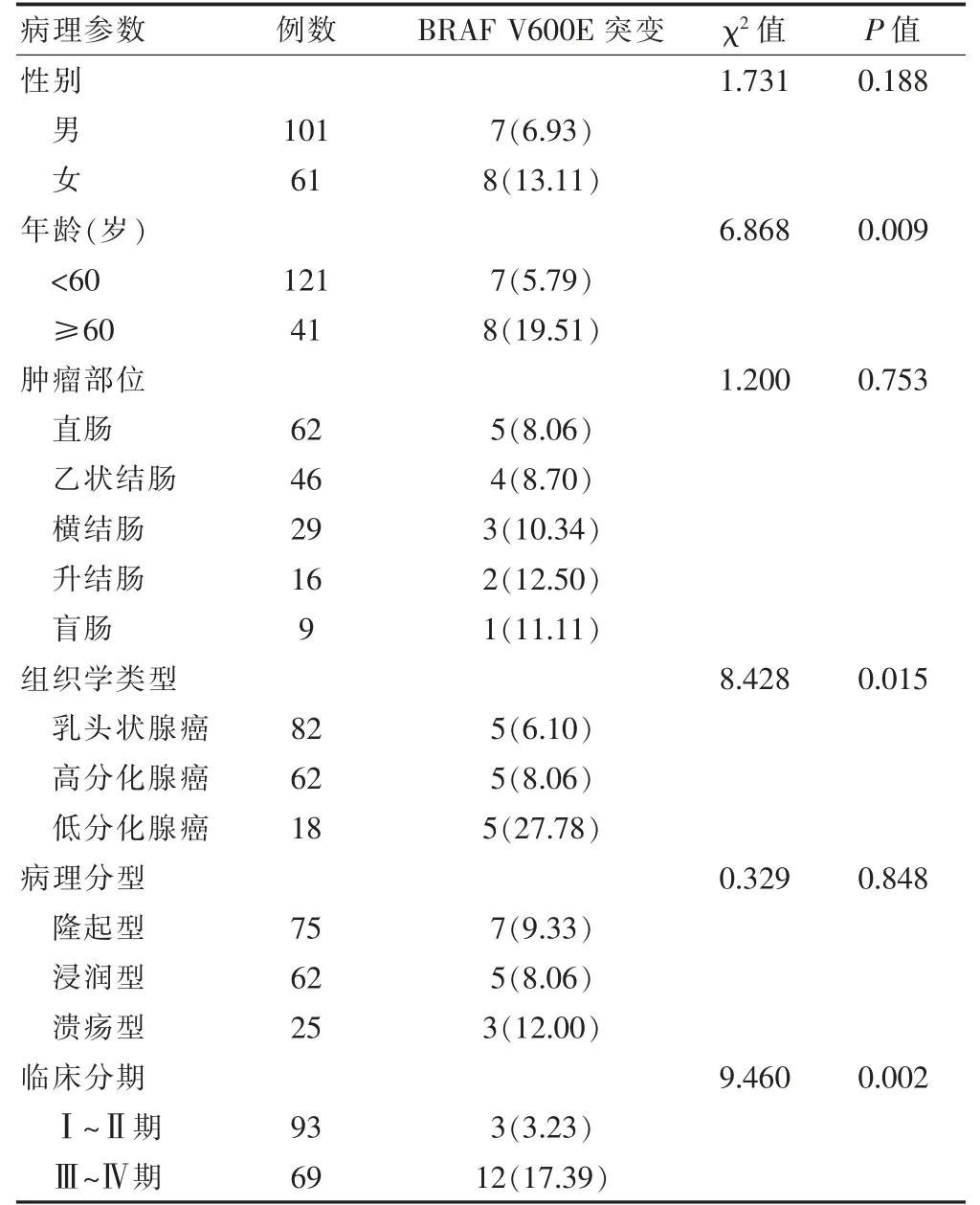
表2 人BRAF V600E 突变与临床病理特征的关系[例(%)]
本研究发现ddPCR 法与高通量测序结果一致,进一步证实ddPCR 的高精度和高准确性的优点。Xu等[21]研究显示ddPCR 具有较高的重复性和灵敏性,160 例乳头状甲状腺癌患者中检出128 例BRAF V600E突变,其中4 例BRAF V600E 突变阳性患者ARMS检出为阴性。毛旭华等[22]研究显示,与ARMS 法比较,ddPCR 可检出更多的EGFR T790 突变。曹紫阳等[23]从ARMS 法检测的10 例EGFR T790 突变阴性病例中,以ddPCR 检出阳性3 例。另外,本研究还发现年龄越高、组织学类型低分化、临床分期Ⅲ~Ⅳ期患者BRAF V600E 突变分布较高,与报道结果类似[5,24-26]。可见V600E 突变的BRAF 参与了结直肠癌的发生发展,通过检测结直肠癌BRAF V600E 是否存在突变有助于个体化制订治疗方案及判断预后。
综上所述,ddPCR 与ARMS 均可用于检测结直肠癌的BRAF V600E 突变,ddPCR 有更高的检测效能。

