鸽avUCP基因克隆、原核表达与多抗制备
李晨星 潘广伟 宋思进


摘 要:解偶联蛋白(uncoupling proteins,UCPs)是线粒体内膜上具有调节质子跨膜转运作用的转运蛋白,在细胞的产热、氧化还原、活性氧产生等许多细胞过程中起着关键作用。鸟类解偶联蛋白(avian uncoupling protein avUCP)通过调控脂类利用和细胞代谢产热参与机体的脂肪代谢和能量平衡,多种环境和激素因子调控其转录和翻译水平。为了更好地理解avUCP参与鸟类代谢产热的分子机理,该研究以鸟类模式生物之一鸽为实验材料,克隆了鸽avUCP基因的部分保守序列,基于原核表达系统,构建了pET32a-avUCP原核表达载体,成功表达了鸽avUCP重组融合蛋白,经Ni2+亲和层析法纯化重组蛋白,SDS-PAGE结果显示,所得到的目标蛋白分子量与预测值一致,表明纯化得到了高纯度目标蛋白。以目标蛋白为抗原免疫新西兰大白兔,5免后制备抗血清,ELISA检测结果显示效价为1∶51200。Western blot检测结果表明,该抗体不仅可以免疫结合重组avUCP蛋白,而且与鸽(Columba)、画眉(Garrulax canorus)和灰背椋鸟(Sturnus sinensis)骨骼肌中的avUCP抗原蛋白同样具有良好的特异性免疫反应,说明制备的抗体具有较好的特异性和保守性。该研究将为分子水平研究鸟类能量代谢的规律和调控机理提供必要的抗体基础。
关键词:鸽;avUCP;基因克隆;原核表达;多克隆抗体
Abstract:Uncoupling proteins(UCPs),which are transporters in the mitochondrial membrane that regulate proton transport across the membrane,play a pivotal role in thermogenesis,redox balance,reactive oxygen species and many other cellular processes. Avian uncoupling protein(avUCP)takes extensively part in fat metabolism and energy balance by regulating lipid utilization and cellular thermogenetic metabolism. A variety of environmental and hormonal factors regulate its transcription and translation. In order to better understand the molecular mechanism of avUCP involved thermogenetic metabolism,the fusion protein of avUCP from Pigeon,one of the avian model organisms,was successfully expressed in the prokaryotic expression system. Firstly,some conserved sequences of pigeon avUCP gene were cloned,and the prokaryotic expression vector pET32a-avUCP was constructed by using gene recombination method. The target fusion protein was purified by Ni-NAT purification system. The results of SDS-PAGE showed that the molecular weight of the target protein was consistent with the predicted value. New Zealand white rabbits were immunized with target protein antigen,and anti-serum was obtained after five times immunization. Western blot analysis showed that the antibody could immunologically bind to recombinant avUCP protein and nature avUCP proteins of G.canorus,S. sinensis and C.livia. The results revealed the antibody had higher immune-specificity and conservatism in birds. This study will provide the necessary antibody for the study of the regulation mechanism of energy metabolism in birds at the molecular level.
Key words:Pigeon;avUCP; Gene cloning; Prokaryotic expression; Polyclonal antibody
动物的产热(Thermogenesis)包括专性产热(obligatory thermogenesis)和兼性产热(facultative thermogenesis)[1]。专性产热是指为维持生命基本功能所发生的所有合成和分解代谢生物化学过程中以副产物的形式产生的热量,产生于所有器官,如基础代谢率(basal metabolic rate,BMR)和静息代谢率(resting metabolic rate,RMR)[2]。兼性产热又称为适应性产热(adaptive thermogenesis),是指对环境温度或饮食的变化发生响应的产热作用,其目的是保护生物体免受低温胁迫或调节饮食变化后的能量平衡,只发生在部分组织中,如肌肉的颤抖性产热(shivering thermogenesis,ST)、褐色脂肪组织(brown adipose tissue,BAT)的非颤抖性产热(nonshivering thermogenesis,NST)及食物诱导产热(diet-induced thermogenesis,DIT)等[3]。糖类、脂肪和蛋白质三大营养物质在细胞线粒体内的氧化放能是动物产热的主要生物化学基础,而线粒体内膜上的质子泄漏(proton leak)是动物代谢产热变化的重要潜在机制之一[4]。通过电子传递链向外泵送质子,线粒体的氧化磷酸化会在内膜两侧产生质子电-化学势能(ΔP)。质子通过F0/F1- ATP合成酶重新进入线粒体基质,由ADP和无机磷酸盐(Pi)生成ATP。若质子不通过F0/F1-ATP合成酶进行ATP合成,而直接通过线粒体内膜回到基质则被称为质子泄漏或解偶联(uncoupling),其结果导致贮存在ΔP中的自由能以热的形式被消耗[5]。作为线粒体转运载体蛋白家族成员之一的解偶联蛋白-1(uncoupling protein-1,UCP-1)是调控上述机制的主要蛋白[6]。Nicholls等在哺乳动物的褐色脂肪组织(brown adipose tissue,BAT)中首次发现了该蛋白,UCP-1仅在BAT中特异表达,在寒冷或饮食不足时以增加产热[7,8]。自此,小哺乳动物BAT中的UCP-1调控的非颤抖性产热在适应性产热中的作用得到了广泛而深入的研究。1997年以后哺乳动物的同源蛋白UCP-2[9]、UCP-3[10]、UCP-4[11]和UCP-5[12]也相繼被发现。
鸟类缺少褐色脂肪组织,因此与哺乳动物相比其非颤抖性产热的研究相对滞后。2001年Raimbault等人通过对鸡(Gallus gullus)的骨骼肌cDNA文库进行筛选,获得了与哺乳动物UCP-1同源的鸟类UCP(avian UCP,avUCP)cDNA[13]。此后,avUCP在鸟类非颤抖性产热中的作用得到了较为充分的研究。冷暴露条件下,雏鸭(Anas platyrhynchos)、鸡和疣鼻栖鸭(Cairina moschata)等鸟类avUCP的mRNA表达均显著上调[14];日眠(torpor)和苏醒(rewarming)时,蜂鸟avUCP mRNA的表达较清醒状态分别升高3.4倍和2.2倍[15];体外条件下,与从未下过水的幼年王企鹅(Aptenodytes patagonicus)相比,实验性冷水浸泡或自然适应海洋低温个体的胸肌细胞呼吸中存在线粒体的跨膜质子电导,同时伴随avUCP mRNA表达丰度的显著升高[16]。有研究表明,食物诱导也可以导致鸟类avUCP mRNA表达发生变化[17]。大量的实验证据表明,avUCP在鸟类的产热调节中具有类似哺乳动物UCP-1的重要调控作用。除了产热以外,还有研究认为avUCP通过解偶联机制参与降低线粒体的氧化应激水平[18]。总之,avUCP与鸟类肌肉组织中线粒体的能量代谢存在密切关系。
为了满足人类医学和小哺乳动物能量代谢的科研需求,人、大鼠和小鼠等的UCP-1抗体试剂相继实现商品化生产。然而,有关avUCP的研究则相对滞后,目前尚无商品化抗体供研究者使用。受到抗体缺乏的影响,关于鸟类avUCP表达水平的研究多局限于mRNA水平。本研究以鸟类模式生物之一鸽为实验材料,对其肌肉组织avUCP基因进行同源克隆,常规方法原核表达avUCP重组蛋白并纯化,免疫新西兰大白兔制备兔抗鸽avUCP多克隆抗体,为深入研究鸟类avUCP的功能及其在鸟类代谢产热中的贡献和作用机制提供必要的检测工具。
1 材料与方法
1.1 试验材料与试剂 健康成年美国白羽王鸽购自黑龙江省大庆市花鸟鱼市场。王鸽饲养于动物房内,环境温度为25℃±0.5℃,光周期为16h∶8h(光照∶黑暗),相对湿度为50%~60%,市售标准鸽粮饲养。15d后断头法处死动物,迅速取胸肌组织投入液氮速冻,随即转入-80℃冰箱存放备用。
基因克隆用的高保真KOD DNA聚合酶和dNTP购自东洋纺(上海)生物科技有限公司;RNA提取试剂Trizol、胶回收试剂盒、BamH I和EcoR I限制性内切酶、T4连接酶、蛋白质分子量标准和羊抗兔IgG二抗购自赛默飞世尔科技(中国)有限公司;cDNA合成试剂盒和DNA分子量Marker购自宝日医生物技术(北京)有限公司;pEASY-blunt cloning vector载体购自北京全式金生物技术有限公司;弗氏完全佐剂(FCA)和弗氏不完全佐剂(FIA)购自西格玛奥德里奇(上海)贸易有限公司;其他试剂购自国药集团化学试剂北京有限公司。引物合成和测序由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 鸽avUCP基因的克隆与原核表达载体构建 采用Trizol法提取鸽肌肉组织总RNA,利用随机引物法合成cDNA的第一条链,具体方法参照试剂盒说明书进行。
美国国家生物技术信息中心(NCBI)网站获取原鸽(Columba livia)的avUCP基因序列信息(KU166860.1)。采用同源克隆的方法,设计含有酶切位点的引物。上游引物avUCP-5:5-CGCGGATCCACAGGGCTGGCGGCGCGGCTGCTG-3(下划线表示设计的BamH I酶切位点),下游引物avUCP-5:5-CCGGAATTCtcGCGCTGCAGCTGCTCGTAGGAGG-3(下划线表示设计的EcoR I酶切位点,小写字母为防止移码突变引入的碱基)。预测的目的片段的大小为552bp。
PCR扩增反应条件如下:94℃预变性2min,94℃变性15s,60℃退火30s,68℃延伸1min,35个循环,68℃终止循环10min。用1.5%琼脂糖凝胶对PCR产物进行电泳分离。胶回收纯化目的片段方法参照说明书执行。
纯化后的目的片段连接pEASY-blunt cloning vector,PCR法和测序法同时检测载体的连接情况,连接成功后,载体命名为pEASY-avUCP。测序正确的pEASY-avUCP载体与pET32a空载体分别使用BamH I和EcoR I限制性内切酶进行双酶切,酶切产物利用T4连接酶连接,连接产物转化DH5a感受态细胞,抗性筛选阳性克隆,PCR测序检测目的片段与原核表达载体的连接情况,测序正确构建好的原核表达载体命名为pET32a-avUCP。
1.2.2 重组蛋白avUCP的诱导表达和纯化 测序正确的重组表达质粒pET32a—avUCP转入原核表达感受态BL21(DE3)中,37℃培养过夜后,随机挑选阳性菌落克隆于含卡那霉素(50ug/mL)的LB液体培养液中37℃,220r/min培养。当OD600检测值为0.5~0.7时,取出2.5mL菌液,加入IPTG至终浓度为1mmol/L,继续培养3h,收集菌体,使用12% SDS-PAGE检测重组蛋白表达情况。重组菌株用18℃低温扩大培养,0.2mmol/L和0.5mmol/L IPTG诱导表达,摇床过夜培养,4℃,5000r/min离心5 min,收集菌体。12% SDS-PAGE检测重组蛋白表达对不同浓度IPTG的响应情况。纯化参考孜拉吉古丽·西克然木等[19]的方法。
1.2.3 重組蛋白avUCP的多克隆抗体制备 参考李铭等(2018)的方法[20]制备多克隆抗体。
1.2.4 ELISA检测抗体效价 抗原经包被液(0.05mol/L碳酸盐缓冲液,pH9.6)稀释至2?g/mL后包被ELISA板,每孔100?L,4℃过夜。弃掉包被液后PBST(0.01M PBS缓冲液+0.05%TWEEN-20)重复洗板3次,每孔150?L,每次3min。5%脱脂乳封闭,每孔100?L,37℃温育1h后洗涤同上。每孔加入按比例稀释的抗血清或阴性对照血清100?L,37℃温育1h后洗涤同上。每孔加1∶5000羊抗兔IgG-HRP二抗100?L,37℃温育1h后洗涤同上。每孔加底物显色液OPD 100?L,37℃温育条件下避光显色5~10min,颜色有明显梯度变化时,每孔加入2moL/L的浓硫酸100μL终止颜色反应,酶标仪492nm处测定吸光度。结果判断:空白OD<0.05,阴性对照OD<0.2,(试验孔OD值-空白孔OD值)/(阴性对照孔OD值-空白孔OD值)>2判定为阳性[21]。
1.2.5 重组蛋白avUCP多克隆抗体的特异性检测 采用Western杂交方法检测制备的重组蛋白avUCP多克隆抗体的特异性。SDS-PAGE结束后,将胶体放于转膜液(25mMTris,192mM甘氨酸,20%甲醇,pH8.0)中。用100%的甲醇激活适当大小的PVDF后将其置于转膜液中平衡5~10min。按由下到上的顺序放置滤纸-电泳胶-PVDF膜-滤纸于转移槽上,15V电转30min后,双蒸水清洗2次,每次10min。然后用5%脱脂奶粉在4℃下封闭PVDF膜过夜。次日,以重组蛋白avUCP多克隆抗体为一抗(1:3000),室温孵育2h。用TBS-T(20mM Tris-HCl,150mM Nacl,0.05% Tween 20,pH8.0)洗膜3次,每次15min。以含有辣根过氧化物酶(HRP)标记的羊抗兔IgG为二抗(1:5000),室温抚育1h。TBS-T膜3次,每次15min,ECL发光液室温孵育1min后成像拍照。
2 结果与分析
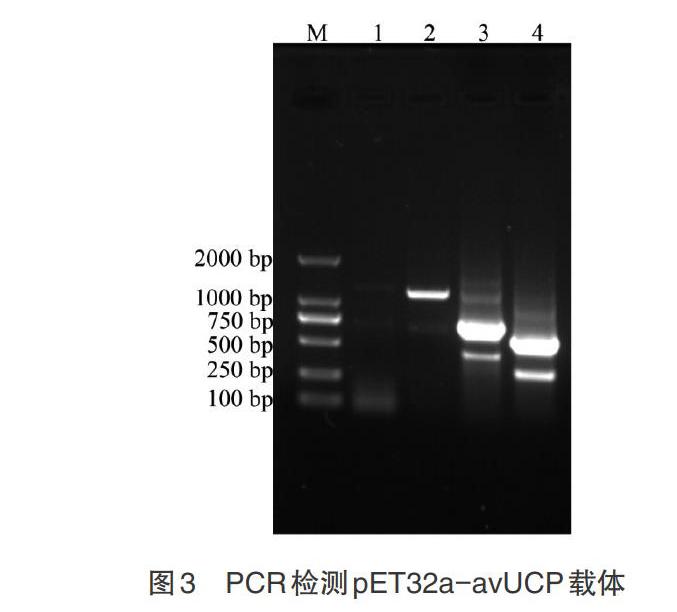
2.1 鸽avUCP基因与表达载体 以鸽的总RNA反转录产物cDNA为模板,利用高保真的KOD酶进行avUCP基因的PCR扩增,得到与预期结果相一致的长度为552bp的目的条带(图1A)。胶回收后,连接平末端pEASY-blunt克隆载体,抗性筛选获得阳性克隆,提取质粒后,利用载体引物M13F和M13R检测目的片段与载体的连接情况。结果如图1B所示,条带大小为752bp,符合预期结果,目的基因成功连接到pEASY-blunt载体上。PCR鉴定正确的质粒送公司测序,王鸽avUCP基因与原鸽具有100%的同源性。
2.2 鸽avUCP重组蛋白的诱导表达 首先用1mmol/L的IPTG诱导表达avUCP重组蛋白,经SDS-PAGE检测,得到分子量大小约为37.7kDa的目的条带,符合预期结果(图4泳道2)。为了纯化avUCP重组蛋白,采用18℃低温条件和不同浓度的IPTG(0.2、0.5mmol/L)诱导重组蛋白,并超速离心分离菌体的上清和沉淀。结果显示,低温条件下,不同浓度的IPTG诱导,avUCP重组蛋白以包涵体的形式存在(图4泳道4和6)。
2.3 鸽avUCP重组蛋白和免疫特异性 利用8M尿素溶解包涵体,His标签亲和层析avUCP重组蛋白,纯化的重组蛋白目的条带单一,符合多克隆抗体制备的要求(图5泳道2)。以制备的鸽avUCP抗血清为一抗,以纯化的avUCP重组蛋白为抗原进行Western blot 分析。结果显示,免疫反应获得的抗血清能够与重组蛋白结合且与预期条带大小相一致(图5泳道3)。
2.4 鸽avUCP多克隆抗体的效价检测 以纯化好的重组蛋白为抗原,对新西兰大白兔连续免疫5次后,ELISA法检测血清抗体效价,实验结果见表1。经计算可得,当抗血清稀释度为1∶51200时,各样品在492nm处的吸光值之间的关系为(0.37-0.045)/(0.154-0.045)=2.98,即检测孔大于阴性对照2倍以上。
2.5 鸽avUCP重组蛋白抗血清免疫保守性 为了检测制备的avUCP重组蛋白抗血清的保守性和适用性,分别提取灰背椋鸟(Sturnus sinensis)、王鸽和画眉(Garrulax canorus)的肌肉组织总蛋白作为抗原进行Western blot分析。结果显示,所制备的抗体与上述3种鸟肌肉组织中的avUCP均可结合且与预期条带大小相符(图6),表明制备的抗血清对鸟类的avUCP具有较好的免疫原性。
3 讨论
哺乳动物UCPs作为生物体细胞内线粒体氢离子转运蛋白,参与生物体发育的多种细胞过程,包括:组织产热代谢、细胞ROS的响应、脂代谢的调控及糖原和胰岛素稳态的调控等[22]。与哺乳动物相比,鸟类基因组中仅有一个UCP(avUCP),不存在哺乳动物UCP1和 UCP2的相似物[23]。已有的研究表明,avUCP参与鸟类的代谢产热和能量平衡等[15,24,,25]。来源于人和鼠源的UCPs抗体已经广泛用于免疫沉淀、Western blot、免疫组化和蛋白定位等研究。然而,对avUCP功能的研究常因avUCP蛋白相关抗体的缺少而受到限制。因此,制备针对avUCP的高质量抗体对于鸟类能量代谢的研究是必要的。
大肠杆菌(Escherichia.coli)表达系统是目前应用最为广泛的制备多克隆抗体的原核表达系统。在原核表达系统中,外源基因的表达除了受基因自身结构的影响外,还受温度、IPTG浓度和pH值等影响[26]。本研究摸索发现18℃低温条件下,IPTG的浓度对avUCP的诱导表达产生影响,0.2和0.5mmol/L诱导后,重组融合蛋白均可在包涵体中表达。采用8M尿素溶解包涵体,亲和层析avUCP融合蛋白。
avUCP同源的哺乳动物的UCP3基因存在组织表达特异性,骨骼肌表达量较高,可能的原因是其參与骨骼肌的能量代谢[27]。已有报道,avUCP基因在鸟类的骨骼肌中特异表达,参与体温调节[28]。因此,本研究以鸟类模式生物之一-鸽为对象,提取其胸肌组织中的总RNA,克隆获得其avUCP基因的部分序列,用于抗体的制备。人工制备特异性抗体的方法包括:多克隆抗体、单克隆抗体和基因工程抗体[29]。基于实验成本、周期和目的要求,本研究选择制备avUCP多克隆抗体。免疫原的线性表位是决定决定抗原特异性的关键。利用Immune Epitope Database and Analysis Resource(IEDB)在线工具分析avUCP蛋白序列,选取亲水性较高、线性表位较好的第114~297个氨基酸序列作为免疫多肽序列。本研究成功纯化了含有该序列的融合6个His标签的重组蛋白,免疫获得的抗体效价达到1∶51200,说明选择的抗原片段具有良好的免疫原性。同时,利用Western blot方法显示制备的抗体具有很好的特异性。
avUCP編码307个氨基酸,与人类、哺乳动物和植物UCP具有较高的同源性[27]。avUCP氨基酸序列含有3个线粒体载体特征结构域,此结构域特征与人[30]、鼠[31]和鱼[32]的UCP相应序列特征相一致,暗示着其在进化过程中具有高度的保守性。已有氨基酸序列分析表明,鸽avUCP与其他鸟类,如火鸡(Meleagris gallopavo)、鸡、鹌鹑(Coturnix japonica)和斑胸草雀(Taeniopygia guttata)的同源性高达约93%[33]。本研究利用制备的兔抗鸽avUCP抗体免疫检测了鸟纲画眉科画眉鸟(Garrulax canorus)和椋鸟科灰背椋鸟(Sturnus sinensis)骨骼肌avUCP基因的表达情况。结果显示所制备的抗体能够杂交出单一且符合预期结果的目的条带,表明本研究制备的抗体具有很好的保守性和适用性。
参考文献
[1]AL–Mansour MI.Seasonal variation in basal metabolic rate and body compositionwithin individual sanderling bird Calidris alba[J].Journal of Biological Sciences,2004,4(4):564–567.
[2]Lindsay CV,Downs CT,Brown M.Physiological variation in Amethyst Sunbirds(Chalcomitra amethystina)over an altitudinal gradient in winter[J].Journal of Experimental Biology,2009,212(4):483–493.
[3]Himms-Hagen J. Brown adipose tissue thermogenesis:role in the thermoregulation,energy regulation and obesity[M]// Schonbaum E,Lomax P. Thermoregulation physiology and biochemistry. New York:Pergamon Press:1990,327–414.
[4]Vian A,Martin DB. The on-off switches of the mitochondrial uncoupling proteins[J].Trends in Biochemical Sciences,2009,35(5):298-307.
[5]Brand MD,Chien LF,Ainscow EK,et al. The causes and functions of mitochondrial proton leak[J].Biochimica et Biophysica Acta(BBA)- Bioenergetics,1994,1187(2):132-139.
[6]Cannon B,Golozoubova V,Matthias A,et al. Is there a life in the cold without UCP1? Uncoupling proteins and thermoregulatory thermogenesis[M]// Heldmaier G,Klingenspor M. Life in the cold. Berlin:Springer:2000,387-400.
[7]Nicholls DG,Bernson V,Heaton G. The identification of the component in the inner membrane responsible for regulating energy dissipation[M]// Girardier L,Seydoux J. Effectors of Thermogenesis. Basel:Birkhauser Verlag:1978,89-93.
[8]Klingenberg M,Huang SG. Structure and function of theuncoupling protein from brown adipose tissue[J].Biochimica et Biophysica Acta(BBA)- Biomembranes,1999,1415(2):271-296.
[9]Fleury C,Neverova M,Collins S,et al. Uncoupling protein-2:a novel gene linked to obesity and hyperinsulinemia[J].Nature Genetics,1997,15(3):269-72.
[10]Boss O,Samec S,Paoloni-Giacobino A,et al. Uncoupling protein-3:a new member of the mitochondrial carrier family with tissue-specific expression[J].FEBS Letters,1997,408(1):39-42.
[11]Mao WG,Yu XX,Zhong A,et al. UCP-4,a novel brain-specific mitochondrialprotein that reduces membrane potential in mammalian cells[J].FEBSLetters,1999,449(2),293-293.
[12]Yoshitomi H,Yamazaki K,Tanaka I. Cloning of mouseuncoupling protein 3 cDNA and 5′-flanking region,andits genetic map[J].Gene,1998,215(1):77-84.
[13]Raimbault S,Dridi S,Denjean F,et al. An uncoupling protein homologue putatively involved in facultative muscle thermogenesis in birds[J].Biochemical Journal,2001,353(3):441-444.
[14]Sami D,Okanlawon O,Quirine S,et al. Gene expression,tissue distribution and potential physiological role of uncoupling protein in avian species[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2004,139(3):273-283.
[15]Vianna CR,Hagen T,Zhang CY,et al. Cloning and functional characterization of an uncoupling protein homolog in hummingbirds[J].Physiological Genomics,2001,5(3):137-145.
[16]Talbot DA,Duchamp C,Rey B,et al. Uncoupling protein and ATP/ADP carrier increase mitochondrial proton conductance after cold adaptation of king penguins[J].The Journal of Physiology,2004,558(1):123-135.
[17]Collin A,Malheiros RD,Moraes VMB,et al. Effects of dietary macronutrient content on energy metabolism and uncoupling protein mRNA expression in broiler chickens[J].British Journal of Nutrition,2003,90(2):261-269.
[18]Abe T,Mujahid A,Sato K,et al. Possible role of avian uncoupling protein in down-regulating mitochondrial superoxide production in skeletal muscle of fasted chickens[J].FEBS Letters,2006,580(20):4815-4822.
[19]孜拉吉古麗·西克然木,马纪,库尔班·吐松,等.小胸鳖甲胞外铜锌超氧化物歧化酶重组蛋白的原核表达及多克隆抗体制备[J].四川动物,2019,38(4):387-393.
[20]李铭,张志国,胡敏,等.鸽Beclin1基因克隆,原核表达与多克隆抗体制备[J].中国家禽,2018,40(17):19-22.
[21]贾琳琳.王鸽α-Syn基因克隆及AVM急性中毒对其在脑组织中表达的影响[D].哈尔滨:东北农业大学:2011. 25-27.
[22]Ferver A,Dridi S. Regulation of avian uncoupling protein(av-UCP)expression by cytokines and hormonal signals in quail myoblast cells[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2020,248:110747.
[23]Emre Y,Hurtaud C,Ricquier D,et al. Avian UCP:The Killjoy in the Evolution of the Mitochondrial Uncoupling Proteins[J].Journal of Molecular Evolution,2007,65(4):392-402.
[24]Klein A,Margit Kulcsár,Virág Krízsik,et al. Effects of environmental temperature on thyroid hormones in the barn owl(Tyto alba)[J].Acta Veterinaria Hungarica,2006.,54(3):321-331.
[25]Rey B,Roussel D,Romestaing C,et al. Up-regulation of avian uncoupling protein in cold-acclimated and hyperthyroid ducklings prevents reactive oxygen species production by skeletal muscle mitochondria[J].BMC Physiology,2010,10(1):5.
[26]尹珊.猪瘟病毒Erns、NS4A、NS4B、NS5A蛋白的原核表达及多克隆抗体的制备[D].南宁:广西大学.2013.
[27]贾俊静,李青,赵彦光,等.调节禽类体内产热作用的候选基因-禽解偶联蛋白质基因[J].中国家禽,2003,7(1):118-120.
[28]Walter I,Seebacher F. Endothermy in birds:underlying molecular mechanisms[J].Journal of Experimental Biology,2009,212(15):2328-2336.
[29]李军.Nanog基因的原核表达、蛋白纯化及抗体制备[D].杨凌:西北农林科技大学.2007.
[30]Solanes G,Vidal-Puig A,Grujic D,et al. The human uncouplingprotein-3 gene Genomic structure,chromosomallocalization,and genetic basis for short and long formtranscripts[J].The Journal of Biological Chemistry,1997,272(41):25433-25436.
[31]Yoshitomi H,Yamazaki K,Tanaka I. Cloning of mouseuncoupling protein 3 cDNA and 5′-flanking region,andits genetic map[J].Gene,1998,215(1):77-84.
[32]Wen Z Y,Liang X F,He S,et al. Molecular cloning andtissue expression of uncoupling protein 1,2 and 3 genesin Chinese perch(Siniperca chuatsi)[J].ComparativeBiochemistry and Physiology. Part B,2015,185(3):24-33.
[33]田勇,李國勤,陶争荣,等.鸽UCP3基因克隆、序列特征及组织表达分析[J].农业生物技术学报,2018,26(11):1938-1948.
(责编:王慧晴)

