培养条件对食源性混合病原菌生物被膜形成的影响
张钰皎,胡炜东,黄海英,赵雪平,孙子羽,满都拉,陈忠军,*
(1.内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018;2.内蒙古农业大学职业技术学院,内蒙古包头014109)
金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)和沙门氏菌(Salmonella)是重要的食源性病原菌,其引起的食物中毒是最常见的细菌性疾病之一[1]。金黄色葡萄球菌、大肠杆菌和沙门氏菌适应性极强,在各种不利环境中通常以生物被膜的形式生存[2]。细菌生物被膜(biofilm)是嵌入胞外多糖中的有组织的微生物聚集体,微生物附着于物体表面后,通过相互作用释放胞外多糖将自身包裹其中而形成生物被膜[3]。食源性病原菌在形成生物被膜后对外界不良环境抵抗力增强,极难被抗生素等杀菌剂清除[4]。食源性病原菌生物被膜会对食品加工器具设备、加工厂地板和墙壁表面造成持续性污染,一旦清除不完全将会导致严重的食品安全问题,并造成因食品腐败而引起的经济损失[5]。
生物被膜的形成过程中受到多种营养因素的调控,比如载体、生长温度、时间、pH 值、培养基质量分数、碳源、氮源和活菌数等极大影响着生物被膜的形成量和黏附率[6]。邓开野等[5]发现金黄色葡萄球菌(S.aureus)生物被膜受到温度、pH 值、初始菌浓度的影响。Rode等[8]发现温度、氯化钠、葡萄糖和乙醇的联合作用可促进金黄色葡萄球菌生物被膜的形成。食品加工环境的不同,形成食源性病原菌生物被膜的结构也会不同。目前,国内外学者主要致力于研究单一菌种生物被膜的形成条件,对混合菌生物被膜研究鲜少。因此,探究培养条件对混合菌生物被膜形成的影响至关重要。
本文以96 孔聚苯乙烯培养板为载体,经结晶紫染色法染色后,通过测定其黏附率,探究培养基pH 值、培养温度和培养时间对金黄色葡萄球菌、大肠杆菌和沙门氏菌形成的混合菌生物被膜的影响,并采用响应面法优化最佳培养条件。根据文献资料获得3株单一菌的最佳培养条件[9-11],在最佳形成条件下探究胰蛋白胨大豆肉汤(tryptone soy broth,TSB)培养基质量分数、NaCl 质量分数和葡萄糖质量分数对金黄色葡萄球菌、大肠杆菌、沙门氏菌及其混合菌形成的生物被膜的影响。揭示培养条件对单一菌和混合菌生物被膜的影响规律,为今后探究食源性病原菌生物被膜生理生化特性和控制食品加工环境中生物被膜的形成提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
金黄色葡萄球菌(Staphylococcus aureus)CMCC 26003-3、大肠杆菌(Escherichia coli)ATCC 11775-3、沙门氏菌(Salmonella)ATCC 14028:中国普通微生物菌种保藏管理中心。
1.1.2 试剂
磷酸氢二钾、磷酸氢二钠:天津市永大化学试剂开发中心;结晶紫、氯化钠、氯化钾:鸿之惠商贸有限公司;草酸铵、甲醇、冰醋酸、乙醇:上海国药集团化学试剂有限公司。以上所用试剂均为分析纯。
1.1.3 培养基
胰蛋白胨大豆肉汤培养基:北京陆桥生物技术有限公司。
1.2 主要仪器与设备
Synergy H1 全功能微孔板检测仪:美国伯腾仪器有限公司;SW-CJ-1FD 超净工作台:上海博迅实业有限公司医疗设备厂;GHP 隔水式恒温培养箱:上海一恒科学仪器有限公司;LDZX 全自动高压灭菌锅:上海申安医疗器械厂;浦春JY 系列电子天平:上海浦春计量仪器有限公司;XH-C 漩涡混匀器:常州未来仪器制造有限公司;PHS-3 型pH 计:上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 菌悬液的制备
将金黄色葡萄球菌、大肠杆菌和沙门氏菌活化后,分别接种于 TSB 培养基,于 37 ℃、120 r/min 恒温培养箱中培养过夜。将菌悬液稀释至OD600nm约为0.1,备用[12]。
1.3.2 单一菌和混合菌生物被膜的培养
将金黄色葡萄球菌、大肠杆菌和沙门氏菌以1%的接种量分别接种于事先装有200 μL TSB 培养基的96 孔微量板中,37 ℃下培养24 h 后,微孔板检测仪测其630 nm 下的光密度值A1,空白对照记为A1C。空白对照组只加TSB 培养基,且试验组及对照组均进行3 次平行试验。将3 株单一菌悬液以体积比1 ∶1 ∶1 混合后,以1%的接种量接种于每孔添加了200 μL TSB 培养基的标准96 孔板中。在最适条件下培养后,用微孔板检测仪测定630 nm 下的光密度值,处理方法同单一菌[13]。
1.3.3 生物被膜黏附率的测定
弃去96 孔板中的培养基后,每空加入300 μL 磷酸盐缓冲液冲洗3 次;然后于每孔中添加200 μL 无水甲醇固定15 min 后弃去悬浮液,并于60 ℃下干燥1 h;随后添加200 μL 2 %结晶紫染液染色20 min,蒸馏水冲洗孔壁至冲洗液无色,干燥;最后于每孔中添加300 μL 33%冰醋酸,放置10 min;微孔板检测仪震荡 10 min 后测定 A2和 A2c[14]。黏附率(B 值)的计算公式为:
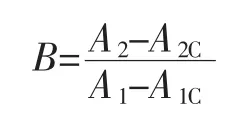
式中:A1、A2为培养和染色后的光密度值;A1c、A2c为空白对照的光密度值。
1.3.4 混合菌生物被膜最佳形成条件的确定
1.3.4.1 培养基pH 值、培养温度和培养时间对混合菌生物被膜黏附率的影响
分别配制 pH 值为 5、6、7、8、9 的 TSB 培养基,灭菌[15]。每孔中分别加入200 μL 上述培养基,混合菌接种后于37 ℃下静置培养24 h。混合菌黏附率的检测如上所述,平行试验3 次。以混合菌生物被膜的黏附率确定最佳培养基pH 值。用此方法依次确定混合菌生物被膜的最佳培养温度(25、30、37、40、45 ℃)和培养时间(12、24、36、48、60 h)[16]。
1.3.4.2 通过响应面分析确定混合菌生物被膜最佳培养条件
依据单因素试验结果,对培养基pH 值、培养温度和培养时间3 个影响因素进行响应面分析。使用Design Expert 8.0.6 软件设计模型,获取最佳培养条件参数。
1.3.5 不同营养条件对生物被膜黏附率的影响
1.3.5.1 培养基质量分数对生物被膜黏附率的影响
分别配制质量分数为0.2%、0.4%、0.8%、1.6%、3.2%、6.4%的TSB 培养基,灭菌。每孔中分别加入200 μL 不同质量分数的TSB 培养基,单一菌和混合菌分别在最适条件下培养[17]。参照1.3.3 测定单一菌和混合菌生物被膜的黏附率,进行3 次平行试验。
1.3.5.2 NaCl 质量分数对生物被膜黏附率的影响
分别配制含NaCl 质量分数为0%、0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.4%的 TSB 培养基,灭菌后于每孔中加入200 μL 含不同NaCl 质量分数的TSB培养基,单一菌和混合菌生物被膜的培养方法及黏附率的检测方法如1.3.2 和1.3.3 所述,平行试验3 次[18]。
1.3.5.3 葡萄糖质量分数对混合菌生物被膜黏附率的影响
分别配制含葡萄糖质量分数为0%、0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.4%的 TSB 培养基,灭菌后于每孔中加入200 μL 含不同葡萄糖质量分数的TSB 培养基,单一菌和混合菌生物被膜的培养方法及黏附率的检测方法同1.3.2 和1.3.3,平行试验3 次[19]。
1.3.6 数据统计分析
利用Microsoft Excel 2016 进行统计作图处理,Design Expert 8.0.6 软件设计响应面模型。
2 结果与分析
2.1 混合菌生物被膜最佳形成条件的确定
2.1.1 不同培养基pH 值、培养温度和培养时间对混合菌生物被膜黏附率的影响
将不同条件下形成的混合菌生物被膜结晶紫染色法染色后,对混合菌生物被膜黏附率(B 值)进行测定,确定最佳培养基pH 值、培养温度和培养时间,结果如图1 所示。
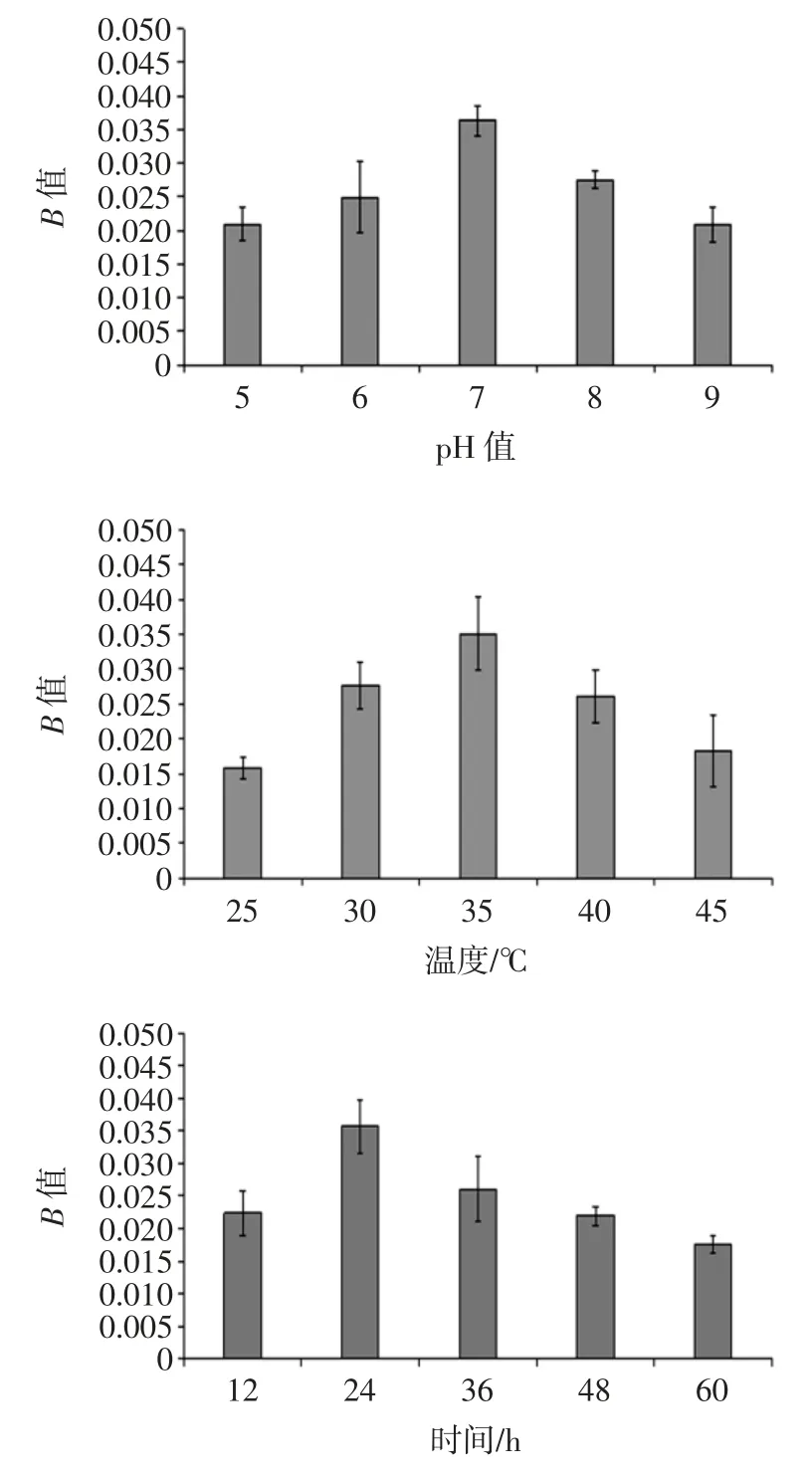
图1 培养基pH 值、温度和时间对混合菌生物被膜黏附率的影响Fig.1 Effect of medium pH value,temperature,time on the adhesion rate of mixed biofilm
由图1 可知,混合菌生物被膜的黏附率随着培养基pH 值的变化呈现先提高后降低的趋势,并于pH 7时达到最大黏附率0.036 4。马燕等[20]研究蜂房哈夫尼亚菌生物被膜时发现,中性培养条件更利于其生物被膜的形成。因此,在混合菌生物被膜培养中应选用此培养基pH 值,过酸或过碱的培养基都会抑制混合菌生物被膜的形成。混合菌生物被膜的黏附率随着培养温度的增加也呈现先提高后降低的趋势,在37 ℃时的混合菌黏附率高达0.035 1。低于37 ℃时,由于温度过低,生物被膜形成缓慢,导致黏附能力较弱。而超过37 ℃后,黏附率明显下降,说明过高的温度会减弱生物被膜的形成能力。郝旭昇等[21]探究了不同生长温度(12、25、37 ℃)对阪崎克罗诺肠杆菌ATCC 29004 生物被膜形成的影响,发现25 ℃和37 ℃下阪崎克罗诺肠杆菌的黏附菌量和生物被膜形成量高于12 ℃,但是阪崎克罗诺肠杆菌在37 ℃形成了更加致密且立体的生物被膜结构。综合考虑,混合菌生物被膜的最佳培养温度为37 ℃。不同培养时间对B 值的影响显著,培养24 h时所得的混合菌黏附率明显高于其他组分,因此选用24 h 为最佳培养时间。
2.1.2 响应面法优化混合菌生物被膜的形成条件
依据单因素试验分析结果,以黏附率(Y)为响应值,采用Design Expert 8.0.6 设计三因素三水平的Box-Behnken 试验。响应面模型因素与水平设计见表1。Box-Behnken 试验设计与结果见表2。

表1 响应面试验因素水平表Table 1 Factors and their levels of response surface design

表2 Box-Behnken 试验设计与结果Table 2 Response surface design arrangement and corresponding experimental data
应用回归分析对方程和方程的各因子进行方差分析,分析结果如表3 所示。
从表3 中可以看出,该模型极其显著(P<0.01),失拟项不显著(P>0.05),模型的决定系数 R2=0.985 3,因此可选用该方程代替真实试验点对响应值有效预测和分析。培养时间和培养温度对混合菌生物被膜的形成影响极显著(P<0.01),二次项 A2、B2和 C2极显著(P<0.01),交叉项 AB、BC 极显著(P<0.01),其它均不显著。各因素对混合菌生物被膜黏附率的影响程度顺序为A>B>C,即培养温度>培养时间>培养基pH 值。
将某因素固定在中心值不变,分析另外两个因素的交互作用对混合菌生物被膜黏附率的影响结果,如图2 所示。
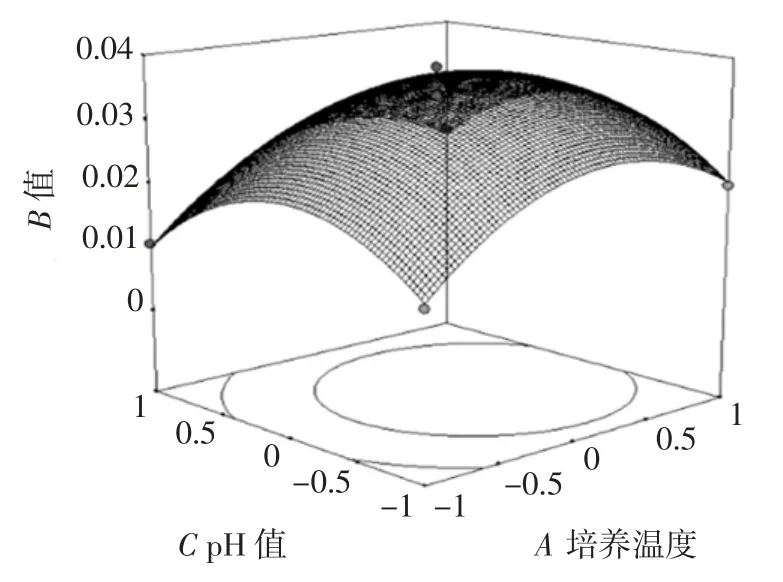
图2 两因素及其交互作用响应面图Fig.2 Surface plot and contour for reciprocal effection of three operating parameters
比较图2 曲面图和等高线可以看出,培养温度和培养时间对混合菌生物被膜的黏附率影响显著,表现为曲面较陡。而培养基pH 值对于黏附率影响不显著,培养温度和培养时间的交互作用极显著。各因素之间两两交互作用对混合菌生物被膜黏附率的影响强度由强到弱依次为:AB>BC>AC,与方差分析结果一致。回归方程求解的最佳培养条件经验证为:培养温度36.2 ℃,培养时间21.3 h,培养基pH 7.12,此条件下混合菌生物被膜的黏附率可达0.032 4。为实际操作方便,将理论混合菌生物被膜形成条件调整为培养温度为36 ℃,培养时间为22 h,培养基pH 值为7。
2.2 不同营养条件对生物被膜黏附率的影响
2.2.1 培养基质量分数对生物被膜黏附率的影响
培养基质量分数对生物被膜黏附率的影响见图3。

图3 培养基质量分数对生物被膜黏附率的影响Fig.3 Effect of medium quality score on the adhesion rate of biofilm
微生物生物被膜的形成过程中,营养条件是影响其黏附率的最大因素之一。TSB 培养基质量分数的不同,使其为微生物的黏附提供的营养不同,造成微生物生物被膜黏附率的波动。由图3 可知,大肠杆菌、金黄色葡萄球菌、沙门氏菌和混合菌生物被膜的黏附率随着培养基质量分数的变化呈现先增加后减少的趋势。且当TSB 培养基质量分数为1.6%时,形成的生物被膜黏附率最大,即大肠杆菌黏附率为0.065 2,沙门氏菌为0.030 2,金黄色葡萄球菌为0.083 2 和混合菌为0.035。单一菌和混合菌的黏附率在TSB 培养基质量分数为3.2%时呈明显下降趋势,因为微生物在营养胁迫环境下倾向于形成生物被膜,以保护自身不被外界不利条件所影响。研究发现混合菌生物被膜的黏附率低于金黄色葡萄球菌和大肠杆菌单独形成生物被膜的黏附率。这表明混合菌生物被膜中的菌株间互相存在着竞争作用,这种竞争作用的存在会使得自然条件下形成的混合菌生物被膜的黏附率有所降低。
2.2.2 NaCl 质量分数对生物被膜黏附率的影响
NaCl 质量分数对3 株单一菌及其混合菌生物被膜黏附率的影响见图4。

图4 NaCl 质量分数对生物被膜黏附率的影响Fig.4 Effect of NaCl quality score on the adhesion rate ofbiofilm
从图4 可以看出,单一菌和混合菌生物被膜的黏附率随着NaCl 质量分数的增加逐渐降低。刚添加0.2%的NaCl 时,4 种生物被膜的形成都已受到抑制。当NaCl 质量分数为0.4%时,金黄色葡萄球菌、大肠杆菌和沙门氏菌单独形成的生物被膜明显被抑制,即下降率为大肠杆菌0.026,金黄色葡萄球菌0.042,沙门氏菌0.012。但混合菌生物被膜的总体下降率明显低于3 株单一菌的下降率,说明混合菌生物被膜对NaCl 的敏感性较弱。根据文献[22]可知,混合菌生物被膜中菌株的相互竞争作用虽导致黏附率降低,但是由于不同微生物分泌的胞外物质不同,增加了混合菌生物被膜的复杂性使得混合菌生物被膜对外界的抵抗力较强。高浓度的NaCl 产生的渗透压可使细胞脱水直至死亡[23]。因此,NaCl 质量分数越高,微生物生物被膜的黏附率越低。可推测一定浓度的NaCl 可以有效抑制微生物形成生物被膜,为食品加工中有效控制生物被膜的生长提供依据。
2.2.3 葡萄糖质量分数对生物被膜黏附率的影响
葡萄糖质量分数对生物被膜黏附率的影响见图5。

图5 葡萄糖质量分数对生物被膜黏附率的影响Fig.5 Effect of glucose quality score on the adhesion rate of biofilm
微生物生物被膜中的主要成分是多糖,糖源是调控微生物形成生物被膜的主要因素之一。靳嘉巍等[24]研究表明,碳源直接决定了微生物形成生物被膜的能力,且含糖量高的微生物形成生物被膜的能力愈高。由图5 可知,单一菌和混合菌在含葡萄糖质量分数为0%~0.8%的TSB 培养基中的黏附率是逐渐上升的,说明葡萄糖可增强单一菌和混合菌生物被膜的形成能力。且大肠杆菌、金黄色葡萄球菌、沙门氏菌和混合菌的黏附率于葡萄糖质量分数为0.8%时达到最大,即大肠杆菌黏附率为0.079,沙门氏菌为0.029 8,金黄色葡萄球菌为0.096 6 和混合菌为0.042 2。葡萄糖质量分数1.0%~1.4%间黏附率虽有所下降,但仍可促进细菌黏附作用。因此可知,一定浓度的碳源可有效促进微生物形成生物被膜,且混合菌生物被膜对葡萄糖较单一菌生物被膜敏感性强,在葡萄糖仅为0.2%时黏附率已高达0.038 2,且基本维持稳定。因此在食品加工过程中,应多次清洗食品加工器具及设备,尽可能降低食品加工过程中的糖分残留量,以避免微生物形成生物被膜而造成食品安全隐患。
3 结论
以96 孔微量板作为单一菌和混合菌生物被膜的黏附载体,通过单因素试验和响应面法优化了培养温度、培养时间和培养基pH 值对食源性病原菌金黄色葡萄球菌、大肠杆菌、沙门氏菌形成的混合菌生物被膜的最佳形成条件。结果表明,混合菌生物被膜的最佳培养温度为36 ℃,最佳培养时间为22 h,最适培养基pH 值为7。在此最佳培养条件下进一步研究营养物质对单一菌和混合菌生物被膜形成能力的影响,研究发现TSB 培养基质量分数、NaCl 质量分数和葡萄糖质量分数均对金黄色葡萄球菌、大肠杆菌、沙门氏菌和混合菌生物被膜的形成能力有显著影响。其中TSB 培养基质量分数为1.6 %时形成的生物被膜黏附率最大;碳源加强了单一菌和混合菌生物被膜的黏附率,因此在高糖类食品生产中应格外注意病原菌生物被膜的形成;而当NaCl 质量分数大于0.4%时,对食源性病原菌生物被膜的形成有一定的抑制作用,因此在食品加工中可以通过添加NaCl,并结合其它抑菌方法来抑制清除食源性病原菌形成的生物被膜。

