姜黄挥发油诱导肺癌细胞凋亡及机理研究
赵明明,卢彩会,牟德华,*
(河北科技大学生物科学与工程学院,河北石家庄050000)
姜黄挥发油(Curcuma longa L.volatile oil,TVO)为姜科植物姜黄(Curcuma longa L.)的块状根茎经水蒸气蒸馏法得到的挥发性油,所含成分较为复杂,一般含有数十至数百种组分,其主要成分是芳姜黄酮(约为40%)、姜烯等化合物[1-4]。姜黄挥发油具有抑菌、抗炎镇痛、抗氧化、抗肿瘤、抗淤血、抗血管生成及降血脂等功能[5-11]。近年来国内外研究表明,姜黄挥发油具有良好的抗肿瘤效果,可以有效抑制人皮肤癌SCL-1[12]、皮肤鳞状细胞癌A431[13]、肝癌细胞MMC-7721[14]、急性单核细胞白血病THP-1 细胞[15]的增殖。
癌症是全世界最致命的疾病之一,是人类死亡的第二大主因。中国肺癌发病率在过去40 年快速升高,其5 年生存率仅为20%,并已成为中国发病率、死亡率最高的恶性肿瘤之一[16]。肺肿瘤分为两种组织学类型:15 %为小细胞型肺癌(small cell lung cancer,SCLC),85%的肺癌病例为非小细胞型肺癌(non-small cell lung cancer,NSCLC),是最常见的侵袭性类型细胞,到NSCLC 被诊断时,大多数情况下已经扩散到身体的其他器官,A549 细胞便是非小细胞肺癌细胞系的一种[17-18]。由于使用抗癌化学药物杀死癌细胞的同时,会对正常体细胞产生一定的毒副作用。因此对于天然产物中高效、低毒的抗癌活性成分研究成为现代国内外的研究热点[19]。最近,植物来源的生物活性化合物被认为是一种有效的抗癌剂,其中植物来源的精油已被用于医药应用[20]。
姜黄中的主要有效活性物质是姜黄素类化合物和姜黄油,目前国内外对其功能性的研究报道主要针对于姜黄素类化合物,由于姜黄挥发油的提取及溶解的复杂性故对于姜黄挥发油的功能性研究较少。因此,本文从细胞的活力、形态、迁移能力、凋亡周期等多方面系统地研究姜黄挥发油及主要成分抑制A549 细胞增殖作用及促进其细胞凋亡的机理。为不断地深入研究姜黄挥发油的抗肿瘤作用机制提供试验依据,同时也为后期寻找高效且低毒的天然抗癌药物开辟新的途径。
1 材料与方法
1.1 材料与试剂
人肺癌A549 细胞:由河北科技大学生物科学与工程学院提供并传代培养维持。
制备姜黄挥发油:采用产于印度卡纳塔克邦的姜黄根茎,打碎过40 目筛,使用离子液体[BMIM]PF6 酶法辅助提取得到的姜黄挥发油为橙黄色透明状液体,且具备典型的姜黄气味[21]。
制备姜黄挥发油储备液:将制备得到的姜黄挥发油用0.1 %二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,且稀释成不同的浓度备用。
RPMI-1640 培养基、胰蛋白酶、青霉素链霉素(双抗):Gibco 公司;胎牛血清:石家庄茂财生物科技有限公司;噻唑蓝溴化四唑(methl thiazolyl tetrazolium,MTT)、5-氟尿嘧啶、芳姜黄酮(纯度>99.8%)、二甲基亚砜、吖啶橙:上海宝曼生物科技有限公司;磷酸盐缓冲溶液(phosphate buffer saline,PBS):北京索来宝科技有限公司;膜联蛋白-V/碘化丙啶(Annexin V-FITC/PI)细胞凋亡试剂盒:上海翊圣生物科技有限公司;多聚甲醛:天津市永大化学试剂有限公司;结晶紫:天津市光复精细化工研究所。
1.2 仪器与设备
分析天平(ar2140):美国奥豪斯仪器有限公司;CO2培养箱(BPN-150CH):上海一恒科学仪器有限公司;超净工作台(SW-CJ-IFD):苏净集团安泰空气技术有限公司;离心机(LG10-2.4A 型):北京医用离心机厂;自动控压蒸汽灭菌锅(D-1-70 型):北京发恩科贸有限公司;全波长酶标仪(EPOCH2 型):美国博腾仪器有限公司;荧光倒置显微镜(IX51):日本奥林巴斯公司;流式细胞仪(accuriC6):美国 BD 公司。
1.3 试验方法
1.3.1 细胞培养
将人肺癌A549 细胞培养于由RPMI-1640 基本培养基:胎牛血清和双抗以90 ∶10 ∶1 的质量比配置成的完全培养基中,置于37 ℃,5%CO2饱和湿度环境的细胞培养箱中培养,细胞贴壁生长至80%~90%时即可消化传代,取传代至第2 代~4 代且生长状态良好的细胞进行试验。
1.3.2 细胞增殖检测
取生长至对数期的A549 细胞,经胰蛋白酶消化离心后,用含10%胎牛血清的RPMI-1640 培养基将其调整至 5×104个/mL 的细胞悬液,每孔 100 μL 接种于 96 孔培养板中。在 CO2培养箱中,37 ℃,5%CO2饱和湿度条件下培养24 h。待细胞贴壁完全后,吸去培养基,药品组加入经0.1%DMSO 稀释成终浓度分别为25、50、100、200 mg/L 的姜黄挥发油培养液。阳性对照组为80 mg/L 的5-氟尿嘧啶和50 mg/L 的芳姜黄酮。另设细胞对照组(不加药)和空白调零组(只加RPMI-1640 培养基),每组均设置6 个重复试验,分别培养24、48、72 h,每孔加入 MTT 溶液(5g/L)20 μL,且调零组不加MTT,培养箱中继续孵育4 h。小心吸去培养基,在每孔加入150 μL 0.1%DMSO,摇床低速振荡20 min至彻底溶解。酶标仪测定在490 nm 波长处各孔的吸光度(optical density,OD)值,计算细胞增殖抑制率,计算公式为:
细胞增殖抑制率/%=(OD1-OD2)/(OD1-OD3)×100
式中:OD1为对照组的吸光度值;OD2为加药组的吸光度值;OD3为空白调零组的吸光度值。
1.3.3 吖啶橙(acridine orange,AO)染色
取生长至对数期的A549 细胞,经胰蛋白酶消化并稀释细胞密度为5×105个/mL 接种到6 孔板,置于细胞培养箱(37 ℃,5%CO2)中孵育,待细胞长到70%~80%左右时,更换培养基同时加入不同浓度姜黄挥发油(50、100、150 mg/L)1 mL/孔,并设置空白对照组和五氟尿嘧啶阳性对照组。加药处理24 h 后加入40 μL 30 mg/L 的吖啶橙AO 染液避光染色10 min 后,在倒置荧光显微镜下观察细胞的形态变化并拍照记录[22]。
1.3.4 细胞凋亡周期检测
取生长至对数期的A549 细胞,经胰蛋白酶消化并稀释到细胞密度为5×105个/mL 接种到6 孔板中,培养至贴壁24 h 后进行加药处理,设置姜黄挥发油的浓度梯度为 50、100、150 mg/L。孵育 48 h 后,加入 0.25%的胰酶进行消化,收集每个孔内的细胞,且死细胞一并收集。用预冷的PBS 缓冲溶液冲洗两次后,离心后弃上清液,加入100 μL 1×Binding Buffer 以重悬细胞,随后加入 5 μL Annexin V-FITC 及 10 μL PI 工作液混匀,37 ℃避光孵育 15 min。再加入 400 μL 1×Binding Buffer,混匀后放入冰上,样品在1h 内用流式细胞仪上机检测[23]。
1.3.5 细胞迁移检测
1.3.5.1 细胞划痕试验
将细胞密度为5×105个/mL 的A549 细胞接种到6孔板,待单层长满后,使用20 μL 无菌微量移液器尖端在各孔细胞中间垂直画一个“一”字。无菌的PBS 洗去脱落的细胞,加入无血清的RPMI-1640 基本培养基,药品组分别加入终浓度为50、100、150 mg/L 的姜黄挥发油,阳性对照组加入浓度为80 mg/L 的5-氟尿嘧啶,空白对照组用0.1%DMSO 处理。将6 孔板置于培养箱中,分别培养0、48、72 h 后每孔选取3 个不同视野进行显微镜拍照观察。
伤口愈合率/%=(0 h 划痕距离-48/72 h 划痕距离)/0 h 划痕距离×100
1.3.5.2 集落形成试验
取生长至对数期的A549 细胞,经胰蛋白酶消化并调整细胞密度为1×103个/孔,接种到6 孔板中,培养24 h 后倾弃培养基。阳性对照组加入浓度为80 mg/L的5-氟尿嘧啶,试验组分别加入浓度梯度为50、100、150 mg/L 的姜黄挥发油进行处理,0.1%DMSO 作为空白对照组。孵育48 h 后吸出原培养基,用pH 6.8 的磷酸缓冲溶液洗涤2 次,加入无任何药物的新鲜培养基,根据培养液中pH 值的变化更换培养基。在第10 天时用4%多聚甲醛固定细胞,在温度为25 ℃时用0.2%的结晶紫染色30 min。显微镜下记录大于50 个细胞的克隆数,后按下式计算集落抑制率。
集落抑制率/%=(接种细胞数-集落数/接种细胞数)×100
1.4 统计方法
本文中所有试验均设置3 组平行。试验数据采用SPSS 17.0 软件统计分析,组间数据的比较采用(Oneway ANOVA)单因素方差分析,以P<0.05 表示有显著性差异,P<0.01 为极显著差异。
2 结果与分析
2.1 姜黄挥发油对细胞增殖的影响
姜黄挥发油对A549 肺癌细胞的抑制作用见图1。

图1 姜黄挥发油对A549 肺癌细胞的抑制作用Fig.1 The inhibitory effect of Curcuma longa L.volatile oil on A549 lung cancer cells
由图1 可以看出,姜黄挥发油对A549 肺癌细胞的抑制作用呈现出一定的剂量和时间依赖关系。同一药物浓度下,作用时间越长,抑制作用越明显。同一时间段内,随着药物浓度增大,细胞增殖抑制率增加。当加入姜黄挥发油浓度为200 mg/L,作用72 h 时,细胞增殖抑制率达到72.93%。芳姜黄酮在姜黄挥发油中占39.37%,是姜黄挥发油中发挥抗肿瘤活性的主要成分[24-25]。本试验中50 mg/L 的姜黄挥发油与阳性对照组50 mg/L 的芳姜黄酮对于细胞增殖抑制效果没有显著差异,进一步证明了芳姜黄酮是姜黄挥发油中起主要抑制肿瘤增殖作用的有效成分。
2.2 吖啶橙染色
姜黄挥发油对A549 肺癌细胞凋亡形态的影响见图2。
由图2A 可知,随着加入姜黄挥发油浓度的增大,细胞数量呈明显的减少趋势。空白组与加药组相比具有完整的细胞形态,细胞核染色亮度均匀,且细胞核边缘比较清晰。图2B 显示,姜黄挥发油促使癌细胞外形发生了新月形颗粒状的变化,细胞膜出现发泡现象,细胞体变小、变圆甚至脱落。且细胞核内染色质部分皱缩,细胞核浓聚、偏位[26]。经150 mg/L 姜黄挥发油处理条件下的大部分癌细胞已经凋亡且结构被完全破坏。可见姜黄挥发油对人肺癌A549 细胞具有很好的凋亡诱导作用。
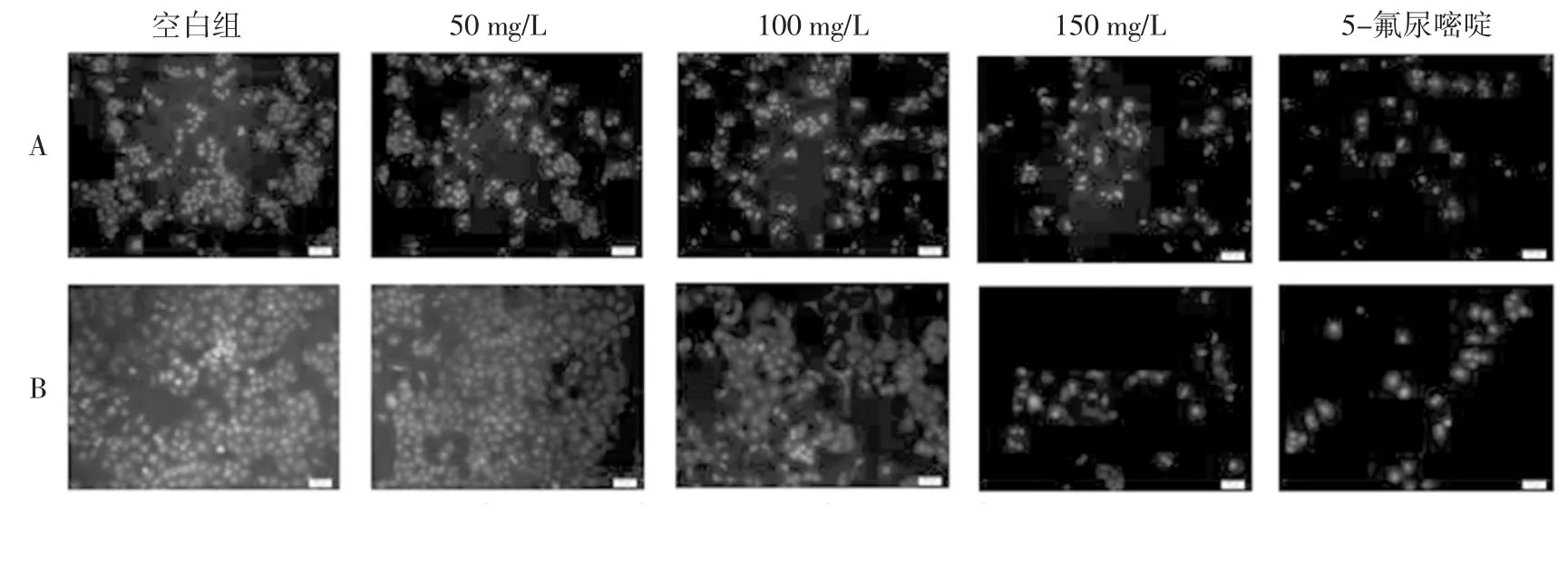
图2 姜黄挥发油对A549 肺癌细胞的凋亡形态影响Fig.2 Effect of Curcuma longa L.volatile oil on apoptosis of A549 lung cancer cells
2.3 流式细胞仪测定细胞周期
姜黄挥发油对A549 肺癌细胞凋亡周期的影响见图3。
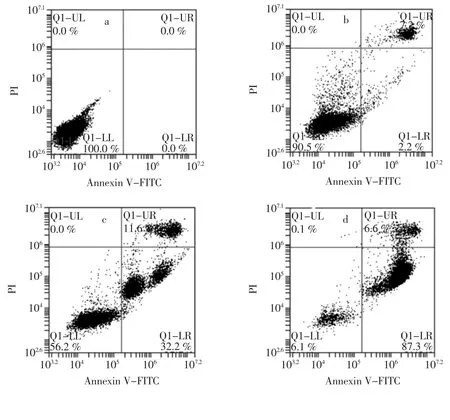
图3 姜黄挥发油对A549 肺癌细胞凋亡影响Fig.3 Effect of Curcuma longa L.volatile oil on apoptosis of A549 lung cancer cells
由流式细胞散点图可以看出姜黄挥发油抑制细胞增殖的可能性因素是诱导细胞凋亡。细胞凋亡的主要特征是来自于细胞质膜的磷脂酰丝氨酸(phosphatidylserine,PS)外化以及细胞中膜完整性的丧失[27]。由图3a 看出,癌细胞由姜黄挥发油处理48 h 后表现出了4 种不同类型的细胞群,活细胞、早期凋亡细胞、晚期凋亡细胞以及坏死的细胞[28]。随着加药浓度的增大,细胞的凋亡率也随之增加。当浓度为50 mg/L 时活细胞数比例为94.7%,凋亡率为5.2%。当浓度增加至150 mg/L 时,活性细胞数下降至56.2%,但细胞凋亡率上升至43.8%。试验结果很好的证明了姜黄挥发油对于促进癌细胞凋亡起到了一定促进的作用。
2.4 细胞迁移试验
2.4.1 划痕试验
姜黄挥发油对A549 肺癌细胞划痕伤口愈合率的影响见图4。

图4 姜黄挥发油对A549 肺癌细胞划痕愈合的影响Fig.4 Effect of Curcuma longa L.volatile oilon scratch healing of A549 lung cancer cells
由图4a 所示,加药处理48 h 和72 h,各浓度姜黄挥发油均具有抑制细胞迁移作用,且时间越长抑制作用越明显。空白组细胞在72 h 时划痕距离完全闭合,而经150 mg/L 姜黄挥发油作用过的细胞,划痕距离不仅没有缩短,并且发生了细胞向两边迁移的现象,细胞间的间隙增大且明显脱落。如图4b 所示,细胞划痕愈合率与加药浓度呈剂量依赖性关系。与空白对照组相比,不同浓度姜黄挥发油处理均能显著抑制细胞划痕闭合率(P<0.05),且加药浓度越高,伤口愈合能力越低。
2.4.2 集落形成试验
姜黄挥发油对A549 肺癌细胞集落形成的抑制作用见图5。
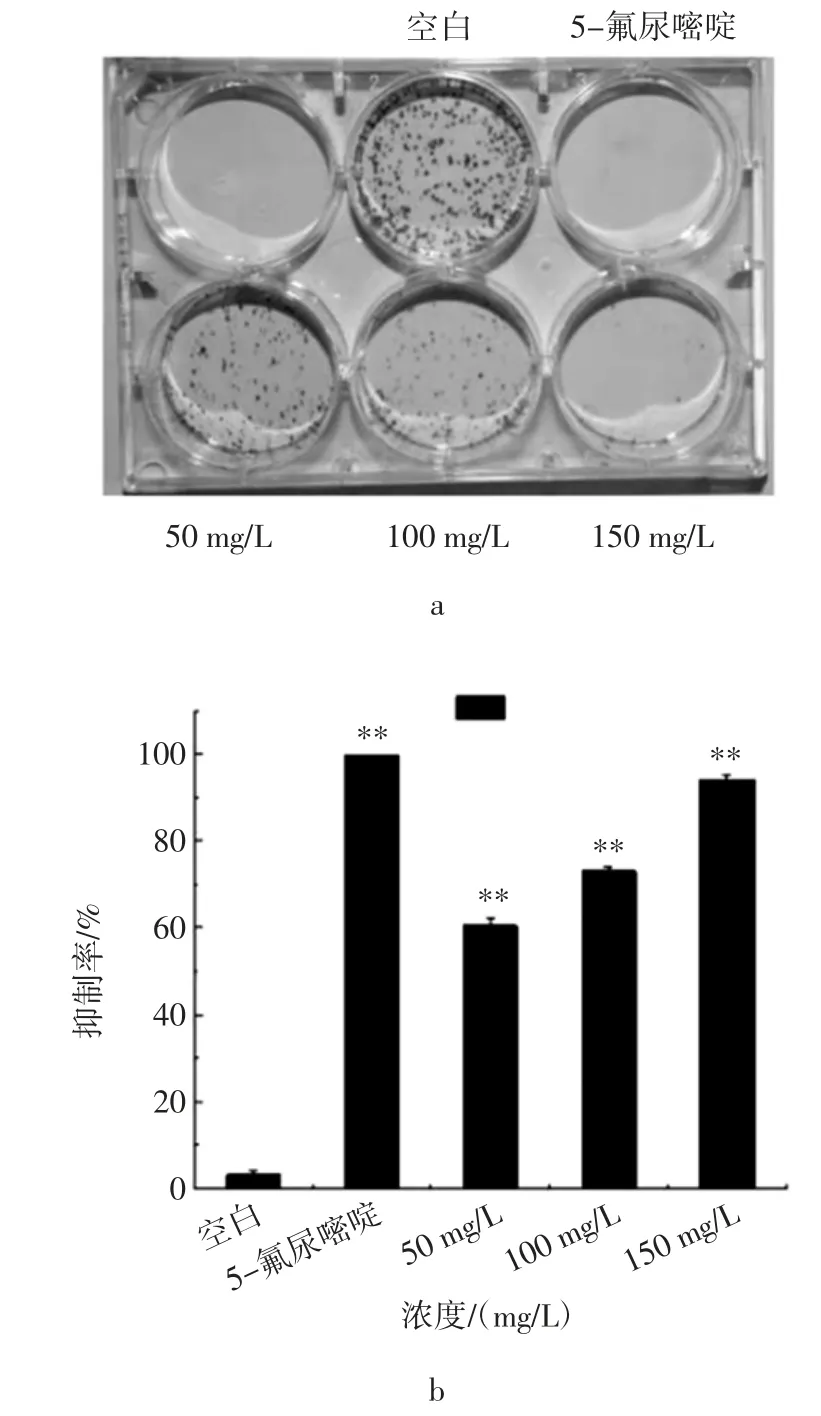
图5 姜黄挥发油对细胞集落形成的影响Fig.5 Effect of Curcuma longa L.volatile oil on Cell Colony Formation
如图5a 所示,为肺癌细胞A549 细胞经姜黄挥发油处理48h 后的集落形成情况,随给药浓度的升高,细胞集落形成率依次降低。图5b 直观的显示了姜黄挥发油对癌细胞抑制作用的定量分析,姜黄挥发油各浓度剂量组与对照组相比,对肺癌细胞集落形成均具有显著抑制作用(P<0.05)[29]。当浓度为 150 mg/L 时,细胞集落增长抑制率达到94.2%。集落形成的试验结果分析表明,姜黄挥发油可以显着抑制人肺癌A549 细胞的增殖。
3 结论与讨论
细胞凋亡是机体为了维持机体内环境的稳态平衡,而由基因控制的细胞自主性的有序死亡,这与基因的激活、基因的表达以及基因调控等作用功能相关。细胞周期调控紊乱凋亡减少及突变细胞恶性增殖是癌症发生的一个重要因素,故诱导肿瘤细胞的凋亡、抑制癌细胞的增殖,是很多药物阻碍肿瘤细胞生长的作用机制之一,也是预防和治疗癌症的有效途径[30-32]。
近期对姜黄挥发油在癌症方面的研究逐渐增加,作为一种天然的植物精油,其在多种肿瘤的防治过程中起到重要的作用[33]。本研究将姜黄挥发油作用于人肺癌A549 细胞,发现其能显著的发挥抗癌作用并呈现出明显的时间和剂量依赖性关系。通过MTT 试验考察了姜黄挥发油对A549 细胞的存活率的影响,并且证实了芳姜黄酮是姜黄挥发油中发挥抗肿瘤效果的主要成分。AO 染色试验发现姜黄挥发油作用在A549细胞后,能够破坏其细胞结构,发挥促进细胞凋亡作用。流式细胞仪对其诱导的细胞凋亡周期结果进行分析,可以看出经不同浓度的加药处理后的A549 细胞,其早期和晚期凋亡的细胞数量均有所增加。细胞迁移试验结果显示姜黄挥发油对A549 细胞的体外迁移能力具有明显的抑制作用。姜黄的分布较广泛,廉价易得,且姜黄挥发油的毒副作用小,这为进一步探索抗肿瘤的新型候选药物提供了可能性,为抗癌药物的开发与研究提供了依据。

