传统发酵蓝莓饮料中乳酸菌的分离鉴定及筛选
胡楠,雷鸣,王远一飞,王俊平,王硕,2,*
(1.天津科技大学食品工程与生物技术学院食品营养与安全国家重点实验室,天津300457;2.南开大学医学院天津市食品科学与健康重点实验室,天津300071)
乳酸菌是一种具有安全性且常用发酵食品的微生物[1]。乳酸菌能够在适宜条件下快速繁殖、产酸,使发酵基质的pH 值迅速降低,不仅有效抑制耐酸能力较差的微生物在发酵基质中的生长繁殖,还能够赋予发酵食品独特的味道[2]。目前,乳酸菌被广泛应用于酸奶[3]、泡菜[4]、酸菜[5]和发酵型饮料[6]等发酵食品中。
传统发酵蓝莓饮料主要采用自然发酵的方式,利用水果果皮、环境或地域等天然存在的微生物作为发酵菌株[7],通过微生物间的优胜劣汰来完成发酵。其中,主导发酵的菌株多为乳酸菌[8],但仍存在一些杂菌和少数致病菌,并且该方法存在发酵工艺不易控制和成品品质参差不齐等缺点。近年来,研究人员采用直投菌种的方式实现发酵蓝莓果汁[9],但多采用商业化的菌株,缺少对其针对性的筛选。利用生物学手段从自然发酵的蓝莓饮料中分离筛选出发酵性能优异的菌株,对于产品生产、质量控制和安全性具有实际意义[10],并可为后续研究发酵机理和功能成分代谢提供了理论基础。
本文从传统发酵蓝莓饮料中分离和鉴定出乳酸菌,分析其产酸能力、耐受性能力和蓝莓发酵过程中的生长能力,从而筛选出可用于发酵蓝莓果汁的乳酸菌。
1 材料与方法
1.1 材料与试剂
传统发酵蓝莓饮料:黑龙江省伊春市。
MRS 培养基、MRS 肉汤:北京陆桥技术股份有限公司;细菌DNA 提取试剂盒:TIANGEN 生化科技(北京)有限公司。
1.2 仪器与设备
全自动生长曲线分析仪(FP-110-C):芬兰Bioscreen C 公司;数码生物显微镜(DN-117M):宁波永新光学股份有限公司;pH 计(FE-28):瑞士梅特勒公司;高压灭菌器(HVA-85):日本 HIRAYAMA 公司;凝胶成像仪和电泳仪:美国Bio-Rad 公司;离心机(5804 R):德国Eppendorf 公司。
1.3 方法
1.3.1 样品DNA 提取及16S rDNA 测序
传统发酵蓝莓饮料样品送至天津诺禾致源生物信息科技有限公司,采用十六烷基三甲基溴化铵法(cetyltrimethylammonium ammonium bromide,CTAB)法[11]提取样品DNA,以515F-806R 为引物扩增细菌16S V4 区,并进行高通量测序文库的构建和Ion S5 XL平台的单端测序。
1.3.2 乳酸菌的分离纯化及保种
将传统蓝莓发酵饮料样品等梯度稀释后涂布于含有 2%碳酸钙的 MRS 培养基[12],37 ℃厌氧培养(48±2)h。挑取平板上具有溶钙圈的菌落进行三区划线,重复3 次,得到纯化菌株。将纯化后的菌株接入MRS 肉汤中,37 ℃过夜静置培养。吸取10 μL 该菌液再接入MRS 肉汤中重复培养3 次后,进行保种及菌种鉴定。
1.3.3 乳酸菌的鉴定与形态学分析
参照TIANGEN 基因组DNA 提取试剂盒[13]说明书进行DNA 提取。以DNA 为模板进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,引物分别为27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和 1492R(5’-GGTTACCTTGTTACGACTT-3’)[14]。经琼脂糖凝胶电泳检测,将条带清晰且单一[15]的PCR 产物送至金维智生物科技有限公司进行测序。序列比对采用GenBank 中的 BLAST 进行分析(https://blast.ncbi.nlm.nih.gov/Blast.cgi)[16]。
对鉴定后的菌株进行菌落特征观察和细胞形态学观察[17]。
1.3.4 乳酸菌初筛
利用Geneious 软件将乳酸菌纯化菌株的16SrDNA序列与样品高通量测序中所有聚类单元(operational taxonomic unit,OTU)代表序列进行比对,选出与乳酸菌的OTU 代表序列匹配度为100%的菌株。
1.3.5 乳酸菌复筛
1.3.5.1 产酸试验
将初筛得到的菌种以5%的接种量接入MRS 肉汤中,厌氧培养24 h 后测定菌液pH 值,确定各菌株产酸能力。
1.3.5.2 胃液及胆汁耐受能力
参考Charteris 和Pacheco 等[18-19]方法测定胃液及胆汁耐受能力,略有改动,具体方法如下:
取 1 mL 菌液,4 ℃、12 000 r/min 离心 5 min,弃去上清液,用生理盐水洗涤2 次,将沉淀于1 mL 生理盐水中充分混匀。在10 mL 人工胃液(pH 2.0)和10 mL 人工胆汁中分别加入100 μL 上述菌液,分别在37 ℃下孵育1 h 和2 h。参考GB/T 4789.35-2016《食品安全国家标准食品微生物学检验乳酸菌检验》进行活细胞计数[20]。
1.3.6 乳酸菌生长曲线的绘制
参考刘书亮等[21]方法测定生长曲线,略有改动,具体方法如下:
以5%的接种量将上述菌种分别接入MRS 肉汤中,转至100 孔板中,利用全自动生长曲线分析仪测定其生长曲线。37 ℃培养,每隔1 h 测定吸光度(检测波长600 nm)。以培养时间为横坐标,菌液OD600值为纵坐标,绘制生长曲线。
1.3.7 乳酸菌发酵蓝莓果汁终点活细胞计数
将乳酸菌培养至对数期,以5%的接种量接入蓝莓果汁中,于37 ℃静置发酵。取发酵72 h 的发酵液进行乳酸菌活细胞计数[22]。
1.3.8 数据分析
利用 Excel 2016、SPSS Statistics 20.0 等统计软件进行数据处理和分析。
2 结果与分析
2.1 传统发酵蓝莓饮料的物种相对丰度
分析传统发酵蓝莓饮料中的微生物组成可以更好地控制生产工艺以及成品质量,通过16S rDNA 高通量测序得到的传统发酵蓝莓饮料中细菌属水平物种相对丰度如图1 所示(仅展示相对丰度排名前十的物种)。
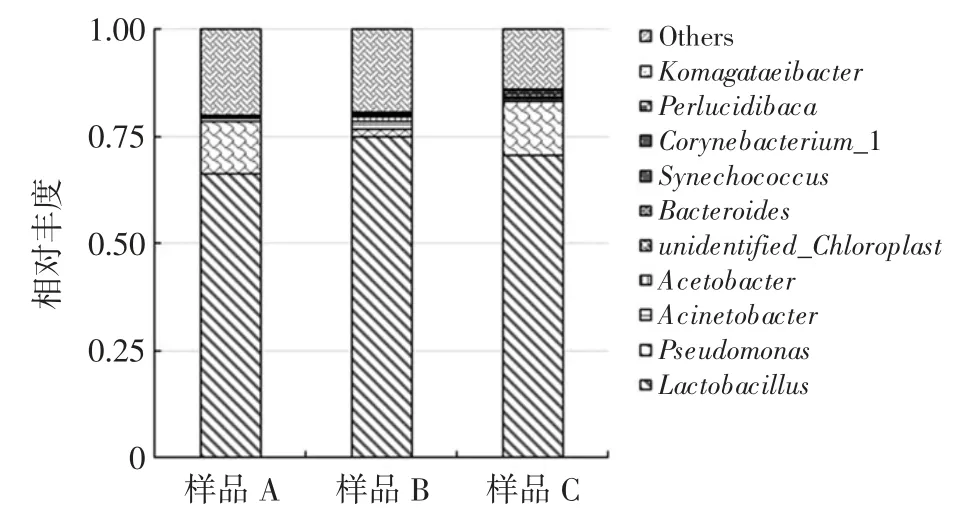
图1 传统蓝莓发酵饮料属水平物种相对丰度Fig.1 Relative abundance of traditional fermented blueberry beverages at genus level
传统发酵蓝莓饮料属水平物种相对丰度中只有乳杆菌属(Lactobacillus)和假单胞菌属(Pseudomonas)超过1%,说明其优势物种相对明显。Lactobacillus 在各样品中的相对丰度介于65.4%~73.2%之间,均值为69.1%,相对丰度排名第一,菌群优势明显。研究表明,Lactobacillus 是很多发酵食品中的主要发酵菌[3-6]。研究人员从发酵食品中分离得到该产品的主要优势菌并加以利用[23],不但较大程度上还原了发酵食品的风味而且在产品质量上也得到较好的控制。Pseudomonas在各样品中的相对丰度介于1.5%~12.1%之间,均值为8.5%,相对丰度排名第二,不是主要的发酵菌,可能在发酵过程中与发酵菌协同完成发酵,有报道称其与Lactobacillus 为芥菜发酵过程中的主要微生物[24],或者是由于成品低温储存时间过长导致其生长[25]。
2.2 菌落和菌体形态学分析
通过分离纯化得到部分纯化菌株菌落和菌体形态,如图2 所示。
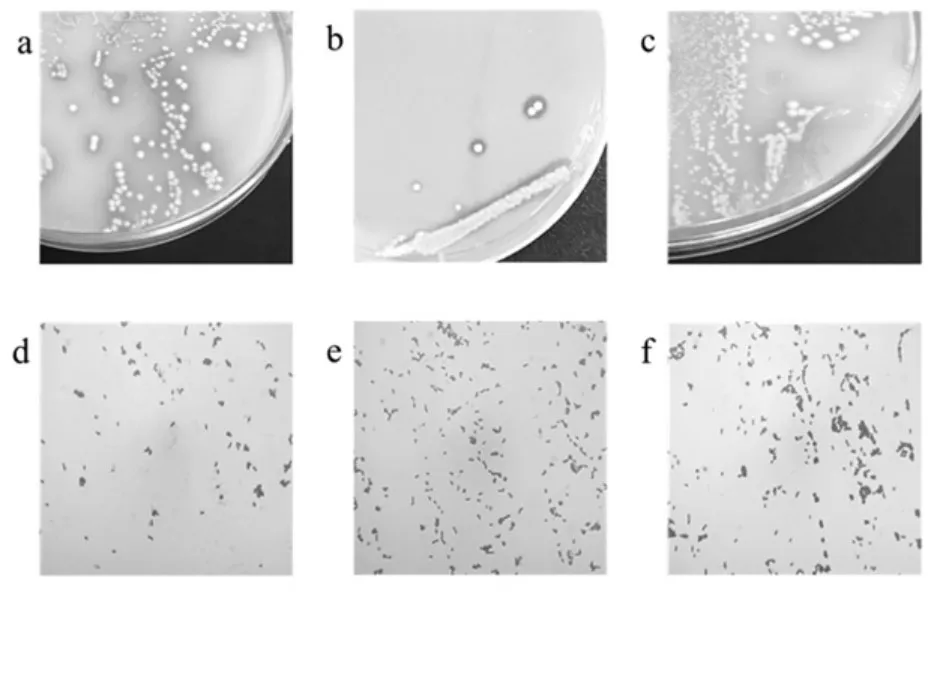
图2 乳酸菌的菌落形态和细胞形态图Fig.2 The colony morphology and cell morphology of lactic acid bacteria
图a 和b 中菌落为圆形,边缘整齐,菌落中心隆起,菌落为白色,不透明,菌落周围有明显透明圈,说明菌落周围的碳酸钙被分解;图c 中菌落呈白色,不透明,边缘整齐,较为扁平;图d、e 和f 中菌体均为短杆状,菌体颜色为紫色,说明其均为革兰氏阳性杆菌。
2.3 乳酸菌鉴定结果
以提取的纯化菌株基因组DNA 为模板,扩增产物琼脂糖凝胶电泳图如图3 所示。

图3 乳酸菌PCR 产物电泳图Fig.3 PCR products electrophoretogram of inter-species primers of lactic acid bacteria
16S rDNA 扩增产物在 1 000 bp~1 500 bp 之间,产物的电泳条带单一且清晰,满足测序要求。
经过MRS 碳酸钙平板划线分离,共得到50 株疑似乳酸菌菌株。将50 株菌株的测序结果与GenBank中已知序列进行同源性比对,确定测序菌株的种属信息,结果汇总于表1。

表1 乳酸菌纯化菌株16S rDNA 鉴定结果Table 1 Results of lactic acid bacteria identification by 16S rRNA gene sequence analysis
50 株疑似乳酸菌菌株均为乳杆菌属(Lactobacillus),其中 25 株为布氏乳杆菌(Lactobacillus buchneri);11 株植物乳杆菌(Lactobacillus plantarum);10 株干酪乳杆菌(Lactobacillus casei);3 株短乳杆菌(Lactobacillus breris);1 株戊糖乳杆菌(Lactobacillus pentosus)。本次分离鉴定得到的菌种在传统发酵食品中均有过相关报道,如姜雪晶等利用布氏乳杆菌通过混合发酵,可有效改善了酸菜成品品质[26]。植物乳杆菌与人类的生活息息相关,常用于奶油、肉类及许多蔬菜发酵制品中,其能够通过消化道进入肠道并定植从而发挥有益作用[27]。干酪乳杆菌能够抑制和杀死食品中的许多腐败菌和致病菌,并具有降胆固醇、抗肿瘤和提高人体抵抗力等益生功能[28]。由此可见,分离得到的菌种通过进一步的筛选试验可作为发酵剂应用于发酵食品。
2.4 乳酸菌初筛
将上述50 株乳酸菌16S rDNA 序列与高通量测序得到的OTU 代表序列进行BLAST 比对。筛选与相对丰度排名前十的聚类单元代表序列匹配度为100%的菌株进行后续试验,筛选结果见表2。

表2 乳酸菌初筛结果Table 2 Results of lactic acid bacteria preliminary screening
共筛选出8 株乳酸菌,其菌株编号分别为:TUSTL4、TUST-L26、TUST-L27、TUST-L36、TUST-L51、TUSTL123、TUST-L129 和 TUST-L138。这 8 株乳酸菌将作为后续乳酸菌复筛试验的试验菌株。
2.5 乳酸菌生长曲线
为了直观反应乳酸菌纯化菌株在培养基中的生长情况,对8 株乳酸菌进行了生长曲线测定。图4 展示了8 株乳酸菌在MRS 肉汤中培养18 h 内OD600变化情况。

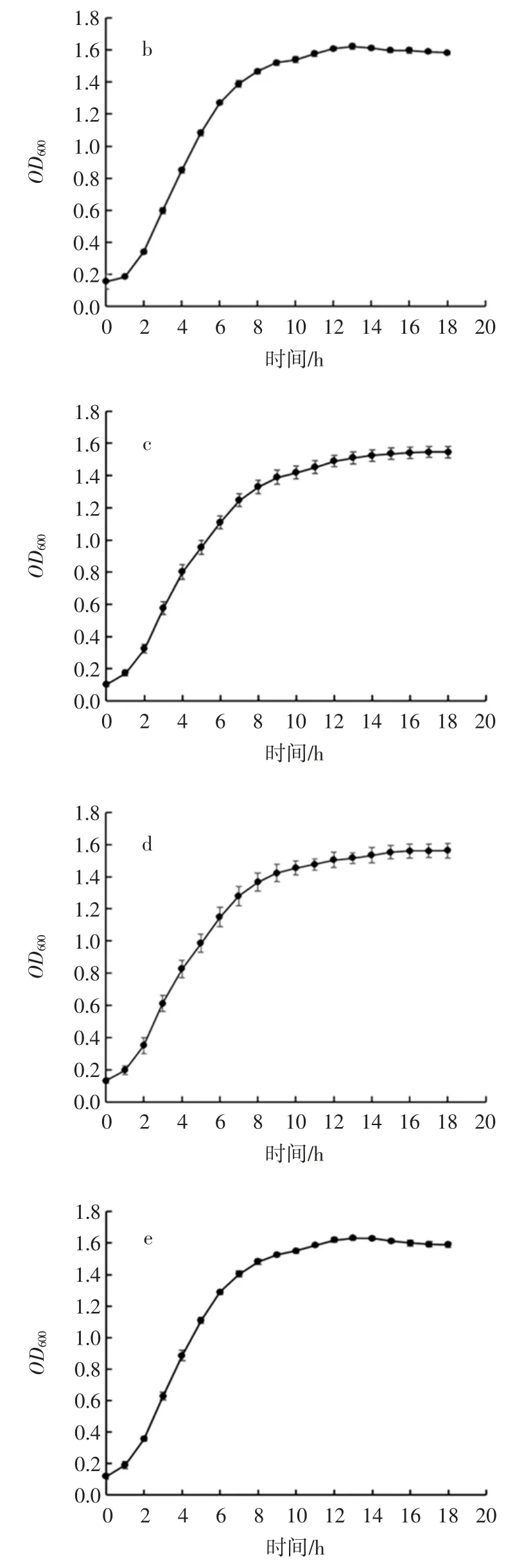

图4 乳酸菌生长曲线Fig.4 The growth curve of lactic acid bacteria
从图4 中可以看出,8 株乳酸菌均都在1 h 左右进入对数期,在8 h~10 h 时进入稳定期,稳定期的OD600值均在 1.4~1.6 之间。
2.6 乳酸菌复筛
2.6.1 乳酸菌产酸能力
乳酸菌发酵产生的有机酸能够改善产品口感和风味,并能有效抑制耐酸性较差的微生物生长[29],预防发酵过程中杂菌污染。因此,对8 株乳酸菌产酸能力进行测定,结果汇总于表3。
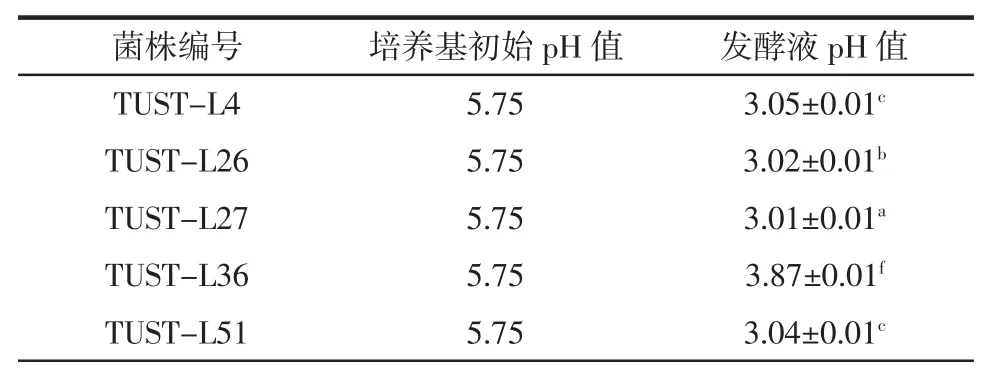
表3 乳酸菌产酸能力Table 3 Acid production quantity of lactic acid bacteria
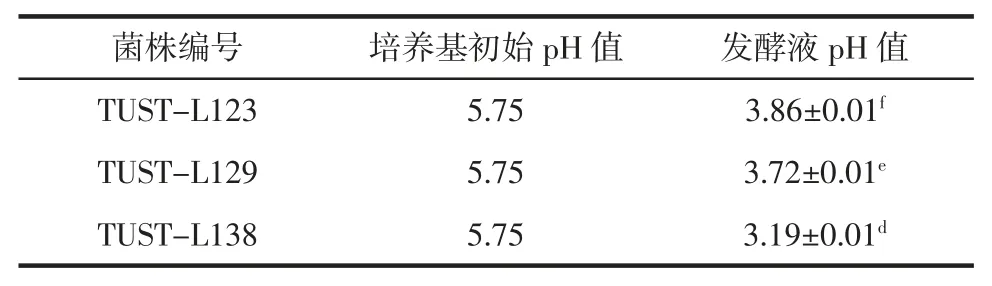
续表3 乳酸菌产酸能力Continue table 3 Acid production quantity of lactic acid bacteria
由表3 可见,TUST-L27 的产酸能力最强,TUSTL26、TUST-L4 和TUST-L51 次之,其余菌株的产酸能力较弱,发酵液pH 值均在3.00~4.00 之间。
2.6.2 乳酸菌胃酸及胆汁的耐受性
在益生菌开发和使用过程中,对其耐胃酸和耐胆盐能力的筛选具有重要意义,是益生菌能否产生益生作用的前提[30]。为此对8 株乳酸菌进行了人工胃液及人工胆汁耐受试验,试验结果见表4。

表4 乳酸菌耐受人工胃液和胆汁的能力Table 4 Assessment of viability of lactic acid bacteria after exposure to simulating gastric juice and bile salts
TUST-L51、TUST-L4、TUST-L26 和 TUST-L274株乳酸菌对人工胃液具有一定耐受性,在人工胃液中孵育1 h 后,其存活率分别为0.10%、2.48%、0.65%、2.71%,其中TUST-L4 和TUST-L27 的存活率相对较高,略高于范颖等报道的植物乳杆菌TD109 的耐人工胃液能力[31];其余4 株乳酸菌的存活率均小于0.01%。本研究中,不同乳酸菌在人工胃液中存活率差异较大,与Argyri 等[32]的研究结果相似。8 株乳酸菌在人工胆汁中孵育后,存活率均小于0.01%,说明其对人工胆汁中的耐受性较低,据Stuart 等[33]研究发现,乳酸菌的耐胆汁能力可通过驯化提高,在后续应用过程中可通过菌株驯化增强其耐胆汁能力。
2.7 乳酸菌发酵蓝莓果汁的活细胞计数
考察乳酸菌在蓝莓果汁中的生长能力。将8 株乳酸菌接入蓝莓果汁中进行发酵,测定72 h 时各菌株的活细胞数量,其计数结果见表5。

表5 乳酸菌发酵蓝莓果汁的活细胞计数Table 5 Total lactic acid bacteria enumeration of fermented blueberry juice
发酵72 h 时,活菌数高于109CFU/mL 的菌株有TUST-L27、TUST-L4、TUST-L129 和 TUST-L138,其中,菌株 TUST-L27 最高;其余 4 株菌株(TUST-L123、TUST-L26、TUST-L36 和 TUST-L51) 的活菌数均低于109CFU/mL。
3 结论
本研究通过高通量测序技术对传统蓝莓发酵饮料样品进行分析,发现乳杆菌属(Lactobacillus)为主要发酵菌属。进一步利用微生物方法对传统发酵蓝莓饮料中的乳酸菌进行分离,共得到50 株乳酸菌。利用分子生物学手段对纯化菌株进行鉴定及初步筛选,有8株与传统发酵蓝莓饮料中相对丰度最高的乳酸菌聚类单元代表序列完全匹配。通过测定菌株生长曲线发现,8 株乳酸菌在MRS 培养基中均能在1 h 内进入对数期。TUST-L4、TUST-L26、TUST-L27 和 TUST-L514株乳酸菌具有较好的产酸能力和耐受性能力。TUSTL4、TUST-L27、TUST-L129 和 TUST-L1384 株乳酸菌在蓝莓果汁发酵过程中具有较强的生长能力。综上所述,注释信息为植物乳杆菌的TUST-L4 和TUST-L27更适合应用于发酵蓝莓果汁。

