姜黄素通过NF- κB/miR33a通路对ox- LDL刺激THP- 1巨噬细胞分泌的影响及机制
钟 毅,谢发江,冯 健,查克岚,郑舒展,李家富,范忠才
1西南医科大学附属医院心血管内科,泸州646000;2达州市中心医院心血管内科,达州 635000
动脉粥样硬化(atherosclerosis,AS)是血管系统的一种炎症性疾病,在动脉壁内巨噬细胞的聚集有助于炎症性AS斑块的进展[1]。巨噬细胞膜表面的凝集素样氧化低密度脂蛋白受体- 1(lectin- like oxidized low- density lipoprotein receptor- 1,LOX- 1)与ox- LDL结合并活化促发巨噬细胞产生大量的活性氧(reactive oxygen species,ROS)及促炎因子,包括IL- 6、TNF- α、MCP- 1等,这一系列过程形成恶性循环,加速AS的进展,以阻断炎症反应为靶点的治疗显示了良好抗AS效果[2]。
姜黄素是一种具有抗心律失常、抗动脉粥样硬化、抗炎、抗纤维化、抗病毒、抗肿瘤等多种药效的多酚类化合物,被广泛用于体内外研究[3- 7]。研究显示姜黄素通过调控靶向激活蛋白- 1(activator protein 1,AP- 1)和 NF- κB抑制单核细胞和肺泡巨噬细胞的细胞因子的表达[8,9]。在活化的巨噬细胞中姜黄素能够下调一氧化氮(nitric oxide,NO),环氧合酶- 2(cyclooxygenase- 2,COX- 2)以及多种白介素家族分子(IL- 1,IL- 2,IL- 5,IL- 8,IL- 12,IL- 18)等[10- 14]。姜黄素能够阻断炎症诱导下人肺泡巨噬细胞TNF- α、IL- 6、IL- 8、MCP- 1等多种炎症因子表达[9]。尽管越来越多的证据显示姜黄素可能通过阻断IκBα激酶而减少NF- κB转录进而发挥抗炎效应[3,4,6,9],但是姜黄素并非NF- κB特异性阻滞剂,其抗炎效应主要通过影响多条途径实现,目前尚未完全清楚。本研究以THP- 1巨噬细胞作为实验对象,于细胞水平探讨姜黄素影响ox- LDL刺激的THP- 1巨噬细胞IL- 6、TNF- α的分泌及其可能的机制。
1 材料和方法
1.1 实验材料、药品与试剂
1.1.1 实验细胞株
THP- 1细胞来源于美国菌种保藏中心(American Type Culture Collection,ATCC)
1.1.2 主要实验试剂
姜黄素、PDTC、佛波酯(Phorbol- 12- myristate- 13- acetate,PMA)购自美国Sigma 公司;RPMI- 1640 培养基购自美国 Gibco公司;人ox- LDL购自广州奕源生物科技有限公司;细胞计数试剂盒CCK- 8购自日本DOJINDO 公司;BCA蛋白浓度测试试剂盒购自武汉阿斯本公司;抗GAPDH抗体购自英国 Abcam 公司产品;Trizol试剂盒购自美国 Invitrogen 公司;实时计量PCR逆转录试剂盒购自日本TOYOBO公司;兔源抗NF- κB p65、IκBα、p- IκBα抗体购自美国CST公司;miR33a inhibitor和control sequence购自上海吉玛公司;IL- 6、TNF- α ELISA试剂盒购自武汉伊莱瑞特生物科技有限公司。
1.1.3 实验仪器
Cytomat 10 C细胞培养箱、TSE400D 超低温冰箱、Multiskan GO全波长酶标仪、Multifuge X3台式超速离心机、Micro CL 冷冻离心机、9700PCR仪均为美国 Thermo Fisher 公司产品;HH- 4 型恒温水浴锅、江南仪器厂均为苏州净化公司产品;倒置生物显微镜、TS100- F 倒置显微镜均为日本 Nikon 公司产品;DYCP- 36 型电泳仪为北京六一仪器厂公司产品;微量移液器为法国Gilson公司。
1.2 实验方法
1.2.1 THP- 1细胞的培养及THP- 1巨噬细胞的诱导分化
以10%FBS、1%青、链霉素的RPIM- 1640培养液,37 ℃,5% CO2培养箱中培养。取对数生长期细胞,以浓度为160 nmol/L PMA的完全培养基孵育48 h,诱导其分化为THP- 1巨噬细胞。
1.2.2 姜黄素的配制及毒性检测
取适量姜黄素粉末融于DMSO溶剂中,配制成浓度为50 mmol/L保存液,- 20 ℃条件下保存,使用时用培养基稀释配制成所需浓度,并且保证DMSO最终在培养基中浓度不超过0.1%。
调整细胞浓度为1×105/mL的悬液,按每孔10 000个细胞接种于96孔板,置于上述培养箱中48 h以贴壁。加入含不同终浓度的姜黄素(0、5、10、20、40、80 μmol/L)RPIM- 1640培养液处理24 h,每孔加入10 μL CCK- 8溶液培养4 h,按照CCK- 8试剂盒说明书步骤,检测细胞活性,筛选出下一步实验所需姜黄素合适的浓度以排除其毒性作用而导致实验结果的误差。
1.2.3 姜黄素对ox- LDL刺激的THP- 1巨噬细胞miR33a 的表达及IL- 6、TNF- α的分泌影响
将前述含PMA细胞培养基更换为终浓度50 μg/mL的ox- LDL无血清RPMI- 1640培养液,37 ℃,5% CO2培养48 h后,再进行相应的干预。
实验分组:空白对照组、ox- LDL组、ox- LDL+姜黄素组,加入相应处理后继续在上述条件中培养48 h[15]。其中姜黄素浓度以1.2.2检测结果为准。
1.2.4 脂质体转染及检测
将提前设计的miR33a inhibitor以脂质体转染法将其转染入THP- 1巨噬细胞,阻断miR33a的表达,另外使用control sequence与之对照,排除非序列特异性对实验的干扰。实验分组:空白对照组、ox- LDL组;ox- LDL+miR33a inhibitor组、ox- LDL+control sequence组;按照LipofectaminTM2000转染试剂盒说明书进行转染操作。
1.2.5 姜黄素介导miR33a的表达影响ox- LDL刺激的THP- 1巨噬细胞IL- 6、TNF- α的分泌
实验分组:空白对照组、ox- LDL组、ox- LDL+姜黄素组、ox- LDL+control sequence组、ox- LDL+control sequence+姜黄素组、ox- LDL+miR33a inhibitor组、ox- LDL+miR33a inhibitor+姜黄素组。
1.2.6 姜黄素对ox- LDL刺激的THP- 1巨噬细胞NF- κB/miR33a信号通路的影响
采用50 μm·mL- 1NF- κB信号通路阻断剂PDTC预处理细胞,阻断NF- κB的活化。实验分组:空白对照组、ox- LDL组、ox- LDL+姜黄素组、ox- LDL+姜黄素组+PDTC组。
1.2.7 姜黄素介导NF- κB/miR33a信号通路影响ox- LDL刺激的THP- 1巨噬细胞IL- 6、TNF- α的分泌
实验分组:空白对照组、ox- LDL组、ox- LDL+姜黄素组、ox- LDL+miR33a inhibitor组、ox- LDL+PDTC组、ox- LDL+miR33a inhibitor+姜黄素组、ox- LDL+姜黄素组+PDTC组、ox- LDL+control sequence组。
1.2.8 RT- qPCR检测miR33a的表达
按照Trizol试剂盒说明书提取细胞总RNA,按逆转录试剂盒操作获取cDNA;使用 RT- qPCR 试剂盒测定mRNA 量。miR- 33a- 5p引物序列:上游5`- GGTGCATTGTAGTTGCATTGC- 3′,下游5′- GCGAC GAGCAAAAAGCTTGT- 3′。内参照 U6引物序列上游5′- AACGCTTCACGAATTTGCGT- 3′,下游5′- AACGCTTCAC- GAATTTGCGT- 3′。反应条件:预变性 95 ℃ 1 min,变性 95 ℃ 15 s,退火 58 ℃ 20 s,延展 72 ℃ 20 s,共 40 个循环。用 ΔΔCt 来计算基因的表达水平,具体公式如下:ΔCt= 目的基因 Ct 值-GAPDH 基因 Ct 值;ΔΔCt= 实验组 ΔCt-对照组 ΔCt;实验组基因相对表达量 =2- ΔΔCt。Stem- loop技术提前处理样本miRNA,此后再按照传统RT- qPCR检测。
1.2.9 Western blot检测NF- κB p65、IκBα、p- IκBα 的表达
收集细胞,加入 RIPA 裂解液提取总蛋白,按BCA蛋白浓度定量试剂盒说明测定样品蛋白浓度。SDS- PAGE 凝胶电泳分离蛋白,每孔上样量 40 μg,按浓缩胶 80 V、分离胶 120 V 进行恒压电泳,切去相应胶带,300 mA恒流转印至 PVDF 膜;置于 5%脱脂牛奶室温封闭1 h,除去封闭液后加入抗NF- κB p65(1∶2 000)、IκBα(1∶1 000)、p- IκBα (1∶1 000)、GAPDH(1∶10 000)一抗4 ℃过夜,TBST 洗膜10 min(3次;加入 HRP 标记的山羊抗鼠抗体(1∶10 000)室温孵育1.5 h,TBST洗膜 10 min(3次,化学发光法定影显色,用 Image Lab 软件进行条带分析。
1.2.10 ELISA测定IL- 6、TNF- α的浓度
收集细胞悬液,以2 000 rpm离心20 min,收集的上清液- 20 ℃保存备用。按ELISA试剂盒说明检测IL- 6、TNF- α的浓度。
1.3 统计学处理

2 结果
2.1 姜黄素毒性检测
与空白对照组相比,姜黄素的浓度在5- 40 μmol/L时对细胞活性影响差异无统计学显著性(P>0.05),而当姜黄素浓度达80 μmol/L时,THP- 1巨噬细胞活性下降(P<0.05)(见图1)。根据实验结果我们选择以姜黄素浓度20 μmol/L作为下一步姜黄素干预实验的基础。

图1 姜黄素对细胞活性的影响Fig.1 Effect of curcumin on cell 注:与对照组比较,aP<0.05。Note:aP<0.05 vs control group.
2.2 姜黄素对ox- LDL刺激的THP- 1巨噬细胞miR33a的表达及IL- 6、TNF- α的分泌影响
与空白对照组相比,ox- LDL组miR33a的表达及IL- 6、TNF- α的浓度增加(P<0.05);与ox- LDL组相比,ox- LDL+姜黄素组miR33a的表达及IL- 6、TNF- α的浓度减少(P<0.05)(见图2)。
2.3 姜黄素通过介导miR33a的表达影响ox- LDL刺激的THP- 1巨噬细胞IL- 6、TNF- α的分泌
2.3.1 miR33a inhibitor和control sequence的脂质体转染检测
与空白对照组相比,ox- LDL组miR33a的表达增加(P<0.05);与ox- LDL组相比,ox- LDL+miR33a inhibitor组miR33a的表达下降(P<0.05),而ox- LDL+control sequence组miR33a的表达与ox- LDL组差异无统计学显著性(P>0.05);与ox- LDL+miR33a inhibitor组相比,ox- LDL+control sequence组miR33a的表达增加(P<0.05)(见图3)。通过脂质体转染的方式,miR33a inhibitor能够有效抑制ox- LDL刺激的THP- 1巨噬细胞miR33a的表达,为下一步探索姜黄素介导miR33a的表达影响ox- LDL刺激的THP- 1巨噬细胞IL- 6、TNF- α的分泌提供了实验基础。

图2 姜黄素对miR33a的表达及IL- 6、TNF- α分泌的影响Fig.2 Effect of curcumin on expression of miR33a and secretion of IL- 6,TNF- 注:与对照组相比,aP<0.05;与ox- LDL组相比,bP<0.05。Note:aP<0.05 vs control group;bP<0.05 vs ox- LDL group.

图3 脂质体转染检测Fig.3 detection of Liposome 注:与对照组相比,aP<0.05;与ox- LDL组相比,bP<0.05;与ox- LDL+miR33a inhibitor组相比,cP<0.05。Note:aP<0.05 vs control group;bP<0.05 vs ox- LDL group;cP<0.05 vs ox- LDL+miR33a inhibitor group.
2.3.2 姜黄素通过介导miR33a的表达下调IL- 6、TNF- α的分泌
与空白对照组相比,ox- LDL组IL- 6、TNF- α的浓度增加(P<0.05);与ox- LDL组相比,ox- LDL+姜黄素组、ox- LDL+miR33a inhibitor组、ox- LDL+姜黄素+miR33a inhibitor、ox- LDL+control sequence+姜黄素组IL- 6、TNF- α的浓度减少(P<0.05),而ox- LDL+control sequence组IL- 6、TNF- α的浓度差异无统计学显著性(P>0.05);与ox- LDL+姜黄素组相比,ox- LDL+姜黄素+miR33a inhibitor组IL- 6、TNF- α的浓度进一步减少(P<0.05),而ox- LDL+姜黄素+control sequence组IL- 6、TNF- α的浓度差异无统计学显著性(P>0.05)(见图4)。提示姜黄素通过介导miR33a的表达下调ox- LDL刺激的THP- 1巨噬细胞IL- 6、TNF- α的分泌,为进一步探索其上游信号分子奠定实验基础。
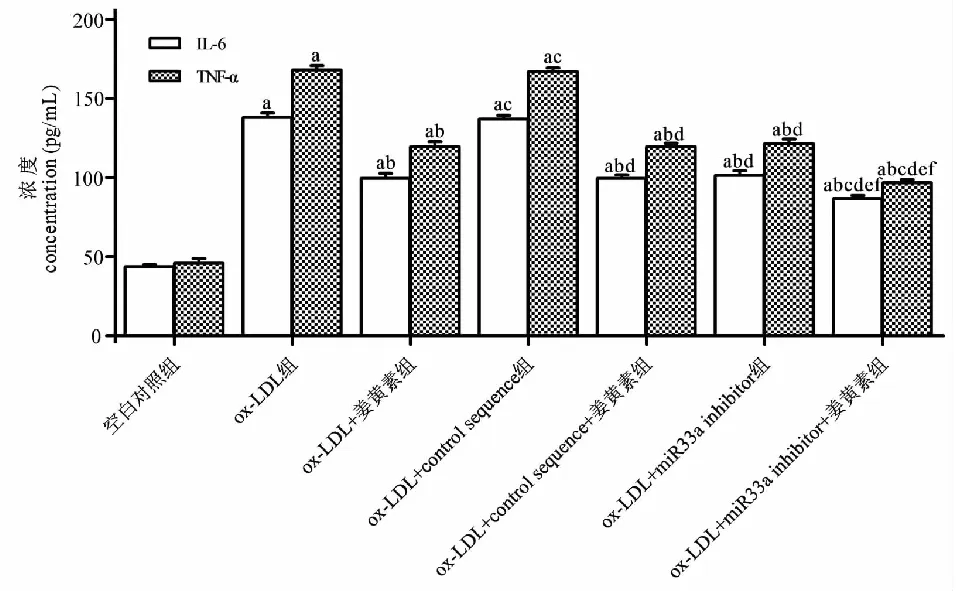
图4 姜黄素通过介导miR33a的表达降低IL- 6、TNF- α的分泌Fig.4 Curcumin reduces the secretion of IL- 6 and TNF- 1 by mediating the expression of 注:与对照组相比,aP<0.05;与ox- LDL组相比,bP<0.05;与ox- LDL+姜黄素组相比,cP<0.05;与ox- LDL+control sequence组相比,dP<0.05;与ox- LDL+control sequence+ 姜黄素组相比,eP<0.05;与ox- LDL+miR33a inhibitor组相比,fP<0.05。Note:aP<0.05 vs control group;bP<0.05 vs ox- LDL group;cP<0.05 vs ox- LDL+ curcumin group;dP<0.05 vs ox- LDL+control sequence group ;eP<0.05 vs ox- LDL+control sequence+ curcumin group;fP<0.05 vs ox- LDL+miR33a inhibitor group
2.4 姜黄素介导NF- κB/miR33a信号通路影响ox- LDL刺激的THP- 1巨噬细胞IL- 6、TNF- α的分泌
2.4.1 姜黄素抑制NF- κB/miR33a信号通路
与空白对照组相比,ox- LDL组miR33a、NF- κB p65、p- IκBα的表达及p- IκBα/IκBα的比值增加(P<0.05),IκBα的表达减少(P<0.05);与ox- LDL组相比,ox- LDL+姜黄素组、ox- LDL+PDTC组miR33a、NF- κB p65、p- IκBα的表达及p- IκBα/IκBα的比值减少(P<0.05),IκBα的表达增加(P<0.05)(见图5)。
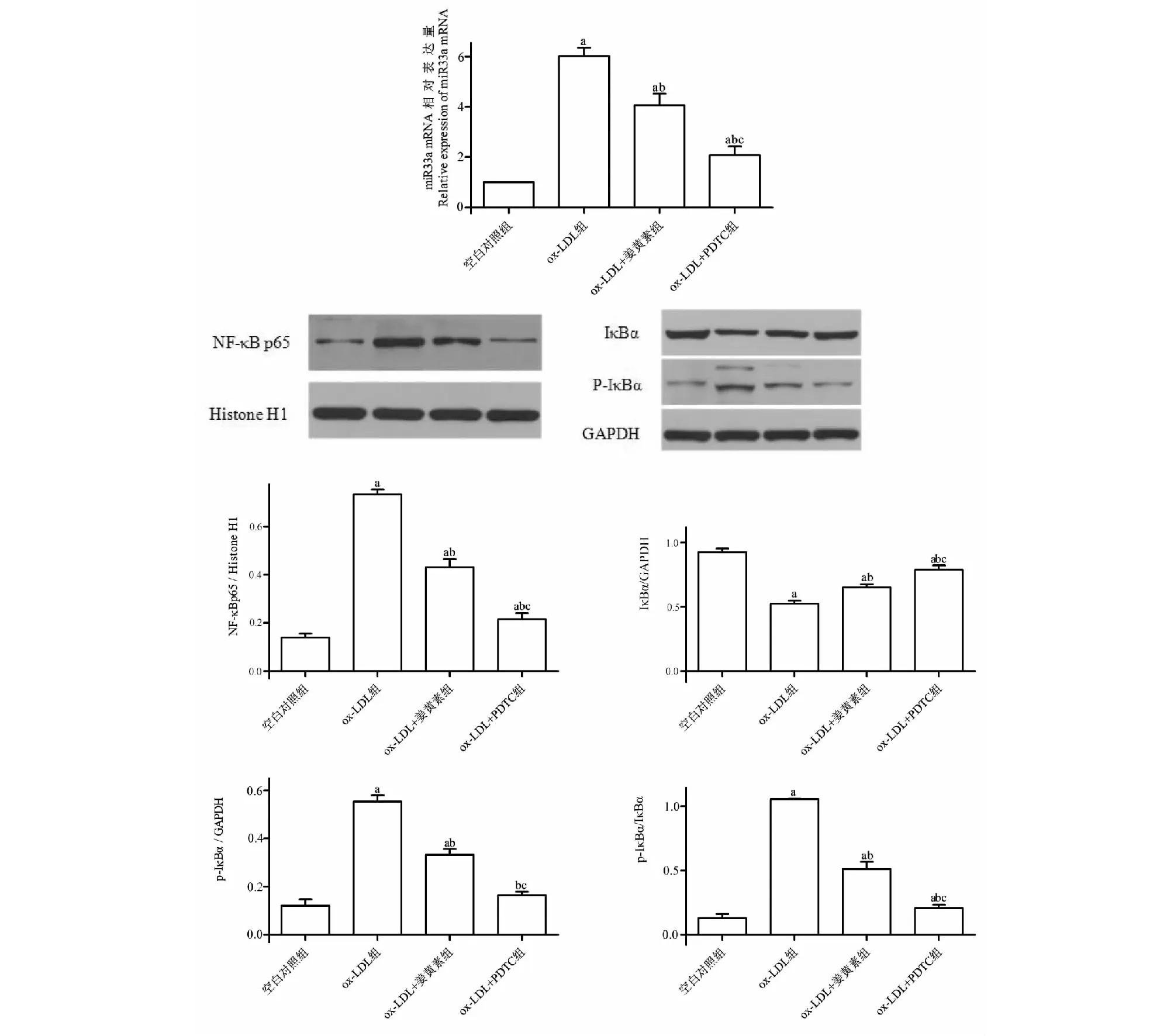
图5 姜黄素对NF- κB/miR33a信号通路的影响Fig.5 Effect of curcumin on NF- κ B/miR33a signaling 注:与对照组相比,aP<0.05;与ox- LDL组相比,bP<0.05;与ox- LDL+姜黄素组相比,cP<0.05。Note:aP<0.05 vs control group;bP<0.05 vs ox- LDL group;cP<0.05 vs ox- LDL+curcumin group.
2.4.2 姜黄素通过调控NF- κB/miR33a信号通路下调IL- 6、TNF- α的分泌
与空白对照组相比,ox- LDL组IL- 6、TNF- α的浓度增加(P<0.05);与ox- LDL组相比,ox- LDL+姜黄素组、ox- LDL+miR33a inhibitor组、ox- LDL+PDTC组IL- 6、TNF- α的浓度减少(P<0.05),而ox- LDL+control sequence组IL- 6、TNF- α的浓度差异无统计学显著性(P>0.05);与ox- LDL+姜黄素组相比或ox- LDL+PDTC组相比,ox- LDL+姜黄素+ PDTC组IL- 6、TNF- α的浓度进一步减少(P<0.05);与ox- LDL+姜黄素组或ox- LDL+miR33a inhibitor组相比,ox- LDL+姜黄素+miR33a inhibitor组IL- 6、TNF- α的浓度进一步减少(P<0.05)(见图6)。
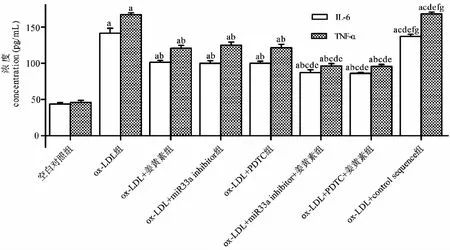
图6 姜黄素通过抑制NF- κB/miR33a信号通路下调IL- 6、TNF- α的分泌Fig.6 Curcumin reduces the secretion of IL- 6,TNF- 1 by inhibiting NF- κB/miR33a signaling 注:与对照组相比,aP<0.05;与ox- LDL组相比,bP<0.05;与ox- LDL+姜黄素组相比,cP<0.05;与ox- LDL+miR33a inhibitor组相比,dP<0.05;与ox- LDL+PDTC组相比,eP<0.05;与ox- LDL+miR33a inhibitor+姜黄素组相比,fP<0.05;与ox- LDL+PDTC+姜黄素组相比,gP<0.05。Note:aP<0.05 vs control group;bP<0.05 vs ox- LDL group;cP<0.05 vs ox- LDL+ curcumin group;dP<0.05 vs ox- LDL+miR33a inhibitor group;eP<0.05 vs ox- LDL+PDTC group;fP<0.05 vs ox- LDL+miR33a inhibitor+curcumin group;gP<0.05 vs ox- LDL+PDTC+curcumin group.
3 结论
姜黄素是存在于姜黄中的具有广泛药理学作用的天然多酚类活性物质。我们前期研究发现,姜黄素能通过下调p38MAPK及NF- κB的表达抑制ox- LDL诱导的血管平滑肌细胞(vascular smooth muscle cells,VSCMs)促炎因子的过表达[3,4]。动物实验也证实[16],每日口服20 mg/kg的姜黄素能延缓ApoE- /-小鼠AS的进程,减轻全身炎症反应。这些结论都说明姜黄素具有抗炎及抗AS的作用,然而其具体的机制尚未完全阐明。本研究通过体外ox- LDL刺激THP- 1巨噬细胞检测IL- 6、TNF- α的分泌及NF- κB/miR33a信号通路相关信号分子探讨姜黄素抗炎及抗AS的分子机制。
为排除姜黄素对THP- 1巨噬细胞的毒性作用,影响实验结果的可靠性,本研究采用不同终浓度的姜黄素与THP- 1巨噬细胞共培养24 h,结果显示,不同浓度的姜黄素对细胞的活性影响不完全相同。较低浓度(0~40 μmol/L)的姜黄素对细胞活性无影响,当浓度达到80 μmol/L时,细胞活性明显下降。本研究中采用20 μmol/L的姜黄素进行干预,该浓度在安全有效范围内,避免了其对THP- 1巨噬细胞的毒性作用。
miRNA inhibitor是经人工克隆生产的miRNA特异性阻断剂,能高效、稳定的结合miRNA,抑制内源性miRNA的活性。本研究中选用miR33a inhibitor转染THP- 1巨噬细胞,与miR33a结合并阻断其表达,并将miR33a control sequence以相同的方转染入细胞,与miR33a inhibitor形成对照,排除非序列特异性的干扰。结果显示,ox- LDL显著增加了THP- 1巨噬细胞miR33a的表达,而miR33a inhibitor减轻这种现象,提示miR33a inhibitor能有效抑制miR33a的表达,与之相似,姜黄素也能显著抑制miR33a的表达,这为我们下一步研究奠定了基础。
在本研究中,姜黄素或miR33a inhibitor能显著下调IL- 6、TNF- α的分泌,当姜黄素和miR33a inhibitor合用时较二者单独使用更能显著下调IL- 6、TNF- α的分泌,相反,当姜黄素和control sequence合用与只使用姜黄素的效果无显著差异,因此姜黄素通过抑制miR33a的表达参与调控IL- 6、TNF- α的分泌,减轻炎症反应,miR33a扮演着促进炎症的角色。本研究结果与Rayner等[17]研究一致,在给予抗miR33a治疗的小鼠中其体内抗炎因子增多,而促炎因子减少,并且循环中炎性巨噬细胞的浓度也明显降低,说明miR33a可能是一种促炎miRNA。有趣的是,Ho等[18]发现miR33a激活剂miR33 mimic能显著降低NF- κB的共激活剂受体相互作用蛋白140(Receptor- interacting protein 140,RIP140)mRNA和蛋白含量,从而减少巨噬细胞TNF- α和IL- 1β的产生,说明巨噬细胞中miR33a又有可能是一种抗炎miRNA,与本研究结果相反。综上所述,miR33a参与调节巨噬细胞炎症反应,miR33a可能存在多种不同的调节机制并且其作用效果可能与巨噬细胞所处的状态相关,仍需进一步研究。
NF- κB与IκB在细胞质中结合成复合体,一旦IκBα被激酶依赖性磷酸化而泛化和降解后,游离NF- κB转位进入细胞核,结合在一些促炎因子的DNA序列上,促进其表达。姜黄素能抑制多种细胞由ox- LDL诱导的炎症反应,抑制活性可能与介导ox- LDL刺激的IκBα磷酸化和降解,P65的磷酸化、核转位以及NF- κB靶向基因的转录有关[19]。本研究中,观察到ox- LDL能显著增加胞核内的NF- κB p65和胞浆内p- IκBα的含量,同时降低胞浆内IκBα的含量,p- IκBα/IκBα比值增大,说明ox- LDL使IκBα降解以及p65核转位,而姜黄素能逆转这一现象,表明姜黄素能抑制ox- LDL刺激的IκB磷酸化,阻断p65的核转位,有效的抑制NF- κB信号通路被激活。
已有大量的研究证实NF- κB与炎症相关,而本研究也证实了miR33a参与调节炎症反应。Ho等[18]发现miR33a能识别NF- κB的共激活剂RIP140的3’UTR而影响炎症因子表达,另外,Kim等[20]发现SIRT6是miR3a的靶向基因,而SIRT6又能与NF- κB相互作用并影响NF- κB的靶向基因。因此我们推测miR33a与NF- κB在炎症反应的调控方面可能存在相互关系。在本研究中,PDTC和miR33a inhibitor均能显著下调IL- 6、TNF- α的分泌,并且姜黄素与PDTC或miR33a inhibitor合用时较单用下调IL- 6、TNF- α的分泌更为明显,表明NF- κB/miR33a信号通路促进ox- LDL刺激的THP- 1巨噬细胞IL- 6、TNF- α的分泌,而姜黄素通过抑制该信号通路下调IL- 6、TNF- α的分泌。
综上所述,姜黄素下调ox- LDL刺激的THP- 1巨噬细胞IL- 6、TNF- α的分泌,其机制可能与抑制NF- κB/miR33a信号通路有关。

