高迁移率族蛋白B1在诱导肝癌细胞HepG2 发生上皮间质转换中的作用*
陈毅华, 程芳, 何选秋, 周元平, 彭雁忠, 李雅琴, 戴璐, 齐明华△
1北京大学深圳医院感染性疾病科(广东深圳 518035); 2南方医科大学南方医院感染性疾病科(广东广州 510515)
高迁移率族蛋白B1(high mobility group box 1, HMGB1)作为一种损伤相关模式蛋白,于1973年被发现,属高迁移率族成员。高迁移率蛋白家族还包括高迁移率族蛋白B2(high mobility group box 2, HMGB2)和高迁移率族蛋白B3(high mobility group box 3, HMGB3),其特点为分子量低,在凝胶电泳中迁移率高。肾素-血管紧张素系统(renin angiotensin system,RAS)在维持内环境的稳定性,调节人体的血压、水分、电解质等中起着非常重要的作用,是人体中一个关键的神经-体液调节系统。RAS主要包括血管紧张素原酶、血管紧张素原、血管紧张素Ⅰ(AngiotensinⅠ,AngⅠ)、血管紧张素转换酶、血管紧张素Ⅱ(Angiotensin Ⅱ,AngⅡ)和血管紧张素受体。目前研究表明,AngⅡ和HMGB1都能在促进肿瘤细胞的迁移、侵袭作用上促进肝癌的发生发展和远处转移,但AngⅡ与HMGB1的作用关系目前尚不明确。因此,我们于2017年6月至2018年6月通过调控HMGB1的表达,观察AngⅡ诱导HepG2发生上皮间质转化(epithelial mesenchymal transition,EMT)的变化。
1 材料与方法
1.1 细胞培养及药物处理 本研究所用肝癌细胞HepG2由北京大学深圳医院中心实验室保存。HepG2细胞的培养方法参照以前的研究[1],用DMEM 在37℃和5% CO2的培养箱中培养,[Gibco DMEM培养基(货号:C11875500BT)加入10%热灭活Gibco 胎牛血清(货号:10099-141),100 U/mL青霉素、100 μg/mL链霉素]。台盼蓝染色法评估细胞活性。
用胰酶消化细胞,接种至培养瓶中,每瓶约106个细胞,利用DMEM完全培养基稀释AngⅡ至终浓度为10-7nmol/L。分为表达组、SiRNA静默组和对照组,表达组和SiRNA静默组加入含有AngⅡ的培养基,对照组细胞用正常的DMEM培养基培养,37℃,5% CO2的条件下培养细胞12 h。
1.2 HepG2细胞转染并过表达HMGB1基因 从HepG2细胞中提取RNA并逆转录制备cDNA模板,扩增HMGB1基因,引物F:5′-CATGGGCAAAGGAGATCCTAAG-3′,R:5′-CTGCGCTAGAACCAACTTATTC-3′,将扩增的HMGB1基因片段克隆至pMD19-T载体。使用EcoRⅠ酶和HindⅢ酶将酶切后的pcDNA3.1载体和pMD19-HMGB1基因片段,回收酶切产物,将HMGB1基因片段克隆至真核表达载体pcDNA3.1+(Invitrogen,美国)中,构建HMGB1真核表达载体pcDNA3.1-HMGB1。EcoRⅠ和HindⅢ双酶切鉴定HMGB1真核表达载体,将构建成功的HMGB1真核表达载体送测序进一步验证,利用Lipofecamine 3000(Invitrogen, 美国)将带有人HMGB1基因的载体转染HepG2细胞,同时将pcDNA3.1转染HepG2细胞做空白对照,转染方法操作参照说明书。
1.3 HepG2细胞转染siRNA 根据Genbank中提供的人HMGB1基因序列,利用siRNA在线设计软件http://sirna.wi.mit.edu/show_oligo.cgi,设计并合成针对HMGB1基因的siRNA,序列为GGA UAU UGC UGC AUA UCG AUU UCG AUA UGC AGC AAU AUC CUU。转染HEK293细胞株,通过荧光定量PCR验证HMGB1基因表达改变。
1.4 RT-PCR检测和Western blot分析 实验步骤参照说明书,使用Trizol试剂(Invitrogen)提取总RNA,参照逆转录试剂盒(Invitrogen)说明书合成单链cDNA。SYBR Green法进行样品定量检测,2-ΔΔCt计算相对表达量。ΔCt=(目的基因Ct-内参Ct)的平均值±标准差;ΔΔCt=(待测样品中目的基因ΔCt-参照样品中目的基因ΔCt)的平均值±标准差(选择“空载”为参照进行计算);相对表达量=(2-ΔΔCt)的平均值±标准差。QPCR检测引物为:HMGB1-上游5′-GCC AAG GAA TCC AGC AGT TTG-3′,HMGB1-下游5′-CCA CCA GGA CAG GGC TAT CT-3′;内参引物β-actin-F: 5′-CATCACTGCCACCCAGAAGACT-3′,β-actin-R: 5′-GGTAGGAACACGGAAGGCCAT-3′。同时提取总蛋白后,BCA法初步测定蛋白浓度。样品蛋白在60℃溶解15 min后聚丙烯梯度电泳,转移至PVDF膜(Milipore,美国)上。杂交膜用5%脱脂奶粉室温封闭1 h,后用0.2%的TBST缓冲液室温洗涤4次。兔抗人HMGB1抗体(Santa Cruz,美国)以1∶3 000进行稀释。室温孵育约1 h左右, 显影后用冷CCD成像仪显影,使用Image J软件分析各条带灰度值,以GAPDH为内参,计算各个蛋白相对表达量。
1.5 统计学方法 采用SPSS 13.0 统计软件,行t检验,以P<0.05为差异有统计学意义。P<0.01为差异有统计学意义。
2 结果
2.1 HMGB1基因表达 转染过HMGB1表达载体和HMGB1-siRNA后,通过Wester blot检测HMGB1基因表达改变。结果显示,与对照组相比,HepG2-HMGB1-siRNA细胞中,HMGB1基因表达受到显著抑制,差异有统计学意义(图1)。
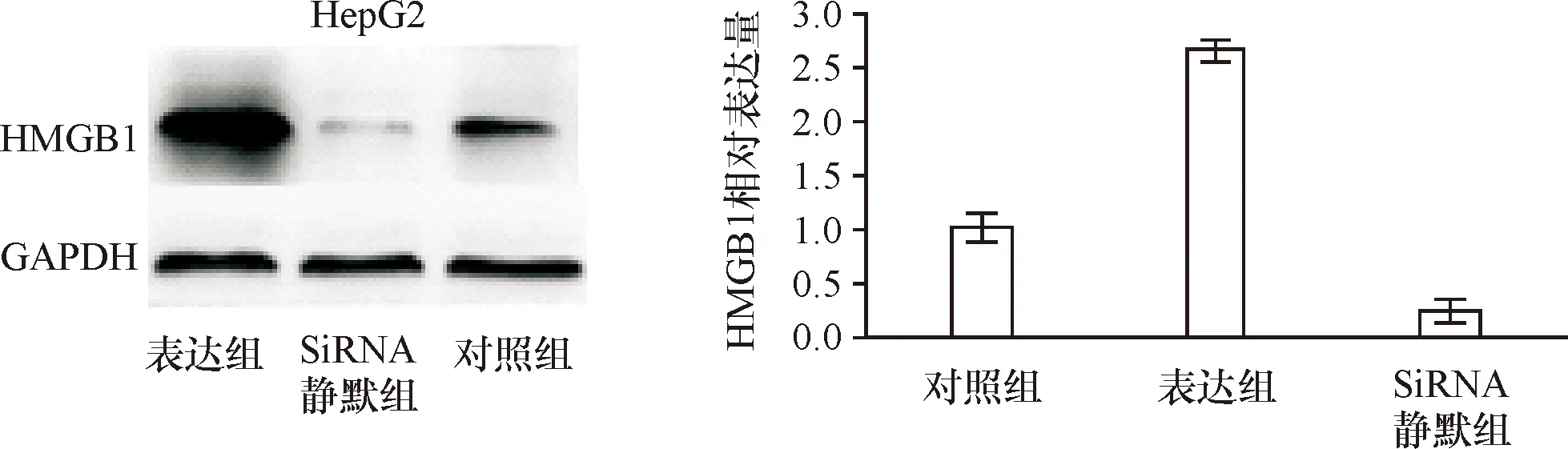
图1 HMGB1-siRNA表达HepG2细胞中的效果检测
2.2 AngⅡ诱导EMT标志蛋白在HMGB1稳定过表达及干扰的肝癌细胞中表达的改变 通过Image J软件分析条带灰度值,对蛋白条带进行半定量分析后发现,E-钙黏蛋白(E-cadherin)的Western blot 结果显示如图2,与正常HepG2细胞相比,经AngⅡ处理后,E-cadherin蛋白表达水平显著下降(P<0.05);与阴性对照相比,HMGB1高表达HepG2细胞经AngⅡ处理后,E-cadherin蛋白表达水平显著下降(P<0.001);与阴性对照相比,HMGB1干扰的HepG2细胞经AngⅡ处理后,E-cadherin蛋白表达水平差异无统计学意义(P>0.05);经AngⅡ处理的HMGB1高表达HepG2细胞与AngⅡ处理的正常HepG2细胞相比,E-cadherin蛋白表达水平显著下降(P<0.01)。
波形蛋白(Vimentin蛋白)的Western blot 结果显示如图2及表1,与正常HepG2细胞相比,经AngⅡ处理后,Vimentin蛋白表达水平显著上升(P<0.01);与阴性对照相比,HMGB1高表达HepG2细胞经AngⅡ处理后,Vimentin蛋白表达水平显著上升(P<0.001);与阴性对照相比,HMGB1干扰的HepG2细胞经AngⅡ处理后,Vimentin蛋白表达水平差异无统计学意义(P>0.05);经AngⅡ处理的HMGB1高表达HepG2细胞与AngⅡ处理的正常HepG2细胞相比,Vimentin蛋白表达水平显著上升(P<0.05)。

图2 Western Blot验证EMT相关标志蛋白在肝癌细胞中的变化

表1 肝癌细胞EMT相关标志蛋白表达
3 讨论
肝癌作为一种常见的人类恶性肿瘤,近年来其在人群中的发病率跃居恶性肿瘤的前5位。全球流行病学统计结果显示,每年约有78万新增的肝癌患者,其中一半的患者在我国[2]。邵海妍等[3]通过对1991—2011年中国15~84岁居民的肝癌死亡趋势分析发现,在这期间,我国居民肝癌病死率整体呈上升趋势,城市、农村人群肝癌病死率分别由1991年的19.63/10万、22.25/10万上升至2011年的23.61/10万、27.12/10万。目前,肝癌的病死率已经超过胃癌、结直肠癌,在所有恶性肿瘤中仅次于肺癌,排第2位[4]。
目前,原发性肝细胞癌(HCC)发生转移的机制尚不明确。HCC转移的机制相当复杂,有基础研究表明肿瘤的生物学特性在很大程度上影响着肝癌的复发和转移,与其有关的癌基因、抑癌基因、黏附分子、基质蛋白酶、细胞因子以及相应的信号转导机制[5-6]。近年来,有研究发现,ETM是肝癌细胞发生侵袭、转移的关键[1]。阐明EMT在HCC中的发生和调控机制对研发新的HCC治疗靶点具有重要的现实意义。
高迁移率族蛋白(high mobility group box,HMG)是一组参与复制、转录、重组和DNA修复,与DNA结合相关的蛋白质结构域,主要包括HMGB1、HMGB2和HMGB3[7]。
HMGB1的相对分子量为30 kD,是一种基因序列高度保守的非组蛋白核蛋白,在进化中,哺乳动物的HMGB1相似程度高达99%,主要参与调节基因转录,DNA修复及各项细胞的生命功能[8]。HMGB1作为内源性分子,BOX B是发挥促炎反应的关键结构,通过损伤组织释放到胞外,激活免疫系统,参与静脉血栓、动脉粥样硬化、类风湿关节炎等疾病的发生与发展[9-10]。HMGB1与肿瘤的发生发展也密切相关,在肺癌、胰腺癌、胃癌、卵巢癌、神经源性肿瘤等多种实体肿瘤组织中均发现其表达水平高于正常组织,可能在肿瘤的侵袭、转移等方面发挥重要作用[11-12]。
经AngⅡ处理后,HepG2侵袭和迁移能力增强, E-cadherin表达下调,Vimentin表达上调;与阴性对照相比,HMGB1高表达的3种肝癌细胞经AngⅡ处理后,侵袭和迁移能力增强,E-cadherin蛋白表达下调,Vimentin表达上调;与阴性对照相比,HMGB1干扰的3种肝癌细胞经AngⅡ处理前后,侵袭和迁移能力无明显差异,E-cadherin和Vimentin表达无明显差异。
与我们研究结果相似,Liu等[13]研究发现,与正常肝癌细胞株Huh7和MHCC97H相比,HMGB1基因敲除后迁移和侵袭能力显著降低,EMT相关蛋白表达降低;人胆管癌细胞经HMGB1基因敲除后,E-Cadherin表达上调, N-Cadherin、Vimentin 和Snail基因表达下调,人胆管癌细胞EMT转变受到抑制,进一步体外研究表明HMGB1可能通过促进VEGF-C表达调节淋巴结微血管的生长,促进肿瘤淋巴转移[14];Wang等[15]亦发现,HMGB1在直肠癌中可能起癌基因的作用,抑制内源性HMGB1的表达有助于激活caspase 3和多聚腺苷二磷酸核糖聚合酶,显著抑制大肠癌细胞SW620和Colo320细胞的增殖,促进肿瘤细胞凋亡。大多数研究表明HMGB1有促进肝癌细胞侵袭和迁移的能力,促进肝癌细胞发生EMT过程,在人肝癌细胞系的生物学行为中HMGB1可能发挥重要的调控作用。
肝癌细胞和祖细胞均属于上皮细胞,肝癌细胞部分或整体的EMT转化使肝癌在细胞水平上表现出异质性,上皮细胞的可塑性变化增加了细胞异质性。在肝细胞肝癌发展过程中,肿瘤细胞为避免氧化损伤和原发性肿瘤部位过量活性氧,显示出与慢性肝损伤“逃逸反应”中类似间充质-上皮转化(mesenchymal to epithelial transition,MET)作用情况。因此,肝癌细胞或祖细胞的EMT转化实质上是使间充质细胞具有抗凋亡和迁移的特性,抵抗细胞死亡刺激,并向细胞因子丰富的微环境转移。在EMT作用下,肝癌细胞能够转化为上皮细胞、部分经EMT诱导的间充质细胞或完全经EMT诱导的与纤维化组织中肝星状细胞衍生的肌成纤维细胞类似的间充质细胞,这些表型在肿瘤的任何阶段均可以MET逆转,恢复上皮性状[16]。此外,EMT能够通过促进促血管生成因子生成,促进肝癌肿瘤内部血管生成,为肿瘤提供营养素和氧供支持,逃逸肿瘤细胞通过循环传播,EMT对MET的可逆性被认为是远端定植的又一标志。
本研究发现,HMGB1在肝癌组织中表达异常升高。进一步功能研究表明,在肝癌细胞中AngⅡ能通过诱导HMGB1表达增强肝癌细胞的侵袭和迁移能力,HMGB1能促进肝癌细胞发生EMT过程。

