黄芪不同有效成分对电离辐射致BMSCsDNA损伤防护作用的比较研究
李洋洋 张苡铭 魏孔熙 周婷 何进鹏 丁楠 周谷城 史桐凡 柯宜诚 牛帆 刘永琦 张利英
摘 要 目的:比较黄芪不同有效成分对电离辐射致人骨髓间充质干细胞(BMSCs)DNA损伤的防护作用。方法:采用2 Gy X射线直接辐照BMSCs建立辐射细胞模型。采用CCK-8法检测不同质量浓度(25、50、75、100 μg/mL)黄芪多糖、黄芪皂苷、黄芪黄酮辐射前干预1 d+辐射后干预1~5 d对辐射BMSCs增殖的影响,筛选给药浓度和辐射后继续干预时间。将辐射BMSCs分为辐射组、黄芪多糖组、黄芪皂苷组、黄芪黄酮组,后3组辐射前后均使用适宜的相应药物进行干预,另设空白组进行比较;采用胞浆分裂阻滞微核法检测辐射后干预适宜时间的微核细胞率和细胞微核率,免疫荧光法检测辐射后干预适宜时间细胞中53BP1焦点簇数量,并对不同时间点(0.5、2、12、24 h)的53BP1焦点簇数量进行比较。结果:与空白组比较,辐射组BMSCs的OD值显著降低(P<0.05或P<0.01);与辐射组比较,50 μg/mL黄芪多糖、黄芪皂苷、黄芪黄酮继续干预2~3 d时BMSCs的OD值均显著升高,其余剂量组仅部分时间点有显著差异(P<0.05或P<0.01);综合考虑确定给药浓度为50 μg/mL,辐射后继续干预时间为2 d。与空白组比较,辐射组、黄芪多糖组、黄芪皂苷组、黄芪黄酮组微核细胞率和细胞微核率均显著升高,辐射组和黄芪多糖组细胞中53BP1焦点簇数量均显著增加(P<0.01)。与辐射组和黄芪黄酮组比较,黄芪多糖组和黄芪皂苷組微核细胞率、细胞微核率和53BP1焦点簇数量(辐射后干预0.5、2、12 h)均显著降低或减少,且黄芪多糖组微核细胞率和细胞微核率均显著低于黄芪皂苷组(P<0.05);超过24 h检测不出53BP1焦点簇。结论:黄芪多糖和黄芪皂苷对辐射所致的BMSCs DNA损伤均有防护作用,其中黄芪多糖防护效果优于黄芪皂苷;黄芪黄酮对辐射所致的DNA损伤无防护作用。
关键词 黄芪多糖;黄芪黄酮;黄芪皂苷;电离辐射;骨髓间充质干细胞;DNA损伤
ABSTRACT OBJECTIVE: To compare the protective effects of different effective components of Astragali radix against DNA damage of human bone marrow mesenchymal stem cells (BMSCs) induced by ionizing radiation. METHODS: 2 Gy X-rays were used to directly irradiate BMSCs to establish a radiation model. CCK-8 method was used to detect the effects of different mass concentrations (25, 50, 75, 100 μg/mL) of astragalus polysaccharide, astragalus saponin and astragalus flavonoids for 1 day before radiation + 1 to 5 days after radiation on the proliferation of BMSCs. The dose concentration and the duration of intervention after radiation were selected. The irradiated BMSCs were divided into radiation group, astragalus polysaccharide group, astragalus saponin group and astragalus flavonoids group. The last three groups were treated with appropriate dosage of corresponding drugs before and 2 days after radiation, and a blank group was set for comparison. Cytoplasmic division arrest micronucleus method was used to detect micronucleus cell rate and cell micronucleus rate after appropriate time of intervention following radiation; immunofluorescence method was used to detect the number of 53BP1 foci in cells after appropriare time of intervention following radiation; the number of 53BP1 foci were compared among different time points (0.5, 2, 12, 24 h). RESULTS: Compared with blank group, OD values of BMSCs were decreased significantly in radiation group (P<0.05 or P<0.01). Compared with radiation group, the OD values of BMSCs were significantly increased when 50 μg/mL astragalus polysaccharide, astragalus saponin and astragalus flavonoids continuously intervened radiation for 2-3 days, there was significant difference in other groups at some time point (P<0.05 or P<0.01). After consideration, drug concentration was determined to be 50 μg/mL, and the continuous intervention time was 2 days after radiation. Compared with blank group, the micronucleus cell rate and cell micronucleus rate of radiation group, astragalus polysaccharide group, astragalus saponin group and astragalus flavonoids group increased significantly, and the number of 53BP1 focus cluster in radiation group and astragalus polysaccharide group increased significantly (P<0.01). Compared with radiation group and astragalus flavonoids group, the micronucleus cell rate, cell micronucleus rate and the number of 53BP1 focus cluster (continued intervention for 0.5, 2, 12 h) in the astragalus polysaccharide group and astragalus saponin group were significantly reduced, and the micronucleus cell rate and cell micronucleus rate in the astragalus polysaccharide group were significantly lower than astragalus saponin group (P<0.05). 53BP1 focus cluster could not be detected 24 h later (P<0.05). CONCLUSIONS: Astragalus polysaccharide and astragalus saponin both have protective effects on BMSCs DNA damage induced by radiation, and the protective effect of astragalus polysaccharide is better than that of astragalus saponin; astragalus flavonoids has no protective effect on radiation-induced DNA damage.
KEYWORDS Astragalus polysaccharide; Astragalus flavonoids; Astragalus saponin; Ionizing radiation; Bone marrow mesenchymal stem cells; DNA damage
放疗是恶性肿瘤的主要治疗手段之一,放疗在杀伤肿瘤组织的同时,不可避免地会对正常组织造成损伤,产生放疗毒性[1-2]。已有研究表明,电离辐射(Ionizing radiation,IR)可通过多种机制破坏细胞,其中最重要的是造成细胞DNA损伤,当损伤无法修复时,则可引发细胞癌变[3]。骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)是具有自我更新和多向分化潜能的细胞,参与多种组织的修复。当辐射肿瘤组织时,该组织周围会聚集大量的BMSCs;受辐射影响,BMSCs可引发多种生物学反应,包括活性氧(ROS)生成、細胞凋亡和增殖抑制等,甚至会发生BMSCs恶性转化[4]。研究表明,IR会诱导BMSCs DNA损伤,其中细胞凋亡、细胞周期紊乱、衰老和细胞因子分泌等分子机制均可影响BMSCs的辐射反应[5],因此,防护IR致BMSCs DNA损伤至关重要。中医认为,辐射可导致机体耗气伤阴,而运用补气类中药黄芪可有效改善辐射导致的细胞损伤[6]。黄芪最主要的活性成分为黄芪多糖、黄芪皂苷和黄芪黄酮,研究表明其具有增强机体免疫、抗应激、抗肿瘤、延缓衰老、抗辐射等多种药理作用[7],但目前尚不明确何种成分可以有效改善IR所造成的DNA损伤。基于此,本研究拟着重比较黄芪的3种主要活性成分黄芪多糖、黄芪皂苷、黄芪黄酮对IR致BMSCs DNA损伤的防护作用,旨在为临床BMSCs的辐射防护用药提供依据。
1 材料
1.1 仪器
MCO-15AC型CO2培养箱(日本Sanyo公司);X-RAD225型X射线辐射仪(美国Faxitron公司);Infinite M200 Pro型全波长酶标仪(瑞士Tecan公司);BX51TRF型荧光显微镜(日本Olympus公司);SKY- 111Z型超净工作台(苏州净化设备有限公司)。
1.2 药品与试剂
黄芪多糖、黄芪皂苷、黄芪黄酮(上海源叶生物科技有限公司,批号分别为ZD1219LA18、B20563、J20F7T9819,均为混合物);0.25%胰蛋白酶(美国Hyclone公司,批号:J150037);CCK-8试剂盒(上海东仁化学科技有限公司,批号:JQ878);4′,6-二脒基-2-苯基吲哚(DAPI,上海浩然生物技术有限公司,批号:H-1200);兔源p53结合蛋白1(53BP1)多克隆抗体、山羊抗兔免疫球蛋白G(IgG)(DyLight? 594)二抗(美国Abcam公司,批号分别为GR89172-5、G1101);细胞松弛素B和吖啶橙染料(北京索莱宝科技有限公司,批号分别为C8080、A8120)、Triton-X 100试剂(上海生工生物工程股份有限公司,批号:0694);卡诺固定液(实验室自制);其余试剂均为实验室常用规格,水为超纯水。
1.3 细胞
人源BMSCs(批号:7500)及其专用培养基(批号:0074)均购自美国ScienCel公司。
2 方法
2.1 细胞培养
用专用培养基将BMSCs接种于60 mm培养皿中,置于37 ℃、5%CO2培养箱中培养,每3 d换液1次,待细胞融合度达到85%时,用0.25%胰蛋白酶消化传代,取第5代细胞用于试验。
2.2 辐射细胞模型建立
用X射线直接辐照BMSCs建立辐射模型,剂量率为200 cGy/min(225.0 kV,13.3 mA),总剂量2 Gy,时间1 min,距辐射源距离为70 cm。
2.3 含药培养基制备
黄芪多糖、黄芪皂苷和黄芪黄酮分别用专用培养基溶解,具体方法为:取相应药物20 mg,分别溶于专用培养基20 mL中,使其质量浓度均为1 000 μg/mL,再分别用专用培养基进行稀释,使其质量浓度分别均为100、75、50、25 μg/mL。
2.4 细胞增殖能力检测
采用CCK-8法检测。收集对数生长期的BMSCs,用0.25%胰蛋白酶消化后,以专用培养基制成单细胞悬液,按100 μL/孔(即2×103个/孔)接种于5个96孔板中,将细胞随机分为空白组、辐射组、黄芪多糖组、黄芪皂苷组、黄芪黄酮组。待细胞贴壁后,弃去培养基,各药物组分别加入含不同质量浓度(25、50、75、100 μg/mL,浓度按前期预试验结果设置)黄芪多糖、黄芪皂苷、黄芪黄酮的专用培养基100 μL,空白组和模型组加入专用培养基100 μL,每个浓度设6个复孔。预干预培养1 d后,吸弃培养基50 μL,空白组用0.3 mm厚的铅板挡住,其余各组用X射线按“2.2”项下条件进行直接照射,照射后弃剩余培养基,重新加入上述相应不含药或含药的专用培养基100 μL,置于培养箱中继续干预。分别于继续干预1、2、3、4、5 d时按CCK-8试剂盒说明书操作,使用酶标仪在490 nm波长处检测各孔的光密度(OD)值。试验重复3次,根据OD值选取后续试验黄芪多糖、黄芪皂苷、黄芪黄酮的给药浓度和辐射后继续干预时间。
2.5 细胞微核形成情况检测
采用胞浆分裂阻滞微核法检测。收集对数生长期的BMSCs,用0.25%胰蛋白酶消化后,以专用培养基制成单细胞悬液,按1 mL/孔(即1×104个/孔)接种于24孔板中,将细胞随机分为空白组、辐射组、黄芪多糖组、黄芪皂苷组、黄芪黄酮组,每组设3个复孔。待细胞贴壁后,按“2.4”项下方法加药、预干预、辐射,重新加入专用培养液后,继续干预(药物组的给药浓度和继续干预时间均参考“2.4”项下结果)。各组细胞加入1 mg/mL的细胞松弛素B 1 μL,放入细胞培养箱培养48 h后弃去培养基,用磷酸盐缓冲液(PBS,pH=7.4)洗两次,在通风橱中用卡诺固定液固定30 min,弃去固定液,反扣培养皿,在通风橱中干燥30 min,用吖啶橙染料染色30 s。用荧光显微镜观察记录1 000个双核细胞中有微核的细胞数量和1 000个双核细胞中微核的总数量(微核呈圆形或椭圆形,游离于主核之外),计算微核细胞率和细胞微核率,以千分率(‰)表示,微核细胞率=(带微核的细胞总数/总的双核细胞数)×1 000‰,细胞微核率=(微核总数目/总的双核细胞数)×1 000‰。试验重复3次。
2.6 细胞中53BP1焦点簇数量的检测
采用免疫荧光法检测。取无菌的12孔板,每孔加入20 mm×20 mm已灭菌盖玻片,用紫外线照射1 h。取对数生长期BMSCs,用0.25%胰蛋白酶消化后,以专用培养基制成单细胞悬液,按2 mL/孔(即4×103个/mL)接种于上述12孔板中,将细胞随机分为空白组、辐射组、黄芪多糖组、黄芪皂苷组、黄芪黄酮组,每组设3个复孔。按“2.5”项下方法加药、预干预、辐射、继续干预适宜时间(参考“2.4”项下结果初设继续干预时间,再根据检测结果细分干预时间,即继续干预0.5、2、12、24 h)。弃去培养基,细胞用4 ℃甲醇固定20 min后,于0.5%Triton-X 100试剂孵育10 min;用5%脱脂牛奶封闭1 h后,加入53BP1抗(稀释比例为1 ∶ 500),室温孵育2 h,以PBST溶液洗涤3次,再加入相应二抗(稀释比例为1 ∶ 1 000),室温孵育1 h,以PBST溶液洗涤5次。细胞核以DAPI进行复染并制片,使用荧光显微镜观察并拍照,每个样品计数100个细胞并计算其中53BP1焦点簇数量(53BP1蛋白显红色荧光)。
2.7 统计学方法
采用SPSS 21.0软件对数据进行统计分析。采用Shapiro-Wilk检验进行正态性检验。计量资料符合正态分布者以x±s表示,不符合正态分布者以M(P25,P75)表示,多组间的比较采用单因素方差分析,两组比较前者采用Students t检验,后者采用秩和检验。计数资料以千分率表示,采用秩和检验。P<0.05 表示差异有统计学意义。
3 结果
3.1 黄芪多糖、黄芪皂苷、黄芪黄酮对BMSCs增殖的影响
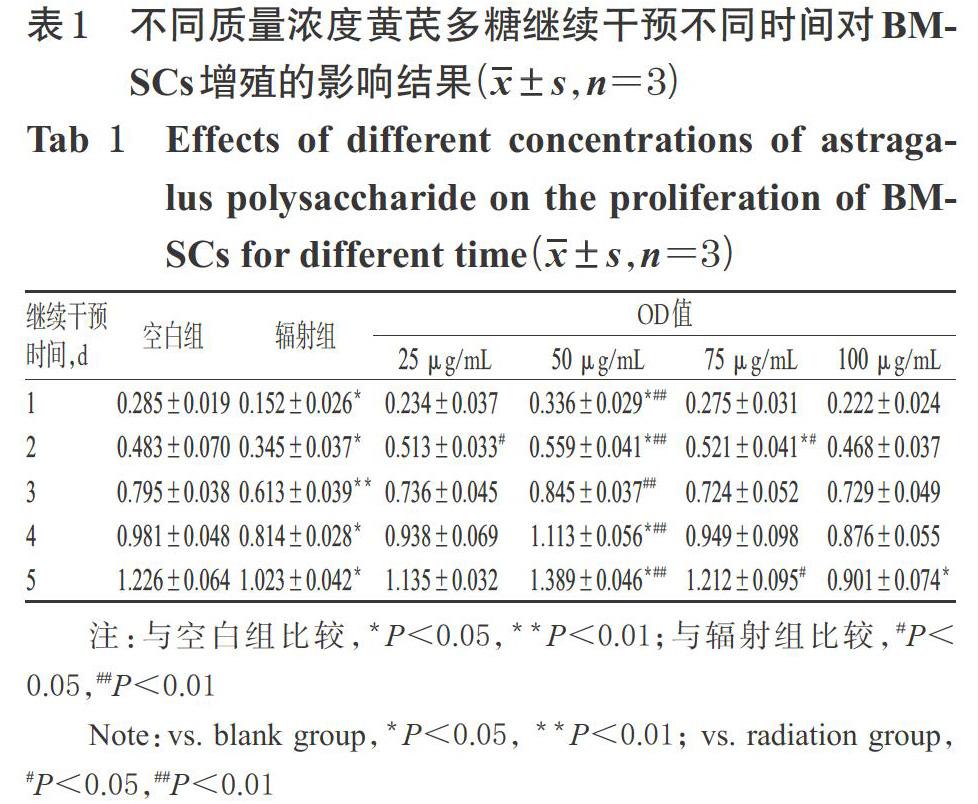
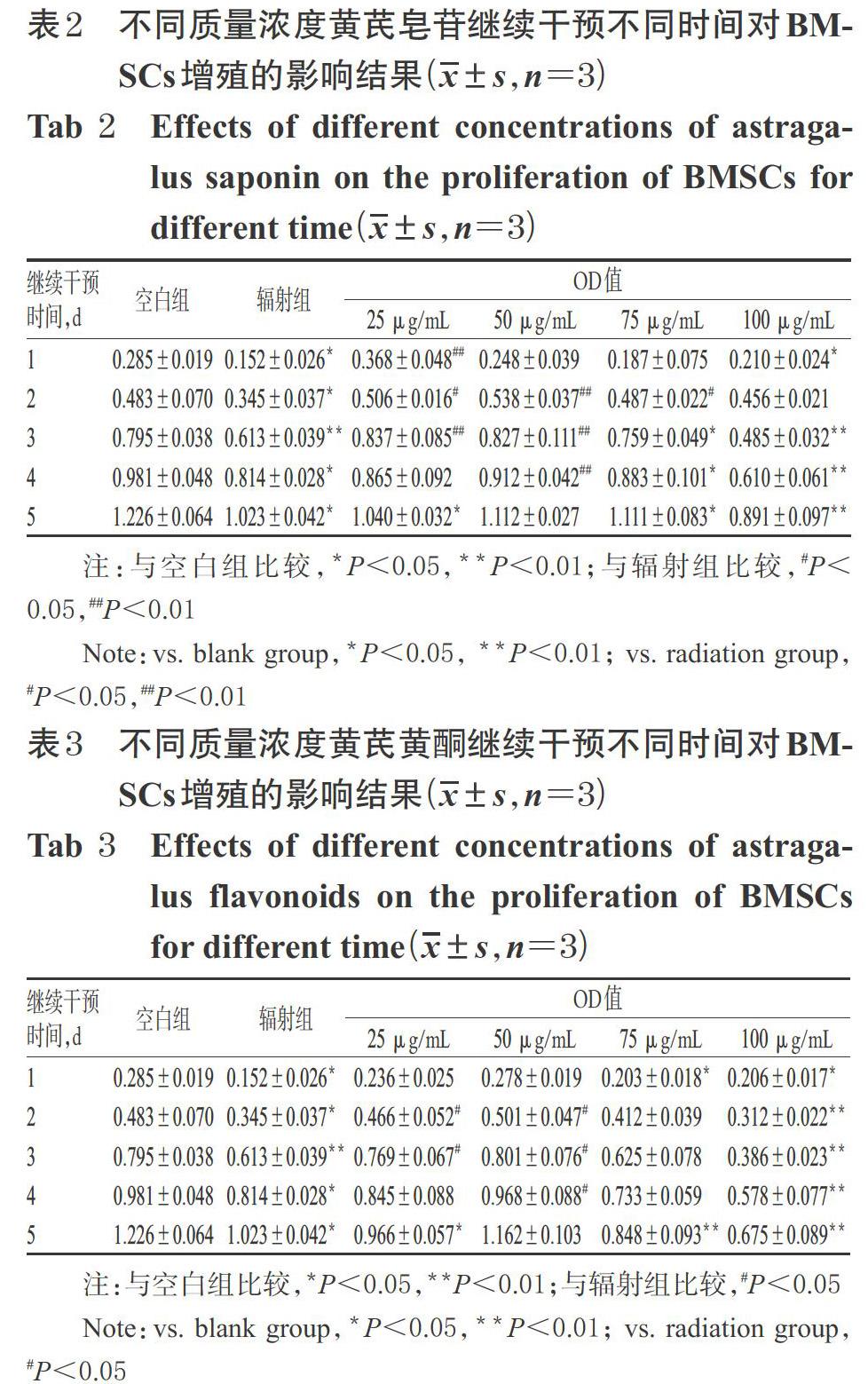
不同质量浓度黄芪多糖、黄芪皂苷、黄芪黄酮继续干预不同时间对BMSCs增殖的影响结果见表1~表3。
表1~表3结果显示,与空白组比较,辐射组各时间点的OD值显著降低,提示BMSCs增殖受到明显抑制(P<0.05或P<0.01)。与辐射组比较,25 μg/mL黄芪多糖继续干预2 d,25 μg/mL黄芪皂苷继续干预1~3 d,25 μg/mL黄芪黄酮继续干预2~3 d,50 μg/mL黄芪多糖继续干预1~5 d,50 μg/mL黄芪皂苷、黄芪黄酮继续干预2~4 d,75 μg/mL黄芪多糖、黄芪皂苷继续干预2 d时BMSCs的OD值均显著升高(P<0.05或P<0.01)。综合考虑BMSCs的生长状况,将后续试验的药物浓度确定为50 μg/mL,辐射后继续干预时间确定为2 d。
3.2 黄芪多糖、黄芪皂苷、黄芪黄酮对BMSCs细胞微核形成的影响
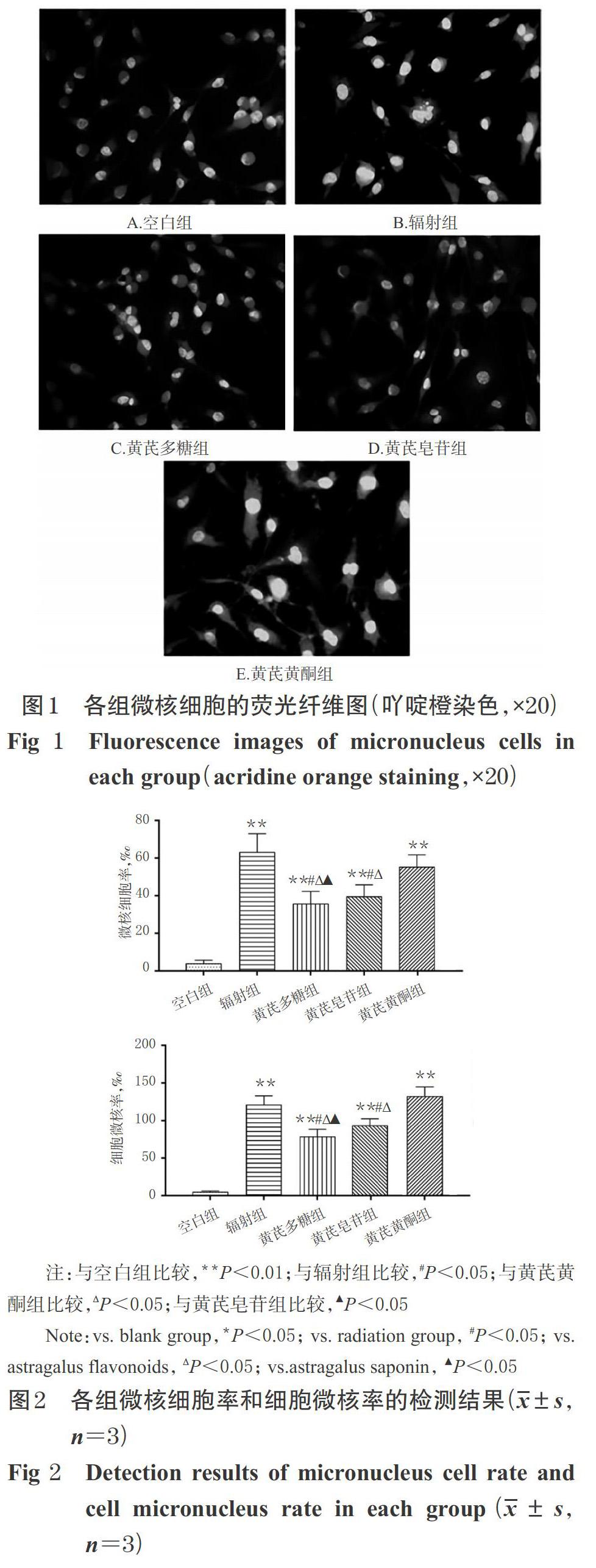
与空白组比较,辐射组、黄芪多糖组、黄芪皂苷组、黄芪黄酮组微核细胞率和细胞微核率均显著升高(P<0.01)。与辐射组和黄芪黄酮组比较,黄芪多糖组和黄芪皂苷组微核细胞率和细胞微核率均显著降低,且黄芪多糖组显著低于黄芪皂苷组(P<0.05)。各组微核细胞荧光显微图见图1,微核细胞率和细胞微核率的检测结果见图2。
3.3 黄芪多糖、黄芪皂苷、黄芪黄酮对BMSCs中53BP1焦点簇数量的影响
随着继续干预时间的延长,BMSCs中53BP1焦点簇数量逐渐减少,超过24 h已基本检测不出结果,故重点分析继续干预0.5、2、12、24 h时53BP1焦点簇数量的变化。与空白组比较,辐射组和黄芪多糖组细胞中53BP1焦点簇数量均显著增加(P<0.01)。与辐射组和黄芪黄酮组比较,黄芪多糖组继续干预0.5、2、12、24 h(与黄芪黄酮组比较除外)和黄芪皂苷组继续干预0.5、2、12时细胞中53BP1焦点簇数量均显著减少(P<0.05),而黄芪多糖组和黄芪皂苷组间比较差异均无统计学意义(P>0.05)。各組继续干预0.5 h时细胞中53BP1焦点簇的荧光显微图见图3(图中,DAPI表示细胞核,53BP1表示53BP1蛋白),53BP1焦点簇数量的检测结果见图4。
4 讨论
放疗是恶性肿瘤的关键治疗手段,然而其对周围组织造成的损伤也不容忽视。放疗在治疗恶性肿瘤的同时,也有诸多副作用,例如其所导致的造血系统、胃肠道系统、心血管及神经系统毒性反应,且随着辐射剂量的增加,毒副反应相应增加[8]。已有研究表明,化疗毒副反应的罪魁祸首即细胞DNA损伤,Smith TA等[9]研究发现,低剂量的IR即可导致细胞DNA损伤,产生大量ROS和自由基,导致细胞基因组不稳定,从而引起细胞凋亡、坏死,甚至癌变。BMSCs是具有自我更新和多向分化潜能的细胞。正常情况下,BMSCs可以对恶性肿瘤所导致的炎症微环境进行损伤修复;但当受到辐射时,BMSCs会受到辐射副作用的影响,从而抑制细胞增殖,引起细胞凋亡,甚至癌变[9]。Thomas JG等[10]研究发现,胶质瘤放疗后可增强BMSCs的定位,其中趋化因子CCL2在IR诱导BMSCs向胶质瘤的定向中起着重要作用。因此,DNA损伤为辐射副作用致BMSCs癌变的罪魁祸首。由此可见,防护辐射所致的BMSCs DNA损伤具有重要的临床意义。
DNA损伤的两个关键指标为微核的产生和DNA双链的断裂。微核也叫微卫星,是由断裂的染色体片段或染色体形成的,其出现通常是遗传毒性事件发生的标志,细胞微核率可反映染色体DNA损伤程度[11]。DNA双链断裂是细胞暴露于IR后最重要的DNA损伤。细胞DNA双链断裂后,很快诱发组蛋白γH2AX的第139位丝氨酸磷酸化为53BP1,53BP1对于募集其他DNA损伤修复反应蛋白到DNA损伤位点处进行DNA损伤修复起着非常关键的作用,其焦点簇数量能够反映辐射损伤的水平,是评价DNA双链断裂的重要指标[12-13]。本研究结果显示,进行IR之后,BMSCs微核细胞率和细胞微核率均显著升高,这与已有研究[14]报道结果一致。
中医将IR命名为新型毒邪——电离毒,兼具火热之性,可耗气伤津,使人体正气亏虚,故补气生津应为辐射防护的主要治则[15]。中药黄芪为补气生津的代表,具有补气升阳、益卫固表等功效,是我国传统的补气中药材之一。黄芪主要活性成分为多糖、皂苷和黄酮等,具有增强机体免疫、造血功能、抗应激、抗肿瘤、延缓衰老、抗辐射、抗菌、抗病毒等多种药理作用[7]。但黄芪是由多种成分共同构成的,尚不清楚哪一种成分防护IR的效果更好。本研究通过CCK-8法检测不同质量浓度黄芪多糖、黄芪皂苷、黄芪黄酮对BMSCs增殖的影响,结果显示,50 μg/mL黄芪多糖、黄芪皂苷和黄芪黄酮对辐射BMSCs进行干预后均可明显促进BMSCs的增殖。用50 μg/mL黄芪多糖和黄芪皂苷对辐射BMSCs继续干预2 d或24 h后,BMSCs的微核细胞率、细胞微核率和53BP1焦点簇数量均显著减少且黄芪多糖组的微核细胞率、细胞微核率均显著低于黄芪皂苷组;而50 μg/mL黄芪黄酮干预则对微核细胞率、细胞微核率和53BP1焦点簇数量无显著影响。由此表明,黄芪多糖和黄芪皂苷对辐射所致的DNA损伤均有防护作用,其中黄芪多糖的防护效果优于黄芪皂苷;而黄芪黄酮对辐射所致的DNA损伤无防护作用。其中,黄芪多糖对IR的防护作用与文献报道结果[16-19]一致。本研究结果为黄芪有效成分防护IR所致BMSCs DNA损伤的应用提供了选择依据,为临床辐射防护奠定了理论基础,但是关于具体的防护作用机制尚不明确,后续仍需进一步探讨。
参考文献
[ 1 ] CITRIN DE. Recent developments in radiotherapy[J]. N Engl J Med,2017,377(11):1065-1075.
[ 2 ] DE RUYSSCHER D,NIEDERMANN G,BURNET NG,et al. Radiotherapy toxicity[J]. Nat Rev Dis Primers,2019.DOI:10.1038/s41572-019-0073-4.
[ 3 ] SANTIVASI WL,XIA F. Ionizing radiation-induced DNA damage,response,and repair[J]. Antioxid Redox Sign,2014,21(2):251-259.
[ 4 ] LIU ZL,LI T,DENG SN,et al. Radiation induces apoptosis and osteogenic impairment through miR-22-mediated intracellular oxidative stress in bone marrow mesenchymal stem cells[J]. Stem Cells Int,2018. DOI:10.1155/2018/5845402.
[ 5 ] XIANG Y,WU C,WU J,et al. In vitro expansion affects the response of human bone marrow stromal cells to irradiation[J]. Stem Cell Res Ther,2019. DOI:10.1186/S1328/- 019-1191-3.
[ 6 ] WANG Z,QI F,CUI Y,et al. An update on Chinese herbal medicines as adjuvant treatment of anticancer therapeutics[J]. Biosci Trends,2018,12(3):220-239.
[ 7 ] LI X,QU L,DONG Y,et al. A review of recent research progress on the astragalus genus[J]. Molecules,2014,19(11):18850-18880.
[ 8 ] PANNKUK EL,FORNACE AJ,LAIAKIS EC. Metabolomic applications in radiation biodosimetry:exploring radiation effects through small molecules[J]. Int J Radiat Biol,2017,93(10):1151-1176.
[ 9 ] SMITH TA,KIRKPATRICK DR,SMITH S,et al. Radioprotective agents to prevent cellular damage due to ionizing radiation[J]. J Transl Med,2017. DOI:10.1186/s12967- 017-1338-x.
[10] THOMAS JG,PARKER KERRIGAN BC,HOSSAIN A,et al. Ionizing radiation augments glioma tropism of mesenchymal stem cells[J]. J Neurosurg,2018,128(1):287- 295.
[11] SU C,HASKINS AH,KATO TA. Micronuclei formation analysis after ionizing radiation[J]. Methods Mol Biol,2019. DOI:10.1007/978-1-4939-9432-8_3.
[12] MAVRAGANI IV,NIKITAKI Z,KALOSPYROS SA,et al. Ionizing radiation and complex dna damage:from prediction to detection challenges and biological significan- ce[J]. Cancers:Basel,2019. DOI:10.3390/cancers11111789.
[13] GONON G,VILLAGRASA C,VOISIN P,et al. From energy deposition of ionizing radiation to cell damage signaling:benchmarking simulations by measured yields of initial DNA damage after ion microbeam irradiation[J]. Radiat Res,2019,191(6):566-584.
[14] SREETHARAN S,THOME C,TSANG KK,et al. Micronuclei formation in rainbow trout cells exposed to multiple stressors:morpholine,heat shock,and ionizing radiation[J]. Toxicol In Vitro,2018. DOI:10.1016/j.tiv.2017. 10.026.
[15] 王磊,王安,胡素敏.試论急性辐射损伤的中医学病因:电离毒[J].北京中医药大学学报,2017,40(1):27-30.
[16] 周妮娜,张利英,刘永琦,等.黄芪多糖对电离辐射诱发间充质干细胞基因DNA损伤的保护作用[J].中国现代应用药学,2016,33(2):139-143.
[17] 王磊,许小敏,张艳辉,等.黄芪多糖对X线辐射所致骨髓间充质干细胞细胞核、染色体及DNA损伤的影响[J].中国肿瘤,2018,27(9):708-714.
[18] 张利英,王磊,张丽昕,等.黄芪多糖对重离子辐射BMSCs防护作用及与NF-κB相关机制研究[J].中华中医药杂志,2018,33(12):5576-5580.
[19] LI YR,CAO W,GUO J,et al. Comparative investigations on the protective effects of rhodioside,ciwujianoside-B and astragaloside Ⅳ on radiation injuries of the hematopoietic system in mice[J]. Phytother Res,2011,25(5):644-653.
(收稿日期:2020-09-16 修回日期:2020-10-29)
(编辑:邹丽娟)

