益生菌复配富铬酵母缓解2型糖尿病的作用机制涉及调节肠道菌群失调
周兴婷,于雷雷,翟齐啸,田丰伟,赵建新,张灏,陈卫
(江南大学 食品学院,江苏 无锡,214122)
肠道菌群作为人体组成的一个重要部分,发挥着重要而又特殊的营养代谢和肠道屏障保护功能。近年来,越来越多的研究表明2型糖尿病的发生与肠道菌群失调有着密切的关系。肠道菌群在宿主体内具有与病原体竞争性定殖、发展免疫系统和肠道屏障系统的功能[1]。肠道菌群失调会导致机体免疫力下降、慢性炎症反应和能量代谢失衡等一系列并发症,这些会进一步导致代谢紊乱和胰岛素抵抗[2],最终形成2型糖尿病。2型糖尿病是以胰岛素抵抗、葡萄糖耐量降低和低度炎症引发的以高血糖为特征的代谢紊乱症之一[3]。国际卫生组织预测2025年糖尿病患者数量将突破3亿,而中国是世界上糖尿病患者数居第2的国家,主要以2型糖尿病为主[4],目前大量研究表明,2型糖尿病会导致小鼠肠道菌群拟杆菌门丰度下降,厚壁菌门丰度上升[5]。对肠道菌群的调节成为当前的一种干预和治疗2型糖尿病的新策略。肠道菌群的可塑性将发展为一种很有前途的治疗手段[6]。乳酸菌属于益生菌的种类之一,近些年对乳酸菌的研究日益增多,益生菌由于其益生性和安全性已经被广泛地应用于发酵食品,且乳酸菌对改善2型糖尿病的症状具有显著的效果,鼠李糖乳杆菌CRL981能够显著缓解高血糖水平,调节机体血脂水平和抗氧化酶的活力[7]。富铬酵母产品具有很好的降糖效果,能够显著缓解糖尿病相关症状,因其效果显著和安全性高的特点在市场上被广泛应用于糖尿病人群的饮食干预。铬参与糖代谢,调控胰岛素功能,从而发挥降糖效果。本文通过研究2株具有显著降糖效果的乳杆菌,植物乳杆菌X1和鼠李糖乳杆菌CCFM0528与富铬酵母进行复配组合,应用于2型糖尿病小鼠模型中,探究其复配剂是否具有协同增效的作用,其缓解机制是否涉及调节肠道菌群失调。本研究的成果将为益生菌复配剂应用于2型糖尿病的干预治疗提供重要参考依据。
1 材料与方法
1.1 菌株和试剂
植物乳杆菌(X1)、鼠李糖乳杆菌(CCFM0528),江南大学食品生物中心菌种保藏中心;富铬酵母,安琪酵母股份有限公司;盐酸二甲双胍片,中美上海施贵宝制药有限公司;链脲佐菌素(STZ),sigma公司;基因组提取试剂盒Fast DNA®SPIN Kit for Feces,美国MP公司;DNA回收试剂盒TIANgel Mini Purification Kit,天根生化科技有限公司;蛋白胨、牛肉膏、酵母粉、无水葡萄糖、无水乙酸钠、MgSO4·7H2O、MnSO4、柠檬酸氢二钠、K2HPO4·3H2O、吐温80、乙酸、丙酸和丁酸,国药集团化学试剂有限公司。
1.2 仪器与设备
小型冷冻离心机,德国Hettich有限公司;大容量冷冻离心机,美国Beckman公司;高速冷冻离心机,Eppendorf公司;隔水式恒温生物培养箱,上海一恒科技有限公司;SW-CJ-1CV型微生物操作超净工作台,苏州安泰空气技术有限公司;高温高压灭菌锅,日本SANYO公司;EL204型电子天平,上海梅特勒-托利多仪器有限公司;气相色谱-质谱联用,岛津中国公司;PCR仪、核酸电泳仪、凝胶成像仪,美国Bio-Rad公司;MiSeq测序仪,美国Illumina公司。
1.3 实验方法
1.3.1 乳杆菌的活化与培养
从-80 ℃冰箱中取出乳杆菌的保菌管,在乳酸细菌培养基(MRS) 固体平板上划线,挑出单菌落接种到MRS液体培养基后于37 ℃培养18 h,之后以1%~2%(体积分数)的接种量接种于MRS液体培养基中在37 ℃培养18 h,连续活化3代后用于后续实验。
1.3.2 益生菌复配剂的制备
将活化菌株按1%(体积分数)的接种量接种于1 L的液体培养基中扩大培养,37 ℃恒温培养下培养18 h后,在4 ℃,6 000 r/min的条件下离心10 min后获得菌泥,无菌生理盐水冲洗3次,用10%(质量分数)的脱脂乳作为保护剂重悬,冷冻干燥后,与富铬酵母进行复配,其中小鼠每日摄入每种乳杆菌含量为109CFU,富铬酵母按小鼠每日铬摄入量100 μg/kg为标准进行复配。小鼠灌胃之前,用无菌生理盐水重悬调整菌液浓度为5×109CFU/mL,富硒酵母为5 mg/mL,并在37 ℃水浴中复苏30 min后使用。
1.3.3 动物实验
1.3.3.1 益生菌复配剂的降糖效果评价实验
选取50只体重相近的3周龄SPF级C57BL/6J雄性小鼠,喂养程序经江南大学动物管理和使用委员会的许可(许可证号:JN.No 20180115c0700613[24])。实验动物房常年恒温恒湿,保持温度在(22±2)℃和湿度在(55±5)%的范围内,并严格遵循12 h昼夜循环标准。适应性喂养1周,喂食普通饲料,1周后随机分为5组,分别为空白组、模型组、药物组、乳酸菌组、复合组。分组后前5周实验期间,正常组喂食普通饲料,其余各组喂食高脂饲料,同时正常组、模型组、药物组灌胃脱脂乳,乳酸菌组喂食混合乳酸菌溶液、复合组喂食益生菌复配剂。第5周,所有小鼠禁食8 h以上,正常组小鼠腹腔注射生理盐水,其余各组小鼠注射新鲜的链脲佐菌素STZ(按100 mg/kg体重注射)。造模1周后,所有小鼠开始喂食普通饲料,同时正常组和模型组灌胃脱脂乳,药物组开始灌胃盐酸二甲双胍(按10 mg/kg体重灌胃),乳酸菌组喂食混合乳酸菌溶液、复合组喂食益生菌复配剂。
1.3.3.2 小鼠粪便肠道菌群的测定[8]
在收集小鼠粪便之后,准确称量500 mg的小鼠粪便样品,利用Fast DNA®SPIN Kit for Feces试剂盒提取粪便样品中的DNA。以提取到的DNA为模板,经过PCR扩增16S rDNA的V3、V4区。PCR体系为50 μL,上游引物341 R,下游引物806 R。扩增结束之后,制作琼脂糖凝胶,点样后进行电泳,利用电泳操作来进行DNA条带的分离,对条带亮区进行切胶回收,将得到的DNA利用Qubit 3.0测定样品的DNA浓度,然后经Illumina MiSeq测序仪进行上机测定。上机测定完成之后,获得下机数据地址,根据bacode表筛选出正确的样品标签,制定出Mapping_File文件,利用SSH Secure Shell Client软件进行数据提取和合并。去除嵌合体序列,进行OTU聚类,选取OTU代表性序列以进行后续分析。通过对序列进行分类,制定biom格式的OTU表。随后将otu_table.biom文件转换可读的OTU_table.txt文件,根据otu_table.biom进行α、β多样性分析和肠道菌群门属水平种类与丰度的多样性分析。
1.3.3.3 小鼠粪便短链脂肪酸的测定[8]
收集粪便之后,放在冻干平板上进行冻干处理脱去水分之后,准确称取50 mg样品放入500 μL饱和NaCl溶液中进行破碎处理,然后加入20 μL H2SO4溶液进行酸化处理,处理完之后加入1 mL乙醚溶液进行短链脂肪酸的提取,将上清液倒入无水Na2SO4固体中进行脱水处理,样品制备完成后转移至棕色进样瓶中,利用气相色谱-质谱联用技术来检测小鼠粪便中的乙酸、丙酸、丁酸中的表达量。
1.4 实验数据处理
实验数据以平均值±标准差表示,数据分析采用One-way ANOVA分析,作图采用Graphpad 8.0。
2 结果与分析
2.1 小鼠肠道菌群α多样性和β多样性分析
为了研究乳酸菌与富铬酵母的复配是否对糖尿病小鼠的肠道菌群结构具有调节作用,通过16S rDNA扩增子测序的方法来分析小鼠粪便中肠道菌群的组成与丰度,分析不同组别间小鼠菌群的α多样性和β多样性,α多样性和β多样性一起构成了小鼠菌群的总体多样性或一定区域的生物异质性。Chao1指数反映了小鼠粪便菌群的丰富性,Shannon指数反映了小鼠粪便菌群的多样性。结果如图1-A所示,造模组小鼠菌群丰富度明显下降,这与IN KIELER等[9]的研究结果一致;如图1-B所示,各组小鼠Shannon指数并没有显著性差异,这说明各组小鼠之间菌群多样性没有显著差异,这与HAN等[10]的研究结果一致。图1-C结果显示模型组集中在PCA图的右下角,药物组、乳酸菌组、复合组与空白组聚集混合在一起,集中在PCA图中上方,这说明糖尿病会引起小鼠肠道菌群发生改变,不同的干预治疗方式会带来不同程度菌群结构的恢复。
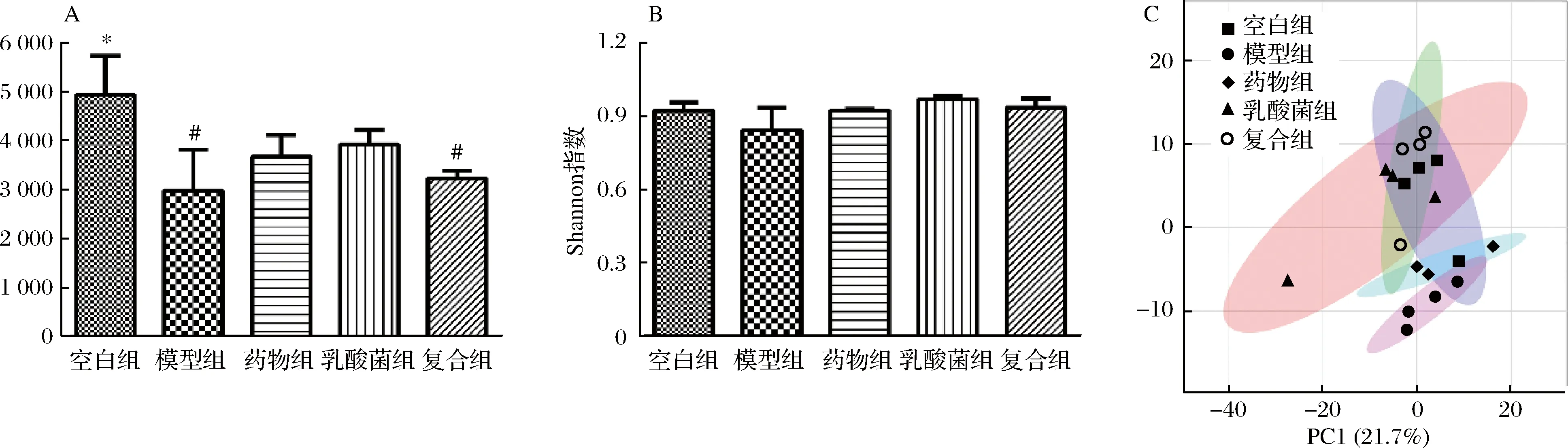
A-菌群丰富度;B-shannon指数;C-主成分分析图1 不同组别小鼠粪便菌群的α多样性、β多样性Fig.1 Alpha diversity, beta diversity of gut microbiota in different groups of mice注:#代表与空白组比较有显著差异,P<0.05;*代表与造模组比较有显著差异,P<0.05。下同。
2.2 小鼠肠道菌群门水平上菌群变化
如图2所示,小鼠粪便菌群在门水平上,主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia) 和变形菌门(Proteobacteria) 组成。图2结果显示,经STZ造模后的糖尿病小鼠在门水平上,Firmicutes丰度明显上升,Bacteroidetes丰度明显下降(P<0.05),这与CAO等[11]的研究结果相一致。
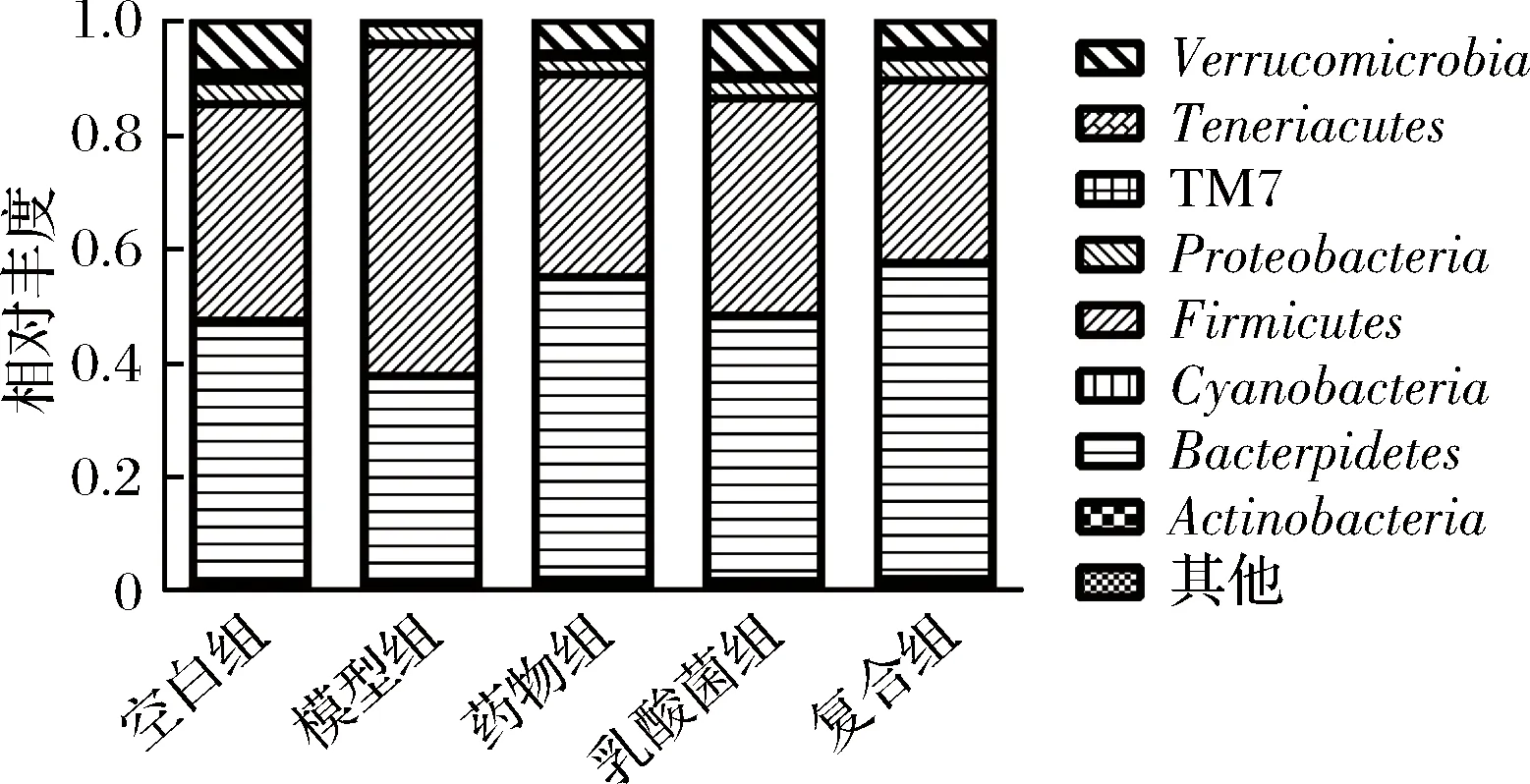
图2 不同组别小鼠肠道菌群的门水平丰度Fig.2 The phylum level of gut microbiota in different groups of mice
Firmicutes和Bacteroidetes是肠道菌群门水平上最主要的组成成分,相对丰度达到70%~90%,肠道内Firmicutes与Bacteroidetes的比例增大时会导致机体更加有效地吸收食物中的热量,从而导致肥胖,研究表明肥胖导致的肠道菌群失调,是诱发2型糖尿病的原因之一。在实验前期通过喂食高脂饲料来诱导糖尿病模型,如图3所示。
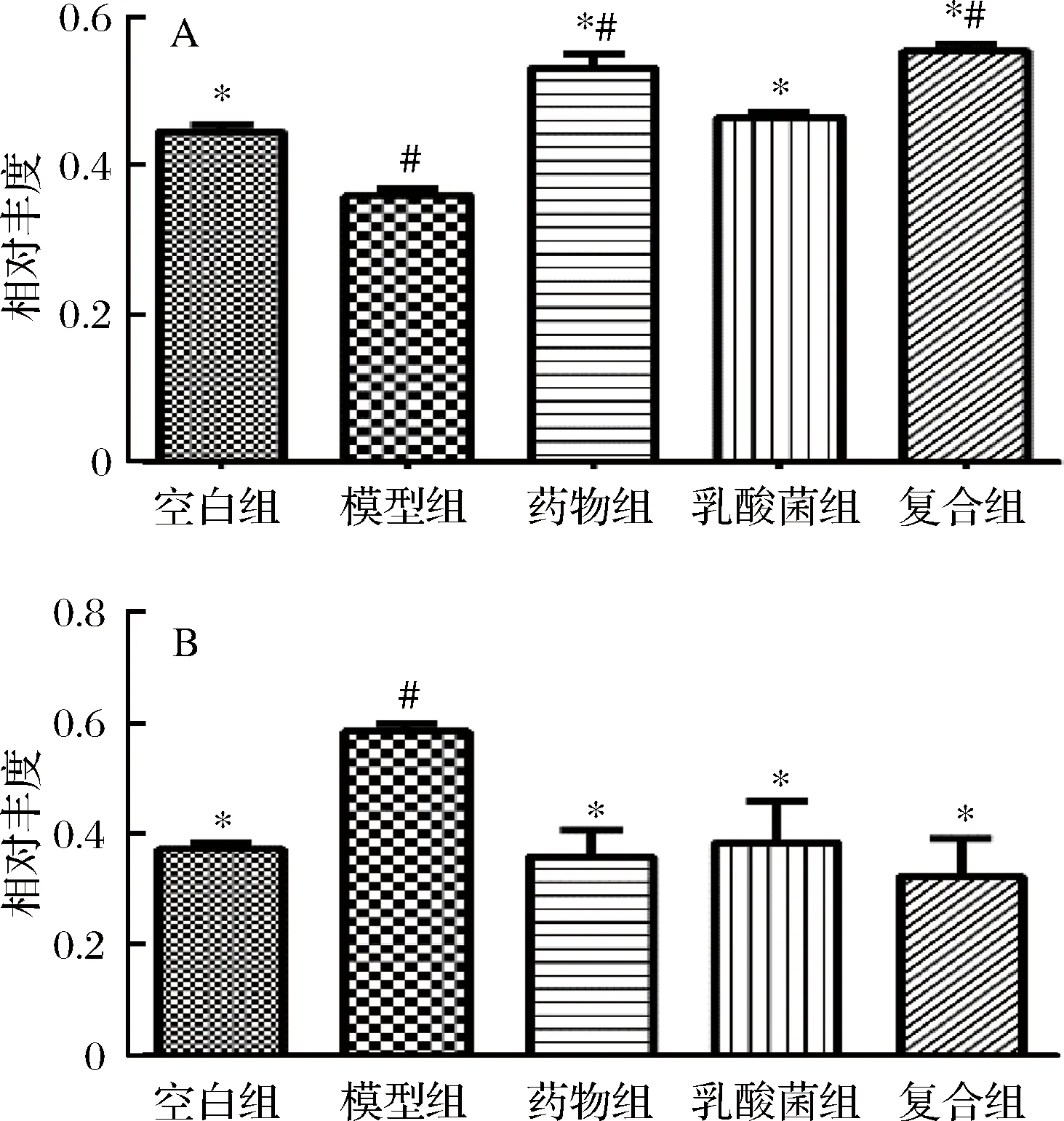
A-拟杆菌门;B-厚壁菌门图3 不同组别小鼠粪便菌群的Bacteroidetes和Firmicute丰度Fig.3 Bacteroidetes and Firmicute abundance of gut microbiota in different groups of mice
模型组小鼠Bacteroidetes明显下降,Firmicutes明显上升,而经过治疗后,药物组、乳酸菌组和复合组的Bacteroidetes和Firmicute的相对丰度均有所恢复,这说明药物组发挥了一定的缓解效果,乳酸菌组和复合组的结果显示,二者均能够显著回调Bacteroidetes和Firmicute的丰度,一定程度缓解2型糖尿病导致的肠道菌群失调。
2.3 小鼠肠道菌群属水平上的差异
从门水平上进行分析,发现2型糖尿病模型会导致肠道菌群发生紊乱,为了进一步探究2型糖尿病在属水平上的差异,利用数据分析软件进一步分析属水平上菌群的相对丰度。如图4所示,小鼠菌群在厌氧棒状菌属(Anaerostipes)、粪球菌属(Coprococcus)、瘤胃球菌属(Ruminococcus)、多尔氏菌属(Dorea)、理研菌属(Rikenellaceae-g_)、双歧杆菌属(Bifidobacterium)、乳杆菌属(Lactobacillus)、Akk菌属(Akkermansia) 等水平上发生了明显改变。

图4 不同组别小鼠肠道菌群的属水平丰度Fig.4 Genus abundance of gut microbiota in different groups of mice
如图5-A所示,与空白组相比,在属水平上,模型组中双歧杆菌属(Bifidobacterium)、乳杆菌属(Lactobacillus)、Akk菌属(Akkermansia) 和瘤胃球菌属(Ruminococcus) 丰度明显减少(P<0.05),经过干预治疗后,复合组小鼠Bifidobacterium、Lactobacillus和Akkermansia菌群丰度均有明显回升(P<0.05),但是Ruminococcus丰度增加但是没有显著性差异。
Bifidobacterium和Lactobacillus是一类居住在肠道内并发挥多种益生作用的微生物,它们可以维护人体健康和调节免疫功能,部分菌株可以有效抑制血糖的增长,达到缓解2型糖尿病的效果[12]。研究发现Bifidobacterium的丰度与肠道内毒素水平存在显著负相关关系[13],内毒素可以激活TLR4 /MyD88/NF-κB途径,释放炎症因子,导致细胞胰岛素抵抗(IR)。糖尿病小鼠由于机体炎症水平导致双歧杆菌丰度下降,而经过干预处理后,其丰度有所回升。Lactobacillus可以抑制诱导自身免疫性糖尿病的CD4+T细胞和细胞因子(IL-2) 的产生,同时可以抑制胰岛β细胞的自身免疫性破坏[14]。胰岛β细胞的破坏加剧了2型糖尿病的症状,在经过乳杆菌干预治疗后,可以明显改善机体2型糖尿病的病症。Ruminococcus[15]是一类革兰氏阳性厌氧菌,是发酵产生丁酸的肠道微生物主要成员之一,丁酸是碳水化合物和脂肪代谢途径的核心,通过影响短链脂肪酸的含量来影响2型糖尿病患者的血糖水平。Akkermansia[16]是人体肠道中一种可降解黏蛋白的细菌,它与肥胖、糖尿病、炎症和代谢紊乱呈负相关,研究发现Akkermansia可以显著增强机体的葡萄糖耐受性并减弱脂肪组织炎症。2型糖尿病小鼠葡萄糖耐受性明显下降且伴随组织炎症[17],造模后导致模型组小鼠Akkermansia丰度明显下降,而喂食乳酸菌和富铬酵母能够明显增加了Akkermansia属丰度。说明喂食乳酸菌和富铬酵母能够在一定程度缓解2型糖尿病造成的肠道菌群紊乱。
与空白组相比,在属水平上,模型组厌氧棒状菌属(Anaerostipes)、粪球菌属(Coprococcus)、多尔氏菌属(Dorea)、理研菌属(Rikenellaceae-g_) 明显增多(P<0.05)。经过干预治疗后,复合组能够显著降低Anaerostipes、Coprococcus和Rikenellaceae-g_菌群丰度(P<0.05)。
Anaerostipes[18]是一类革兰氏阳性致病菌,其致病物质主要是外毒素,可引起局部炎症,当外毒素入血后引起全身中毒症状,常损伤心肌与外周神经,Anaerostipes与2型糖尿病宿主机体炎症水平息息相关。Coprococcus[19]是一类革兰氏阳性厌氧菌,与肠道健康、胃肠道功能和炎症水平息息相关。Dorea[20]是肠道中主要的产气菌,利用碳水化合物产气,与肠易激综合征有关。Rikenellaceae[21]是一类存在于肠道内的致病菌,与艾滋病、胃癌和炎性肠病等疾病的发生息息相关。Anaerostipes、Coprococcus和Rikenellaceae是肠道内存在的致病菌,能够加剧机体炎症水平,其致病物质内毒素进入机体后,会通过TLR4/MyD88/NF-κB等途径在机体内释放炎症因子,导致机体炎症,破坏机体健康状态,胰岛β细胞被破坏,诱导2型糖尿病的形成,同时也会导致一系列并发症的发生,如炎症性肠病。2型糖尿病小鼠肠道稳态遭到破坏,其致病菌的丰度升高,进一步加剧了肠道稳态失调。
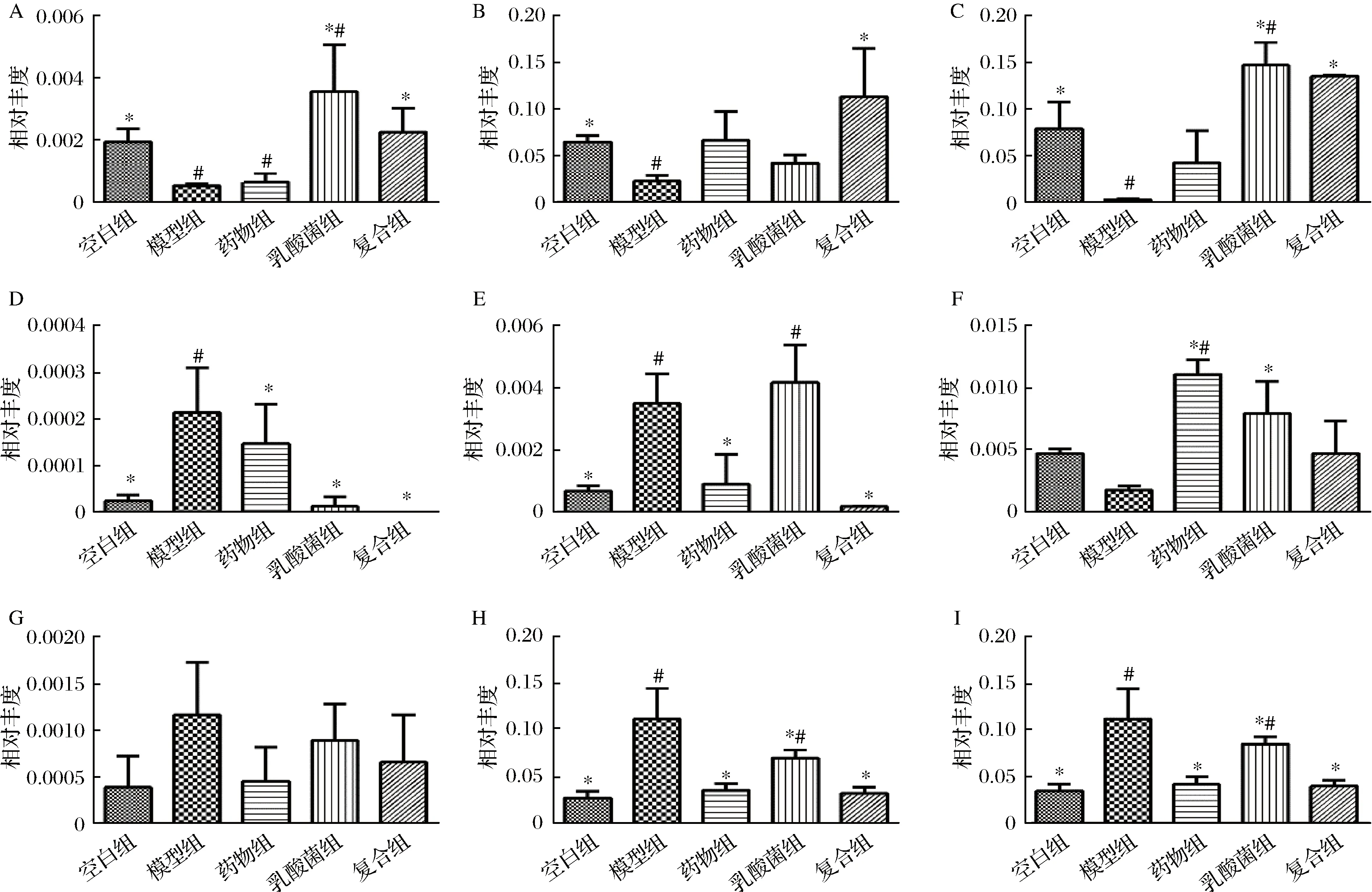
A-双歧杆菌属;B-乳杆菌属;C-Akk菌属;D-压氧棒球菌属;E-类球菌属;F-瘤胃球菌属;G-多尔氏菌属;H-理研菌属;I-分类■理研图5 不同组别小鼠肠道菌群的不同菌属丰度Fig.5 Different species abundance of gut microbiota in different groups of mice
2.4 造模组和复合组间菌群差异分析
对小鼠粪便门水平和属水平上菌群丰度的分析,发现复配配方能够在一定程度缓解2型糖尿病造成的肠道菌群稳态失调的症状,利用LEfse分析对模型组和复合组2组之间进行比较,进行亚组分析,从而找到这2组间在丰度上具有显著差异的物种,分析结果如图6所示。
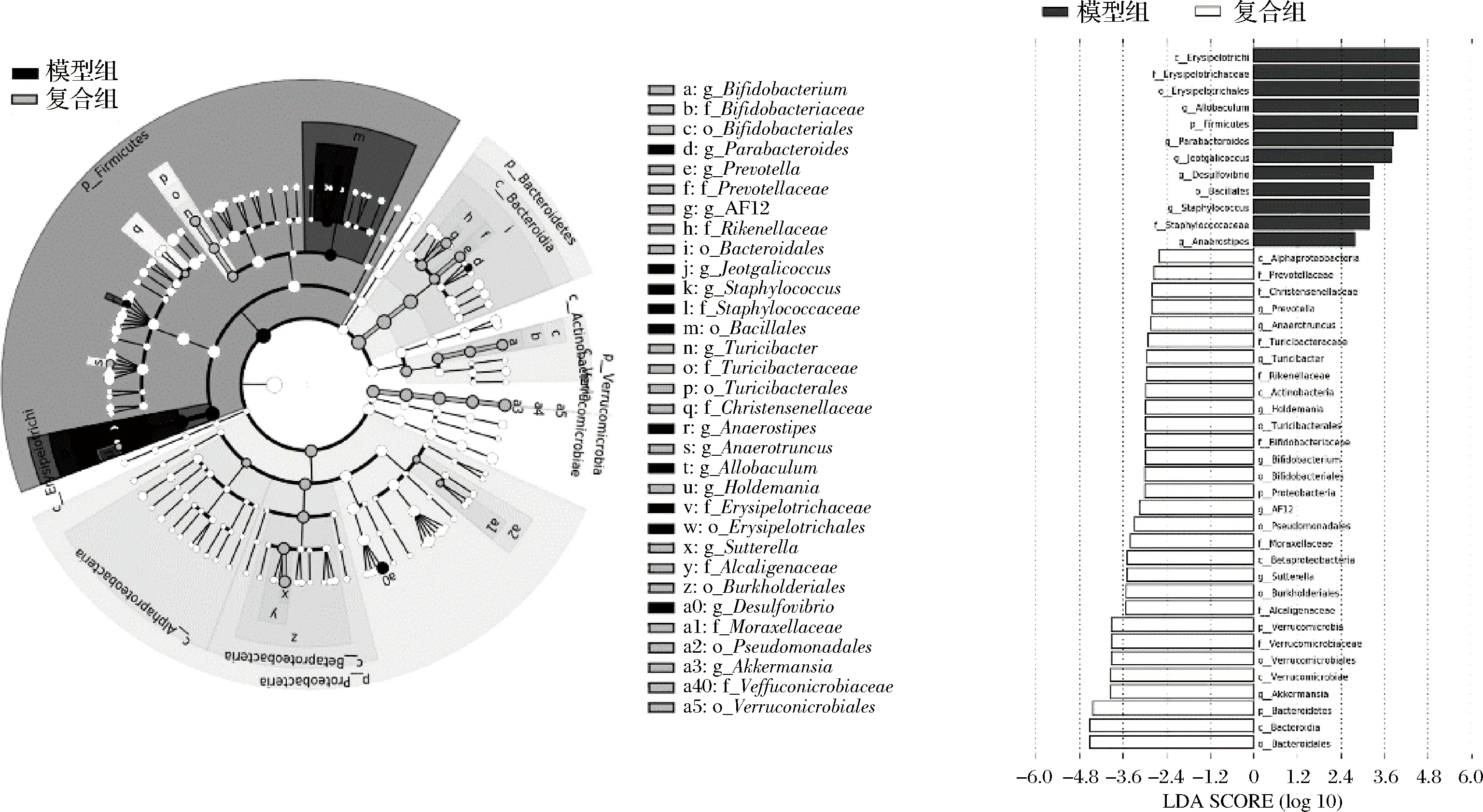
图6 造模组和复合组的进化分支图和LDA值分布柱状图Fig.6 Model and cocktail group evolutionary branch diagram and LDA score diagram
模型组小鼠厚壁菌门(Firmicutes)、丹毒丝菌纲(Erysipelotrichi) 存在显著差异,且厚壁菌门(Firmicutes)、丹毒丝菌纲(Erysipelotrichi)、咸海鲜球菌(Jeotgalicoccus)、副杆菌属(parabacteroides) 和支原菌属(Allobaculum) 丰度上明显增加。复合组小鼠拟杆菌门(Bacteroidetes)、变形菌纲(Alphaproteobacteria)、β-变形菌纲(Betaproteobacteria) 和放线菌纲(Actinobacteria) 存在显著差异,且拟杆菌门(Bacteroidetes)、Akk菌属(Akkermansia) 和双歧杆菌属(Bifidobacterium) 丰度上明显增加。
2.5 小鼠粪便短链脂肪酸含量结果
短链脂肪酸与2型糖尿病之间有着密切关系,短链脂肪酸是由某些肠道菌群通过复杂的多糖发酵产生,主要以乙酸、丙酸和丁酸为主,在能量代谢、葡萄糖稳态、脂肪生成调节和免疫调节过程中发挥重要作用[22]。糖尿病会导致短链脂肪酸水平降低并改变肠道微生物的代谢活性,导致肠道菌群的生态失调[23]。乙酸由宿主体内多种厌氧菌产生,在细胞中,乙酸是碳水化合物和脂肪代谢途径的核心,并且在这些过程中与辅酶A结合[24],在结肠和体循环中浓度最高。丙酸也是通过细菌发酵产生的,一部分进入体循环后可作为糖异生的产物,与机体血糖控制有关,并且其可作为奇数链脂肪酸代谢的中心产物,具有一定的潜在毒性,奇数链脂肪酸分解所必需的酶会导致丙酸等毒素在循环中积聚,导致呕吐、脱水、酸中毒、低肌张力、癫痫发作和嗜睡[25]。丁酸大部分直接作用于肠道,与2型糖尿病的保护作用密切相关[26],其可以通过降低LPS易位来减轻机体炎症,同时可以激活小鼠结肠细胞中的过氧化物酶体增殖物激活受体-γ,抑制兼性厌氧致病菌的生长,促进健康肠道菌群[27]。小鼠粪便总酸水平如图7(A) 所示,造模组小鼠粪便中总酸含量明显下降(P<0.05),而二甲双胍药物组经药物治疗后,总酸含量明显回升,与空白组没有明显差异,这说明药物组治疗效果明显,且乳酸菌组总酸含量较模型组有所上升,复合组总酸含量上升明显,与模型组有显著性差异(P<0.05),这说明复合组治疗效果显著,且优于乳酸菌组。如图7(B~D) 所示为小鼠粪便中乙酸、丙酸、丁酸含量,发现模型组小鼠三者含量明显下降(P<0.05),这与CAO等[11]的研究一致,糖尿病会导致短链脂肪酸含量下降,可能是因为糖尿病导致肠道菌群稳态失调,促进致病菌生长,抑制有益菌生长,降低肠道内的发酵反应,减少短链脂肪酸的生成,而药物组、乳酸菌组、复合组乙酸、丙酸和丁酸水平明显回升,均展现出较好的治疗效果。

A-总酸;B-乙酸;C-丙酸;D-丁酸;E-相关性分析图7 不同组别小鼠总酸、乙酸、丙酸和丁酸含量及相关性分析Fig.7 Total acid, acetic acid, propionic acid and butyric acid in different groups of mice and correlation analysis
短链脂肪酸是由某些肠道微生物通过复杂的多糖发酵产生,通过数据来解析短链脂肪酸生成与肠道微生物之间的相关性,结果如图7-E所示,发现Lactobacillus和Ruminococcus与短链脂肪酸的生成呈正相关性,且与乙酸、丁酸和丙酸的生成呈正相关性,而Akkermansia和Bifidobacterium与丁酸的生成呈正相关性。GABRIELLA等[28]研究发现,乳杆菌NCFM和动物双歧亚种能够显著增强人结肠模型中短链脂肪酸的产生,尤其是乙酸、丙酸和丁酸。Ruminococcus[29]是公认的产丁酸的菌,丁酸的减少会促进炎症并破坏正常的肠道屏障功能,患有2型糖尿病的个体在其肠道中表现出产丁酸菌丰度的下降,Rikenellaceae_g_与Dorea是肠道内的致病菌,与乙酸、丙酸和丁酸的生成呈明显的负相关性,说明Rikenellaceae_g_与Dorea丰度的增加在一定程度上抑制了肠道微生物发酵生成短链脂肪酸。ZHANG等[30]研究发现,利用E.gardneri水提取物可以调节肠道微生物,模型组中肠道菌群发生明显的Rikenellaceae_g_与Dorea丰度上升,出现乙酸和丙酸下降,干预治疗后,菌群丰度下降,短链脂肪酸产量增多。短链脂肪酸与肠道微生物之间的相关性分析可以发现Lactobacillus、Ruminococcus等肠道有益菌可以促进短链脂肪酸的产生,促进肠道健康,而Rikenellaceae_g_与Dorea等肠道致病菌的滋生会破坏肠道菌群稳态,加剧机体炎症水平。乳酸菌组和药物组均起到改善肠道菌群稳态失调的症状。
3 结论
通过将具有缓解2型糖尿病能力的植物乳杆菌X1、鼠李糖乳杆菌CCFM0528与富铬酵母进行复配,应用于高脂饲料和STZ诱导的2型糖尿病模型,发现药物组发挥了缓解2型糖尿病的作用,而乳酸菌组与复合组能够有效增加乙酸、丙酸和丁酸含量,改善肠道菌群的丰度,增加有益菌Bifidobacterium、Lactobacillus、Akkermansia和Ruminococcus丰度,减少致病菌Anaerostipes、Coprococcus、Dorea和Rikenellaceae-g_的丰度,在一定程度上缓解了2型糖尿病的肠道失调。其中复合组相比乳酸菌组的保护效果更显著,更显著增加Lactobacillus的丰度,降低Coprococcus和Rikenellaceae-g_的丰度,同时短链脂肪酸含量被显著增加。综上,复合组对2型糖尿病小鼠肠道菌群失调具有最显著的改善作用。本研究的成果将为益生菌复配剂应用于2型糖尿病的干预治疗提供重要参考依据。

