外源H2全程连续导入沼气原位纯化的实验研究
陈文佳,程玉娥,楼毕觉,林春绵
(浙江工业大学 环境学院,浙江 杭州,310014)
根据《全国农村沼气发展“十三五”规划》测算,中国每年产生农作物秸秆10.4亿t,可收集资源量约9亿t,约有1.8亿t的秸秆未得到有效利用,导致了环境污染和资源浪费[1]。因此将农业生产过程中产生的大量农作物秸秆进行资源化利用产甲烷,是近年来国内外学者研究生物质固废处理的热点之一,也是中国目前大力倡导发展的技术之一[2-4]。秸秆发酵可生产沼气作为能源,又可处理有机废物以保护环境,经沼气发酵后的沼渣、沼气液是优化的有机肥料[5]。沼气作为一种混合气体,主要由60%~70%的CH4、30%~40%的CO2组成,CO2作为一种惰性气体存在于沼气中,降低了沼气的热值和能量密度,严重限制了沼气的用途。
本课题组先前已建立了一套能够将外源H2连续导入沼气发酵系统的装置,初步探索了将不同量的外源H2在发酵稳定期连续地通入厌氧发酵系统对厌氧发酵的影响,初步得到合适的外源H2通入量。本文在之前的基础上,尝试在发酵初始阶段连续通入不同量的外源H2,并在发酵稳定阶段接着通入适量的外源H2进行实验,探究在发酵全程不同时间点通入不同量的外源H2对发酵体系中各参数的影响。
1 材料与方法
1.1 实验材料
使用目前农作物秸秆中占比较大的玉米秸秆,取自河南省开封市杞县高阳镇青龙石口村,秸秆的总固体(total solid, TS)为(88.7±0.2)%,挥发性固体(volatile solid, VS)为(82.1±0.4)%,使用前用粉碎机将其粉碎。沼液,取自杭州正兴牧业有限公司浙江大学奶业科学研究所实验牧场,TS为(4.0±0.1)%,VS为(2.4±0.2)%。实验中所用的药品均为色谱纯试剂。
1.2 实验装置及说明
实验装置如图1所示,发酵瓶容积为1 L,工作容积为600 mL。首先向发酵瓶中装入40.4 g的玉米秸秆和300 mL的新鲜沼液,然后加水稀释,将工作体积控制为600 mL,总TS控制在(8±0.1)%。用带有取样针的橡胶塞盖子密封发酵瓶,为了将发酵瓶维持在厌氧状态,需用Ar气吹扫瓶内残留的空气。将发酵瓶放在恒温水浴锅中,在高温(55±1)℃下进行沼气厌氧发酵。外源H2由钢瓶提供,经过转子流量计初步计量和稳定流量后,然后通过蠕动泵调节,最后利用分气头(三通)将H2分别均等的输送到条件相同的发酵瓶里,构成平行实验。厌氧发酵过程中用无菌注射器吸取发酵液,取样结束后,向发酵瓶中注入等量的新鲜沼液以补充接种物。另外,提前用皂膜流量计来检验蠕动泵的流量。
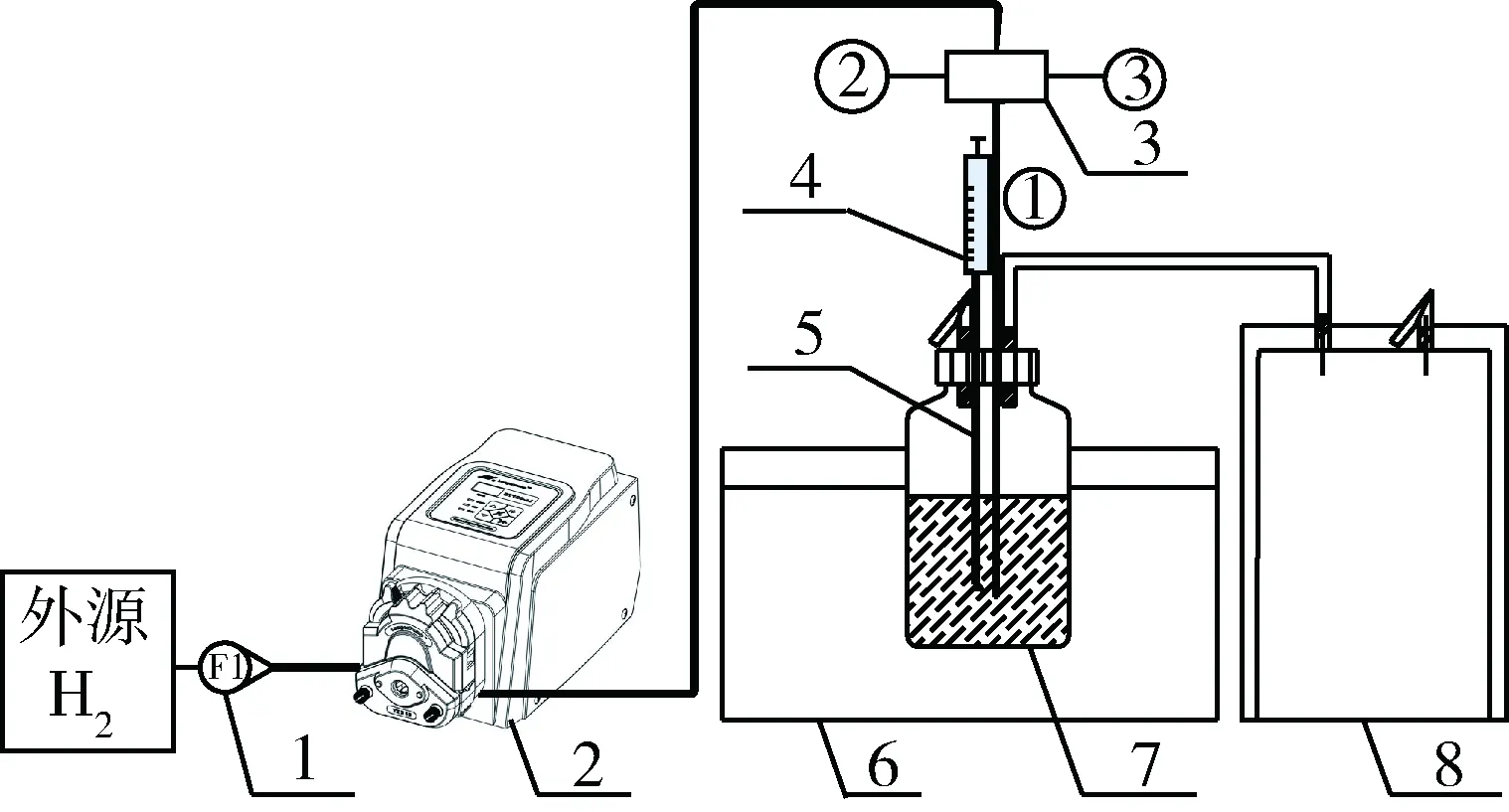
1-转子流量计;2-蠕动泵;3-分气头;4-注射器;5-取样针;6-水浴锅;7-发酵瓶;8-沼气收集装置图1 连续厌氧发酵装置示意图Fig.1 Schematic diagram of continuous anaerobic fermentation setup
根据厌氧发酵体系中食氢产甲烷路径H2与CO2之间的化学计量关系(即1 mol CO2被转化成CH4需要4 mol H2),结合预实验中沼气和CO2产量的变化,确定发酵初始阶段以及发酵稳定阶段外源H2的通入量,具体见表1。
为了后续书写便捷,采用“0/0”表示对照组;用“0/4”、“0/5”表示仅在发酵稳定期通入CO2产生量4、5倍的外源H2量的实验组;“3/4”、“4/4”表示发酵初始阶段通入CO2产生量3、4倍的外源H2量,并在发酵稳定期接着通入CO2产生量4倍H2量的实验组;“3/5”、“4/5”同理。
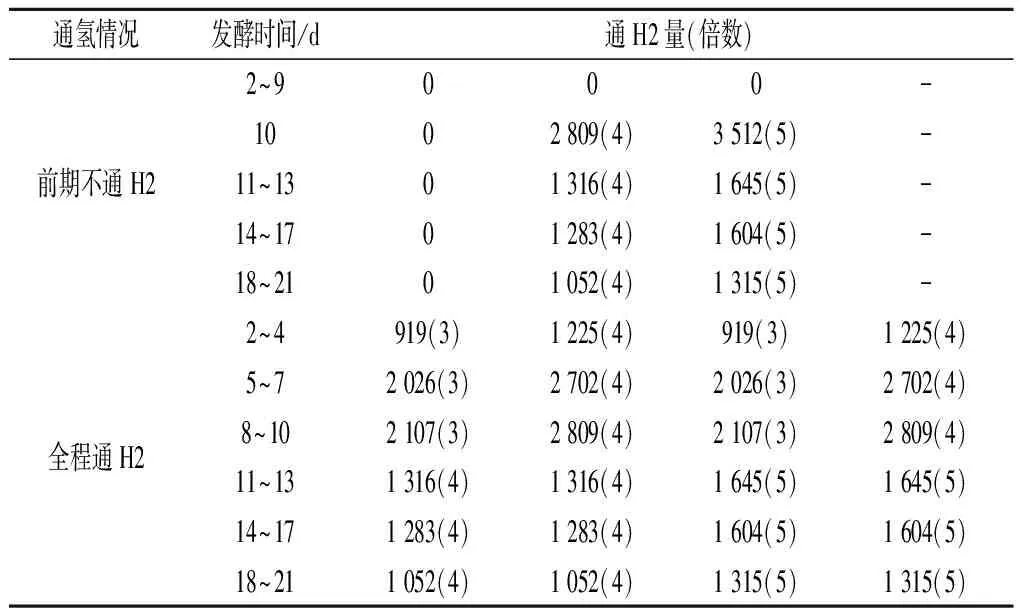
表1 不同发酵阶段外源H2通入量Table 1 Amount of exogenous H2 introduction at different fermentation stages
注:表中初始阶段不通外源H2的实验组,稳定期从第10天开始计;全程通外源H2的实验组,稳定期从第11天开始计。“-”表示无。
1.3 分析方法
TS和VS的测定采用干重法;发酵液的pH通过型号为雷磁PHB-4的pH计进行测定;沼气中CH4、CO2和H2的含量用气相色谱法(GC-6890N,Agilent Technologies)来测定,采用热导检测器(TCD)、TDX-01分析柱和5A分子筛填充柱;用气相色谱法(GC-6890N,Agilent Technologies)检测发酵液的VFAs,采用火焰离子化检测器(FID)、毛细管柱(AT-FFAP)分析柱。
沼气日产量可以通过每天集气柜被沼气顶起的高度与其底面积的乘积获得。对照组的沼气可以直接利用该方法计算,实验组的沼气中可能会残留部分外源H2,利用公式(1)对沼气日产量进行修正[17]。
V′=(1-y)V
(1)
式中:V′—修正后的沼气产量,mL/L;y—沼气中残留的H2体积分数,%;V—修正前的沼气产量,mL/L。
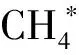
2 结果与分析
2.1 外源H2通入时间及通入量对产气的影响
将不同量的外源H2在不同的时间点连续通入厌氧发酵系统中后沼气总产量和CH4产量变化如表2所示。从表中数据可以看出,当发酵稳定阶段通入的外源H2量一定时,随着发酵初始阶段外源H2通入量由0增加到3倍时,沼气总产量和CH4产量均逐渐增加,而当初始阶段外源H2通入量继续增加到4倍时,沼气总产量和CH4产量均出现下降的趋势。其中当外源H2通入量增加到4/5倍时,沼气总产量降低到29 018.7 mL/L-1,较对照组降低3.5%,而CH4总产量仍略高出对照组10.7%。发酵初始阶段通入外源H2对CH4产量的影响比沼气产气的影响更大。当发酵初始阶段通入外源H2一定,在发酵稳定阶段适当增加外源H2通入量,可以达到沼气和CH4增产的目的。外源H2通入量为3/5倍时取得较好的产气效果,此时沼气总产量和CH4总产量分别达36 414.1、18 331.9 mL/L-1,分别高出对照组21.1%、47.4%。
分析原因,发酵初始阶段适量的外源H2可以强化同型产乙酸菌自养生长利用H2和CO2合成乙酸,为产甲烷阶段提供了直接利用的底物,提高有机物的转化,从而促进了沼气产气,提高了CH4含量[15]。发酵稳定期通入的外源H2主要被氢营养型产甲烷菌利用,将H2与CO2转化合成CH4。而过量的外源H2通入会使沼液pH升高呈碱性环境,不利于厌氧发酵,也可能因为过量的H2无法被全部消耗,发酵罐内氢分压过高导致发酵不稳定[19]。因此,发酵全过程通入适量的外源H2较只在发酵稳定期通入外源H2的实验组沼气和CH4产量有所提高。而过量的外源H2通入可能会形成不利于发酵的环境,从而导致沼气产气和甲烷产量下降。
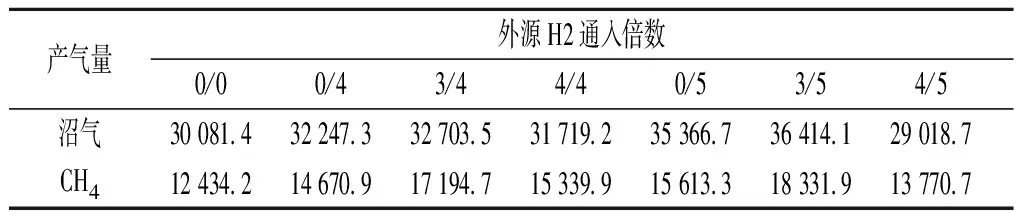
表2 不同外源H2通入量及通入时间下沼气总产量和CH4总产量 单位:mL/L
2.2 外源H2通入时间及通入量对沼气各组分的影响
图2和图3分别为该条件下沼气中CH4、CO2的相对含量随发酵时间的变化。由图2和图3可知,随着发酵时间的进行,CH4的含量逐渐升高,CO2含量逐渐降低,最后分别趋于稳定。在发酵稳定期通入适量H2能明显提高CH4相对含量,降低CO2相对含量,与乔玮等[20]最新研究结果一致。在发酵初始阶段也通入外源H2对初始阶段的CO2和CH4相对含量无明显影响,当进入稳定阶段后,全程通入外源H2的实验组的CH4和CO2相对含量比初期不通外源H2的实验组都有一定的上升和下降,且随通入H2倍数的增加,效果更明显。当H2通入量为3/5倍时,平均CO2相对含量较对照组显著降低,平均CH4相对含量(83.5%)比对照组(63.2%)提高了约32.1%。
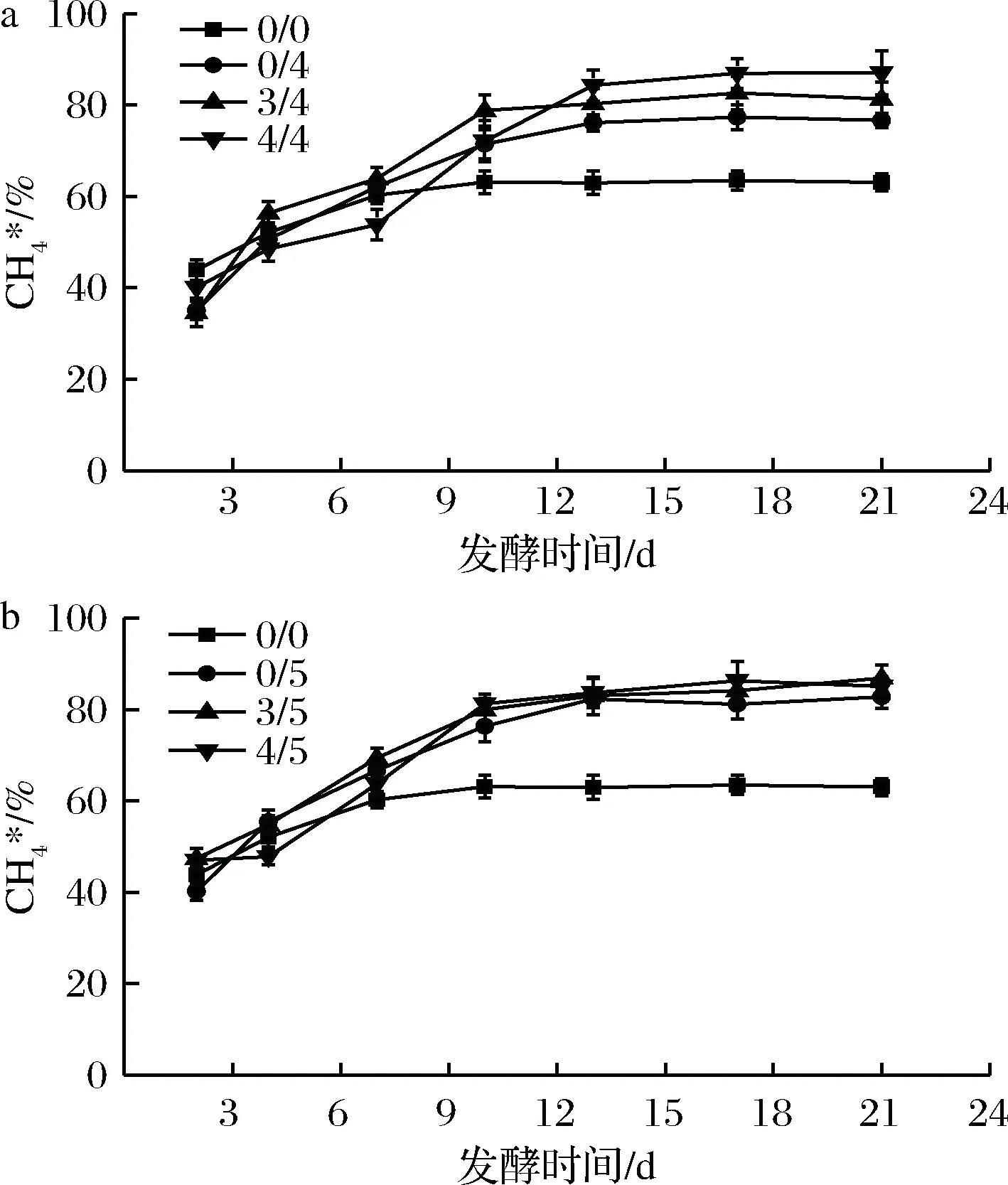
a-后期通4倍H2;b-后期通5倍H2图2 不同外源H2通入量及通入时间下含量的变化Fig.2 The relative content of CH4 at different quantity and time of exogenous H2 supply
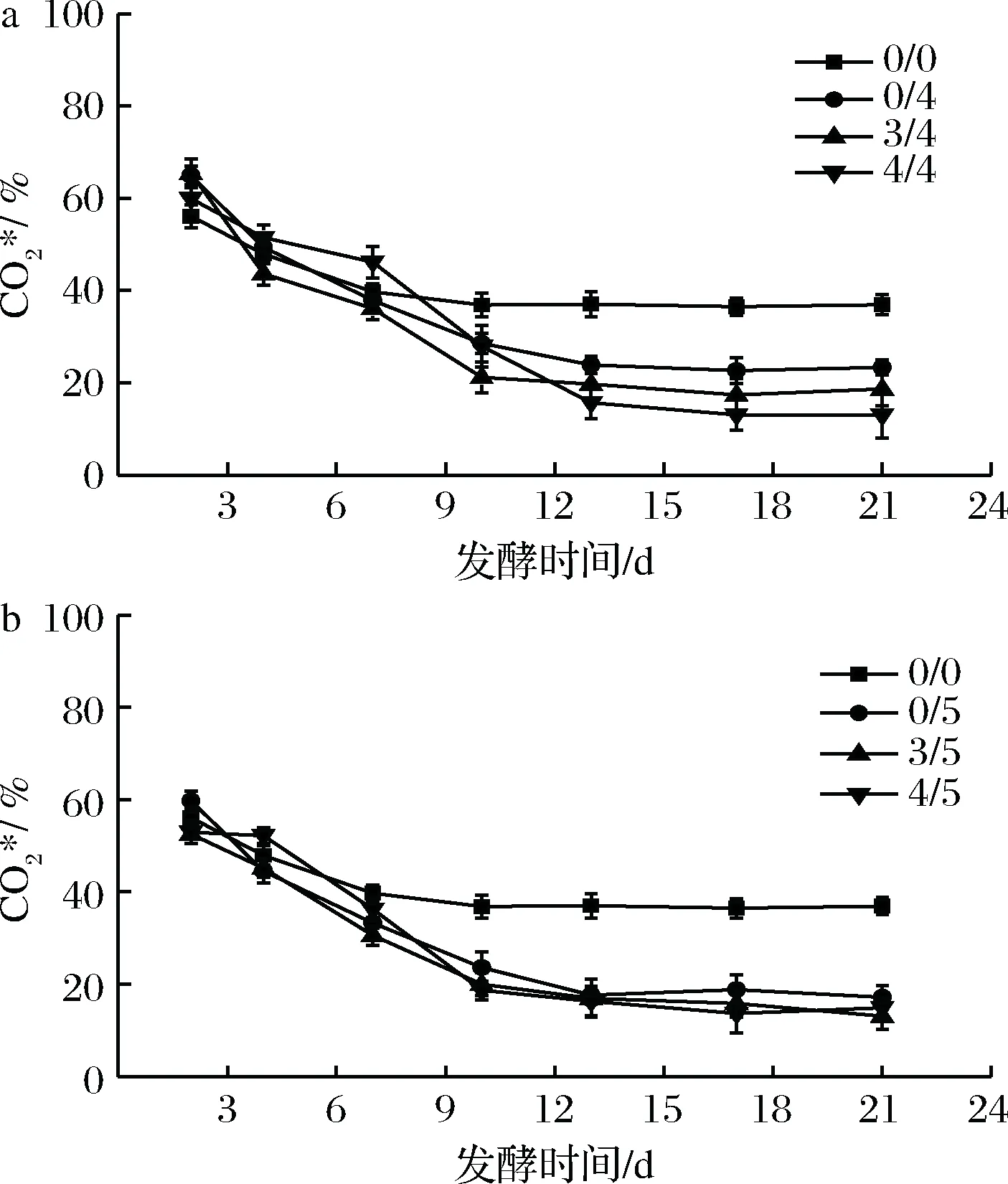
a-后期通4倍H2;b-后期通5倍H2图3 不同外源H2通入量及通入时间下含量的变化Fig.3 The relative content of at different quantity and time of exogenous H2supply
分析原因,这可能是因为向厌氧发酵系统中注入外源H2时,同型产乙酸菌并不能立即起作用,当发酵液中H2水平较高时,同型产乙酸菌以H2和CO2为基质合成乙酸为产甲烷阶段做准备[15]。且随着发酵初始阶段外源H2通入量的增加,同型产乙酸菌的作用得到了加强,从而大量消耗H2和CO2合成乙酸为产甲烷提供底物。而同型产乙酸菌发挥作用时并不会抑制食氢产甲烷菌消耗外源H2原位还原CO2。因此发酵全程通入外源H2较仅在发酵稳定期通外源H2可以取得更高的沼气提纯效果。
2.3 外源H2通入时间及通入量对发酵液VFAs和pH的影响
不同外源H2通入量及通入时间下发酵液中VFAs的浓度随发酵时间的变化以及发酵结束时该条件下发酵液中总VFAs的浓度分别如表3、表4和图4所示。随着发酵的进行,发酵底物消耗,VFAs浓度逐渐降低,最后保持在较低水平。相比仅在发酵稳定期通入外源H2,在发酵初始阶段也通入适量外源H2使发酵液中的VFAs降解更明显。而过量的外源H2通入会使VFAs降解出现轻微抑制,导致发酵后期发酵液中乙酸、丙酸和丁酸出现暂时累积,MULAT等[16]也曾报道过相同的结果。
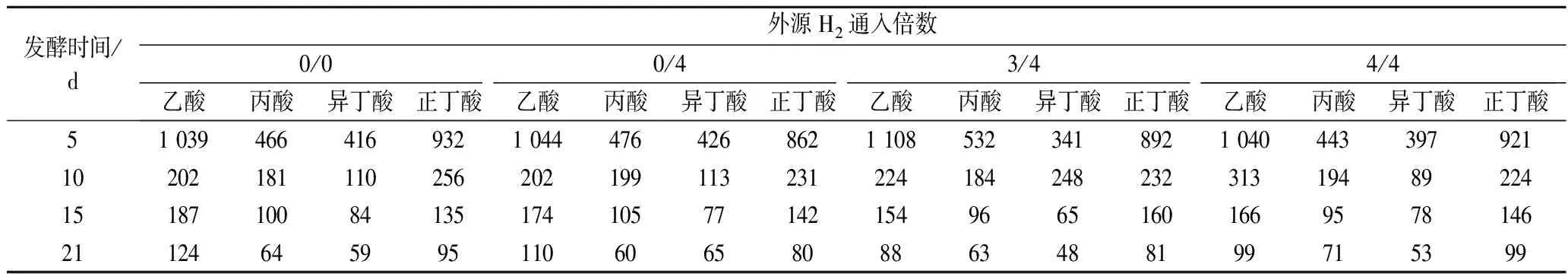
表3 后期通4倍H2发酵液中VFAs浓度随发酵时间的变化 单位:mg/L
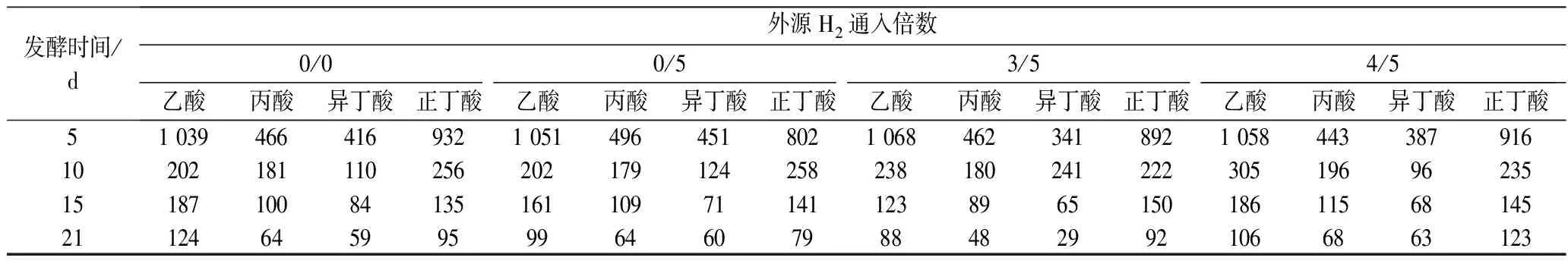
表4 后期通5倍H2发酵液中VFAs浓度随发酵时间的变化 单位:mg/L
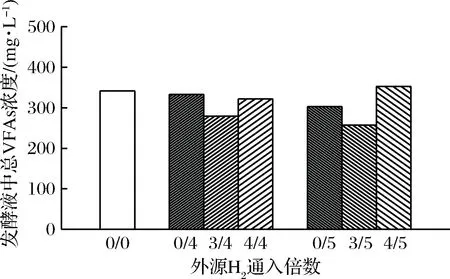
a-后期通4倍H2;b-后期通5倍H2图4 发酵结束时发酵液中总VFAs浓度Fig.4 The total VFAs concentration in biogas slurry at the end of fermentation
分析原因,可能是适当增加外源H2通入可以刺激同型产乙酸菌利用H2产生乙酸,然后进一步转化成CH4,从而将VFAs维持在较低水平。而外源H2通入过量时,生成的乙酸来不及被利用而存在于发酵液中,从而被累积。而较高的乙酸水平还可能导致丙酸、丁酸降解受到抑制。
另外通过图5可知,向厌氧系统中连续通入适量外源H2后,发酵液的pH变化趋势和对照组一致。在发酵初始阶段通入外源H2较不通外源H2的实验组,在初始阶段pH下降更明显,而随着发酵的进行,pH上升也更显著。这可能是因为初始阶段外源H2通入可以刺激同型产乙酸菌利用H2产生乙酸,导致丙酸、丁酸降解受到抑制,从而pH降低。而pH升高是因为外源H2的通入,使食氢产甲烷菌处于优势地位,发酵液中碳酸氢盐被食氢产甲烷菌大量消耗,以及发酵底物降解过快而得不到及时补充,从而导致pH明显上升[21]。LUO等也曾报道外源H2的通入导致pH上升至8.3甚至更高,对厌氧发酵产生抑制[22]。对此,ANGELIDAKI实验组曾采用牛粪与乳清共发酵的方法,控制pH低于8[23]。在发酵结束时外源H2通入量为4/5倍的实验组pH出现低于其他实验组的现象,可能与该条件下发酵液中VFAs降解缓慢并出现轻微累积有关。
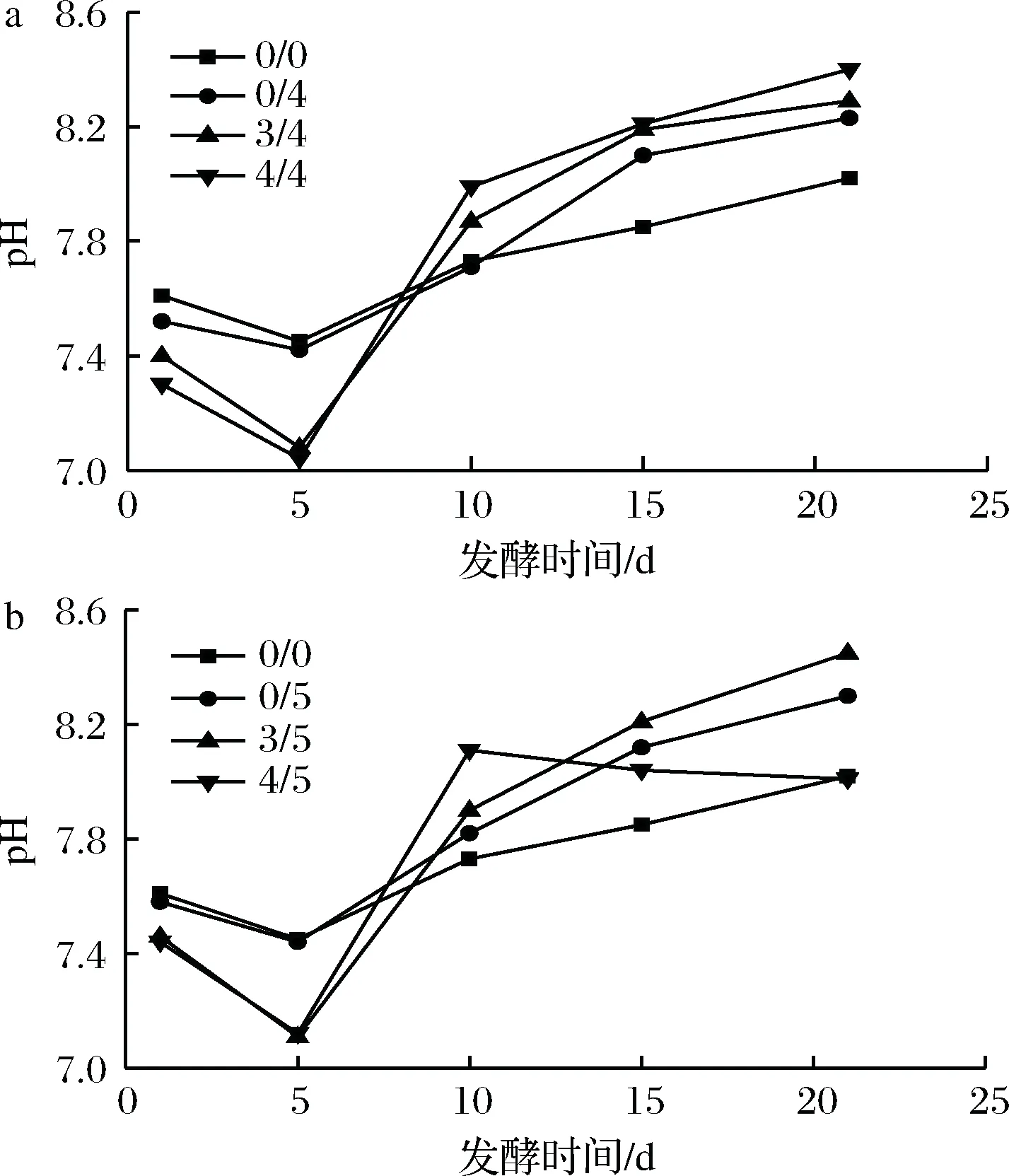
a-后期通4倍H2;b-后期通5倍H2图5 发酵液的pH随发酵时间的变化Fig.5 Variation of pH in biogas slurry during fermentation
3 结论
发酵全过程通入适量的外源H2可以提高沼气产量,提纯效果更优,而过量的外源H2会导致产气量下降且提纯效果提高不明显。发酵初始阶段通入外源H2对CH4产量的影响比沼气产气的影响更大。其中外源H2通入量为3/5倍较适宜,沼气总产量和CH4总产量较高,高出对照组约21.1%、47.1%。同时提纯效果也较好,其平均CH4相对含量为83.5%,比对照组提高约32.1%。
厌氧发酵的初始阶段通入适量的外源H2,可以加强有机物转化,促进VFAs降解,过量的外源H2会导致VFAs降解抑制。外源H2通入量为3/5倍时,发酵结束的VFAs低于对照组最明显;外源H2通入量为4/5倍时,VFAs降解出现轻微抑制。另外,发现通入外源H2会导致发酵液的pH升高。

