罗非鱼性别相关微卫星标记的初步筛选
陈文伟,曹建萌,刘志刚,杨 娜,卢迈新
(1.中国水产科学研究院珠江水产研究所,农业农村部热带亚热带水产资源利用与养殖重点实验室,广州 510380;2.上海海洋大学水产与生命学院,上海 201306)
罗非鱼性成熟时间早,性成熟后产卵周期短,如果雌雄混养会因群体内自繁进而导致人工养殖的罗非鱼种群密度过大,规格参差不齐,极大降低了罗非鱼的经济效益,并且罗非鱼雄鱼比雌鱼更具生长优势,因此目前罗非鱼的商业化生产往往依赖雄性的单性养殖。现已有许多方法可控制罗非鱼雄性化[1-6],但在实际生产过程中都有一定的局限性[7]。
微卫星标记具有多态性高、杂合度大、容易扩增与检测等优势,被广泛应用于遗传图谱的构建、亲子鉴定、遗传多样性分析、动物经济性状的连锁分析等,罗非鱼性别相关微卫星标记的开发已有大量研究。Lee等[8]利用UNH995与UNH104(189 bp等位基因与Y染色体连锁)正确地推测了两个尼罗罗非鱼(Oreochromisniloticus)家系中95%的雄性和雌性个体的性别,利用GM354(129 bp雄性独有)、UNH168、GM271(121 bp雄性独有)和UNH131(193 bp等位基因与Z染色体连锁,187 bp的等位基因与W染色体连锁)正确地推测了一个奥利亚罗非鱼(O.aureus)家系中97%雄性和85%雌性个体的性别[9]。Khan等[10]发现UNH995与一个尼罗罗非鱼家系(HRT26)的性别显著相关。张庭等[11]在筛选奥利亚罗非鱼微卫星位点时发现UNH168在奥利亚罗非鱼家系的雌性个体中可扩增出135 bp和171 bp两个条带,而在该家系雄性个体中只有171 bp一个条带。根据目前的研究,尼罗罗非鱼的性别决定区域定位于连锁群(Linkage group,LG)1和LG23上[8,12-15],而奥利亚罗非鱼的性别决定区域定位于LG1和LG3上[9,16]。本研究拟通过对不同罗非鱼群体遗传多样性的分析,以及对两个尼罗罗非鱼群体和两个奥利亚罗非鱼群体性别相关微卫星标记的筛选和分析,以期为今后罗非鱼育种以及罗非鱼遗传性别的鉴定提供基础资料。
1 材料和方法
1.1 罗非鱼来源及基因组DNA提取
实验鱼详细信息见表1,本实验所用实验鱼均为混合群体。剪取所有实验鱼尾鳍,浸泡在无水乙醇中于-20 ℃保存备用。使用DNeasy Blood & Tissue Kit试剂盒(购自北京柏奥易思生物科技公司)提取基因组DNA,1.5%琼脂糖凝胶电泳检测DNA的质量,微量分光光度计(OSE-260,购自北京天根生化科技公司)检测DNA的浓度及纯度;用ddH2O将基因组DNA稀释至终浓度为50 ng/μL,置于-20 ℃保存备用。
1.2 PCR扩增及产物检测
1.2.1 两个尼罗罗非鱼群体及两个奥利亚罗非鱼群体性别相关微卫星标记的初步筛选
参考罗非鱼微卫星遗传图谱,从LG1、LG3及LG23上选择24个微卫星位点,从GenBank上下载这些微卫星位点引物序列 ,并由金唯智生物科技公司合成,引物详细信息见表2。对每对引物的扩增条件进行优化后,在两个尼罗罗非鱼群体及两个奥利亚罗非鱼群体中进行初步扩增,PCR反应体系为20 μL,包括:50 ng/μL DNA模板1 μL,10 μmol/L上、下游引物各0.4 μL,2×EasyTaq PCR SuperMix for PAGE 10 μL,ddH2O 8.2 μL。PCR热循环程序为:94 ℃预变性3 min,94 ℃变性30 s,X ℃退火30 s,72 ℃延伸30 s,循环数为25~28个,最后72 ℃终延伸5 min,4 ℃保存。PCR产物经12%非变性聚丙烯酰胺凝胶电泳分离,产物上样量为5 μL,50 bp ladder上样量为3 μL,电泳缓冲液为1×TBE。先使用50 V低电压电泳30 min,再使用150 V电压电泳150 min。银染参考许绍斌等[17]的方法并适当调整,同一位点等位基因由大到小记为A、B、C…。统计各微卫星位点的等位基因种类和数目,并在所选样本内部雌雄群体之间进行卡方检验,初步筛选跟性别相关的微卫星标记。
1.2.2 初步筛选的微卫星标记在各群体中的扩增验证
在两个尼罗罗非鱼群体与两个奥利亚罗非鱼群体中初步筛选到与性别相关的微卫星标记后,在这些微卫星标记上游引物的5′端添加不同颜色的荧光标记序列(FAM,HEX),统一在全部群体中进行扩增,扩增采用降落PCR,PCR反应体系为10 μL,包括:50 ng/μL DNA模板1 μL,10 μmol/L上、下游引物各0.5 μL,2×Taq PCR Master Mix 5 μL,ddH2O 3 μL。PCR扩增程序为:95 ℃预变性5 min,95 ℃变性30 s,62~52 ℃退火30 s,72 ℃延伸30 s,共进行10个循环,每个循环退火温度降低1 ℃;之后95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,共进行22~25个循环,最后72 ℃末端延伸20 min后,4 ℃保存。带荧光的PCR产物经DNA测序仪ABI 3730xl进行荧光电泳检测,并使用软件GeneMarker V2.2.0 对原始数据进行条带分型。统计所有群体的各项遗传多样性参数,并进行聚类分析,统计各微卫星位点的等位基因种类和数目,并在两个尼罗罗非鱼及两个奥利亚罗非鱼群体内部雌雄之间进行卡方检验,进一步筛选跟性别相关的微卫星标记。
1.3 数据分析
用软件Popgone32和GenAlEx 6.50计算各微卫星位点的观测等位基因数(Ne)、有效等位基因数(Na)、观测杂合度(Ho)、期望杂合度(He)、香农信息指数(I)、Nei’s遗传距离和遗传一致度,并检验各位点各群体是否偏离哈代温伯格定律,用软件PIC-CALC以及Cervus计算各位点的多态信息含量(PIC),用POPTREE软件对各群体进行NJ聚类分析。
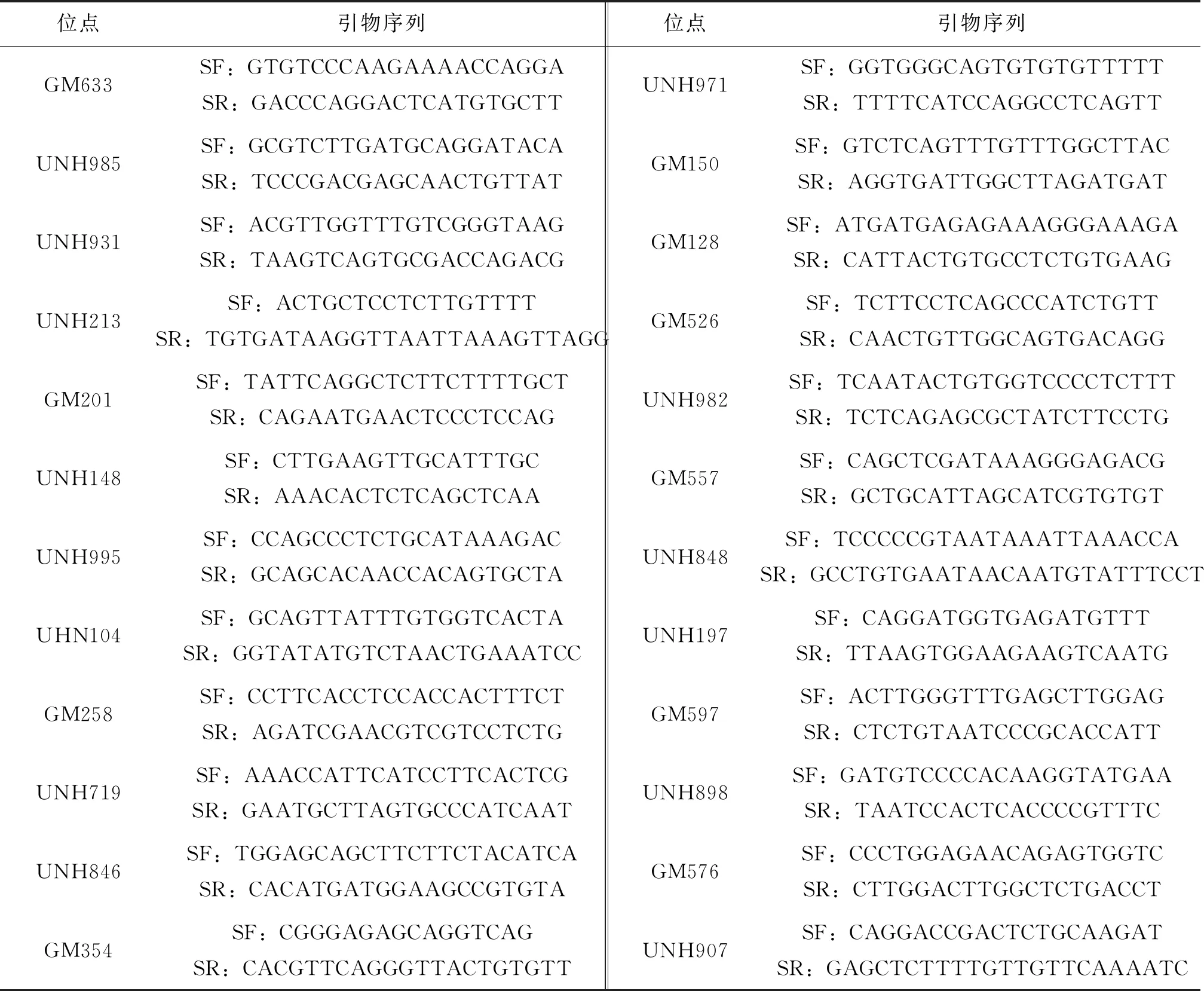
表2 24对微卫星引物信息Tab.2 Information of 24 pairs of microsatellite primers
2 结果与分析
2.1 两个尼罗罗非鱼群体及两个奥利亚罗非鱼群体性别相关微卫星标记的初步筛选结果与分析
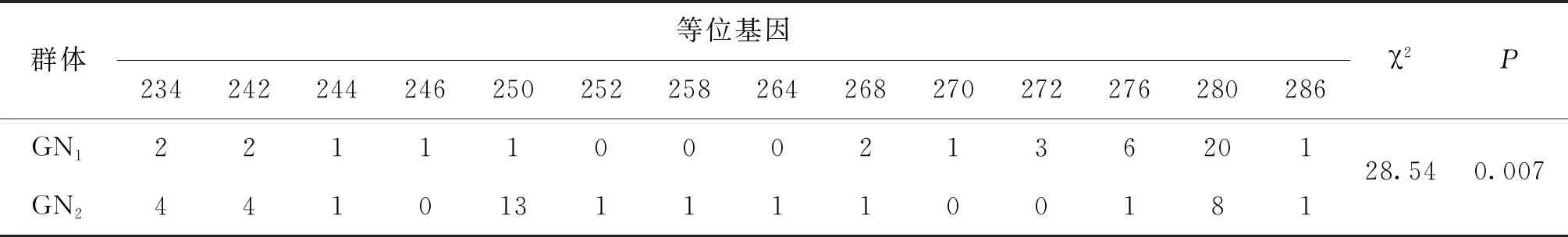
将24个微卫星标记在WN1、WN2、GN1、GN2、WO1、WO2、PO1以及PO2群体中扩增,利用Popgene32软件统计各微卫星位点的等位基因种类和数目,并在所有罗非鱼样本群体内部雌雄群体之间进行卡方检验,最终筛选到UNH931、GM128、GM201、GM258、GM597以及UNH898共6个与性别相关的微卫星标记。在无锡尼罗罗非鱼群体(WN1,WN2)中,UNH898与性别显著相关(P<0.05),GM597与性别极显著相关(P<0.01)。在高要尼罗罗非鱼群体(GN1,GN2)中,UNH931与性别显著相关,GM597、UNH898、GM128与性别极显著相关。在无锡奥利亚罗非鱼群体(WO1,WO2)中,GM201与性别显著相关。在番禺奥利亚罗非鱼群体(PO1,PO2)中,GM258、GM597与性别显著相关,详细结果见表3。
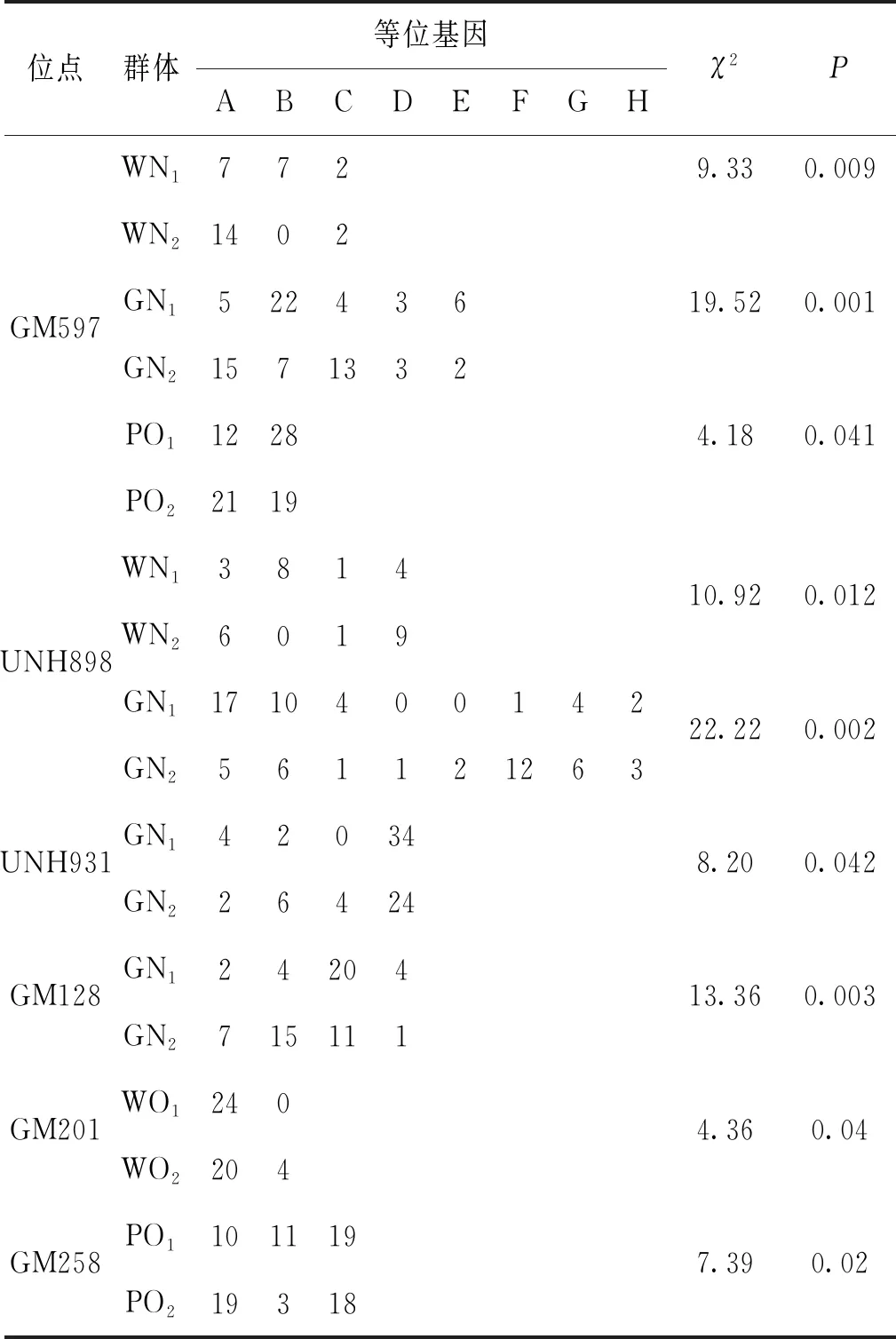
表3 两个尼罗罗非鱼群体及两个奥利亚罗非鱼群体性别相关微卫星标记统计Tab.3 Statistics of sex-related microsatellite markers of two O.niloticus populations and two O.aureus populations
2.2 初步筛选到的性别相关微卫星标记在不同养殖群体中的扩增结果与分析
2.2.1 微卫星扩增结果
将初步筛选到的6个跟性别相关的微卫星标记在全部群体中扩增,均可得到相应的产物。6个微卫星标记在所有群体297个样本中共检测到95个等位基因,其大小在97~302 bp之间,各位点在各群体等位基因数在1~13个之间。
2.2.2 群体遗传多样性参数统计
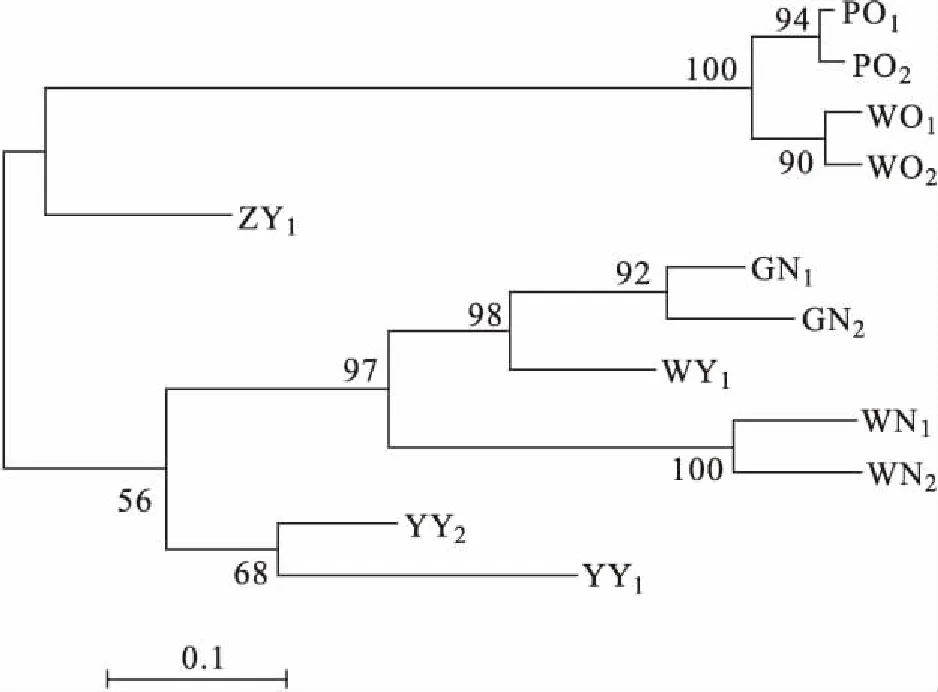
各群体平均观测等位基因数为2.167~9.333,平均有效等位基因数为1.624~4.966,平均观测杂合度为0.324~0.983,平均期望杂合度为0.329~0.782,平均多态信息含量为0.275~0.753。YY1群体多态性最低,WY群体多态性最高,WN1、WN2、GN1、GN2、WY1以及YY2群体达到高度多态(PIC>0.5),WO1、WO2、PO1、PO2、ZY1以及YY1群体为中度多态(0.25 表4 所有罗非鱼群体的平均遗传多样性参数Tab.4 Average genetic diversity parameters for all tilapia populations 2.2.3 遗传距离、遗传一致度以及聚类分析 YY1群体与WO1群体间遗传距离最大(5.404),遗传一致度最小(0.005),因此两者亲缘关系最远。WO2群体与WO1群体之间遗传距离最小(0.029),遗传一致度最大(0.972),因此两者亲缘关系最近。无锡尼罗罗非鱼群体(WN1,WN2)、高要尼罗罗非鱼群体(GN1,GN2)、无锡奥利亚罗非鱼群体(WO1,WO2)以及番禺奥利亚罗非鱼群体(PO1,PO2)内雌雄之间遗传距离较小,遗传一致度较大,说明这些群体雌雄之间分化程度不高,详细结果见表5。根据群体间Nei’s遗传距离用NJ法得到聚类图,所有群体聚为两大支:WO1、WO2、PO1、PO2以及ZY1群体聚为一支,GN1、GN2、WY1、WN1、WN2、YY1以及YY2群体聚为另一支,见图1。 表5 所有罗非鱼群体之间的遗传距离及遗传一致度Tab.5 Genetic distance and genetic similarity coefficient among all tilapia populations 注:对角线以上为遗传一致度,对角线以下为遗传距离。 图1 所有罗非鱼群体的聚类分析图Fig.1 Cluster dendrogram of all tilapia populations 2.2.4性别相关微卫星位点的筛选 将初步筛选到的6个与性别相关的微卫星标记进一步在12个群体中扩增验证后发现:GM597与无锡尼罗罗非鱼群体(WN1,WN2)、高要尼罗罗非鱼群体(GN1,GN2)以及番禺奥利亚罗非鱼群体(PO1,PO2)的性别显著相关(P<0.05),鉴别率(鉴别率=群体内可准确鉴定性别的个体数/群体内个体总数×100%)分别为39.1%、60.5%与7.5%;UNH898与高要尼罗罗非鱼群体(GN1,GN2)的性别极显著相关(P<0.01),鉴别率为71.1%。将GM597与UNH898联合分析可100%鉴定两个尼罗罗非鱼群体的性别。将GM597与GM258在无锡奥利亚罗非鱼群体和番禺奥利亚罗非鱼群体中联合分析,两个群体的雌雄鉴别率分别为33.3%和40.0%。YY1群体中UNH898的基因型与无锡尼罗罗非鱼群体及高要尼罗罗非鱼群体均不相同,利用UNH898可以100%将YY1群体与两个尼罗罗非鱼群体区分开,部分结果见表6~8。 表4和表5列出了各个罗非鱼群体的遗传参数,无锡尼罗、高要尼罗、无锡奥利亚以及番禺奥利亚各个群体内部雌、雄之间各项遗传参数(Na、Ne、Ho、He、I、PIC)差别不大,表明这些群体内部雌雄之间遗传多样性基本相同。无锡尼罗、高要尼罗、无锡奥利亚以及番禺奥利亚各个群体内部雌、雄之间的遗传距离(0.029~0.198)相对较小,遗传一致度相对较大(0.820~0.972),表明这些群体内部雌雄之间基因组差异较小。董在杰等[18]利用RAPD技术对尼罗罗非鱼和奥利亚罗非鱼雌、雄群体进行分析,结果表明,奥利亚罗非鱼雌雄群体的遗传多样性程度接近,而尼罗罗非鱼雄性群体的遗传多样性要比雌性群体丰富,遗传变异比雌性群体大,本研究中两个奥利亚罗非鱼群体的结果与之一致,而两个尼罗罗非鱼群体内雌、雄之间的遗传多样性并无明显差异,一方面可能是群体差异性导致的,另一方面可能是本研究所选标记数较少的原因。无锡尼罗与高要尼罗雌雄群体的平均多态信息含量均达到了高度多态(0.580~0.729),说明两个尼罗罗非鱼群体的遗传多样性较高,这一结果与宋红梅等[19]在构建罗非鱼DNA遗传图谱时得到的三个尼罗罗非鱼群体平均多态信息含量为0.608(达到高度多态)的结果相差不大,高于袁文华等[20]在奥尼罗非鱼及其亲本的微卫星分析中尼罗群体的平均多态信息含量(0.469)。无锡奥利亚与番禺奥利亚雌雄群体的平均多态信息含量均为中度多态(0.307~0.354),说明两个奥利亚罗非鱼群体的遗传多样性中度偏低,这一结果略高于张庭等[21]对四个奥利亚群体进行微卫星分析时得到的4个群体的平均多态信息含量为0.276(达到中度多态)的结果。同种罗非鱼不同群体间多态信息含量的差别可能是不同选育群体之间的遗传差异性导致的。ZY1、WY1、YY1以及YY2型罗非鱼是经过激素诱导以及种内和种间杂交后得到的罗非鱼,目前微卫星标记在这些群体中研究较少,WY1以及YY2群体的平均多态信息含量分别为0.753和0.528(达到高度多态),说明这两个群体遗传多样性较高,ZY1以及YY1型罗非鱼的平均多态信息含量分别为0.486和0.275(达到中度多态),说明这两个群体遗传多样性适中。刘志刚等[22]在利用线粒体DNA构建罗非鱼“粤闽1 号” 及其繁育群体的NJ 系统进化树时发现YY1与YY2群体并没有聚为一支,而在本研究中YY1与YY2群体在聚类分析中聚为一支,这一结果可能是线粒体DNA只能通过母系遗传而微卫星DNA可通过父系及母系共同遗传的差异导致的。 表6 GM597与罗非鱼性别的关联分析Tab.6 Sex-related analysis between GM597 and tilapia 表7 UNH898与罗非鱼性别的关联分析Tab.7 Sex-related analysis between UNH898 and tilapia 表8 GM597与UNH898在两个尼罗罗非鱼群体中雌雄鉴别率统计Tab.8 Statistics on male and female identification rates of GM597 and UNH898 in two O.niloticus populations 本实验采用两种实验方案对两个尼罗罗非鱼以及两个奥利亚罗非鱼群体进行性别相关微卫星标记的筛选。第一种实验方案采用常规PCR扩增微卫星位点,12%非变性聚丙烯酰胺凝胶电泳分离,筛选到与性别相关的标记较多。第二种实验方案采用降落PCR扩增微卫星位点,毛细管电泳分离,筛选到与性别相关的标记较少。造成这一差异的原因有两个方面:一方面由于所扩增的微卫星位点多态性较高,等位基因较为丰富,大量等位基因只相差2 bp,造成基因分型存在不同程度的误差,另一方面传统的PCR和聚丙烯酰胺凝胶电泳相较于降落PCR和毛细管电泳在实际操作过程中不可控的因素更多,误差更大。 采用两种实验方案均发现GM597与无锡尼罗罗非鱼群体(WN1,WN2)、高要尼罗罗非鱼群体(GN1,GN2)以及番禺奥利亚罗非鱼群体的性别显著相关(P<0.05),UNH898与高要尼罗罗非鱼群体(GN1,GN2)的性别极显著相关(P<0.01)。将GM597与UNH898联合分析可100%鉴定两个尼罗罗非鱼群体的性别,利用UNH898可以100%将YY1群体与两个尼罗罗非鱼群体区分开。Eshel等[13,14]研究发现位于LG23内 Scaffold 101上长度为1.5 Mbp的区域是尼罗罗非鱼的一个性别决定区域,UNH898与一个尼罗罗非鱼家系的性别极显著相关,其276 bp的等位基因是雄性个体的一个标记。本研究中筛选到的微卫星标记GM597与UNH898位于该性别决定区域内,因此GM597与UNH898可作为筛选YY1超雄鱼的候选标记。Sun等[15]筛选到一个与尼罗罗非鱼性别相关的AFLP标记SCAR-5位于上述性别决定区域附近,后续可以在该区域附近开发多种类型的分子标记应用到尼罗罗非鱼的性别鉴定过程中。目前的研究显示奥利亚罗非鱼的性别决定区域位于LG1与LG3上[9,16],本研究发现位于LG23上的GM597与番禺奥利亚罗非鱼群体(PO1,PO2)的性别显著相关(P<0.05),但其雌雄鉴别率只有7.5%,将GM597与GM258在无锡奥利亚罗非鱼群体(WO1,WO2)和番禺奥利亚罗非鱼群体(PO1,PO2)中联合分析,两个群体的雌雄鉴别率分别为33.3%和40.0%,均低于50%,可能是样本量少的原因,导致结果存在一定误差。与Lee等[8,9]的研究结果相比本实验中并没有检测到UNH995和UNH104与尼罗罗非鱼群体的性别相关,也没有检测到GM354与奥利亚罗非鱼群体的性别相关,这可能是由于不同选育群体之间的遗传差异性导致的,此外本实验筛选到的与罗非鱼性别相关的微卫星标记数量较少,可能与选取的引物数量相对较少有关,后续可以开发多种性别相关的分子标记,应用到罗非鱼的性别鉴定过程中。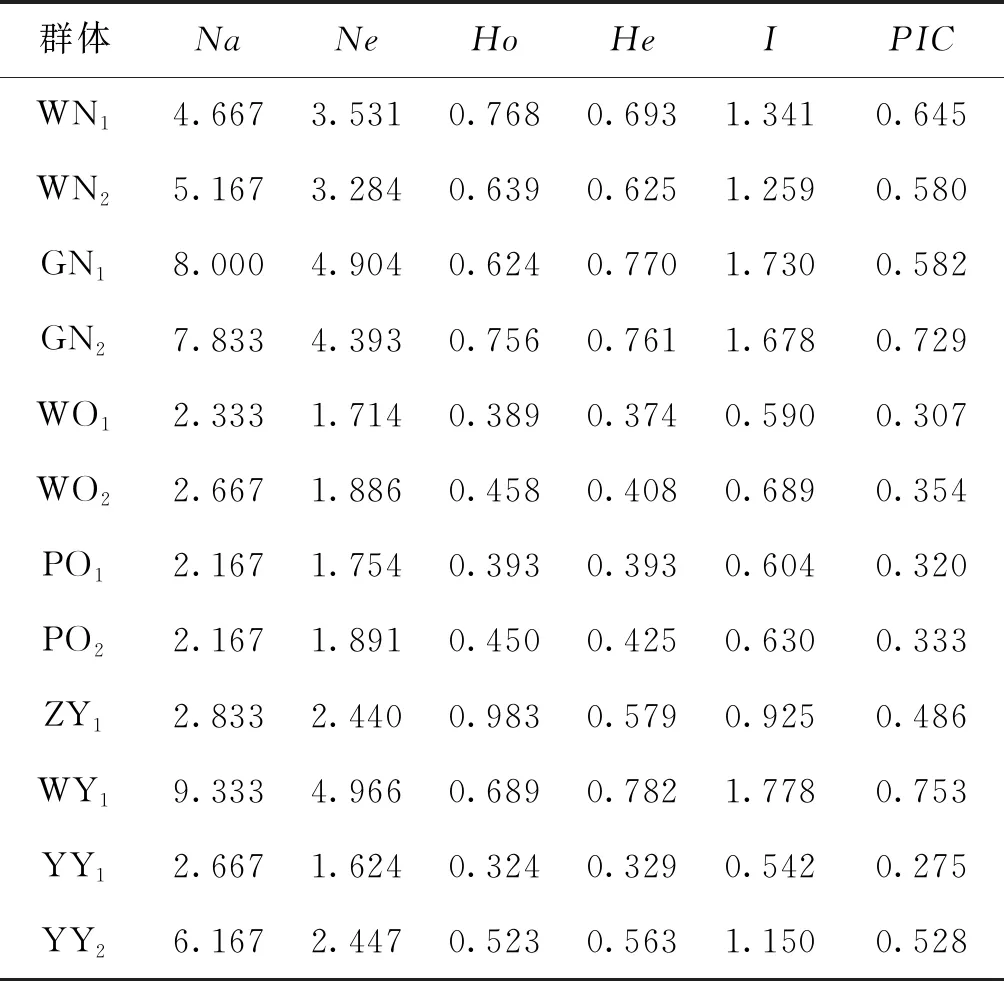

3 讨论
3.1 群体内以及群体间的遗传差异


3.2 性别相关微卫星标记的分析

