鲁卡因调节TRAIL基因抑制宫颈癌细胞增殖和诱导细胞凋亡的机制研究
金翠红, 刘淑娟, 静金艳
(1.河北省滦平县中医院, 河北 滦平 068250 2.河北省承德市妇幼保健院, 河北 承德 067000)
宫颈癌是女性生殖系统最常见的恶性肿瘤,发病率及死亡率高,而晚期宫颈癌易发生远处转移,侵袭性、淋巴转移率高,预后较差[1]。在治疗过程中抑制肿瘤细胞增殖,促进凋亡是治疗肿瘤的关键。普鲁卡因是一种常见的麻醉药物,近年来研究发现其还有抗肿瘤作用,如普鲁卡因对胃癌细胞具有生长抑制和凋亡诱导作用[2]。普鲁卡因还可抑制人类白血病细胞的生长[3]。肿瘤坏死因子相关的凋亡诱导配体(tumor necrosis factor related apoptosis-inducingand,TRAIL)是肿瘤坏死因子超家族成员,可诱导肿瘤细胞凋亡,临床上是极具潜能的抗肿瘤药物[4]。研究发现TRAIL能够诱导人前列腺癌细胞株PC-3细胞凋亡而不损伤正常细胞[5]。但普鲁卡因和TRAIL对宫颈癌细胞增殖和凋亡的影响还尚未清楚,本实验旨在研究普鲁卡因和TRAIL对宫颈癌细胞增殖和凋亡的影响及普鲁卡因是否通过TRAIL影响宫颈癌细胞的增殖、凋亡。
1 材料与方法
1.1材料:宫颈癌细胞SiHa购自中国科学院上海细胞库;胎牛血清、RPMI-1640培养基、胰蛋白酶购自美国Gibico公司;普鲁卡因购自福州海王福药制药有限公司;Lipofectamine TM 2000购自Sigma公司;Trizol试剂、反转录试剂盒、荧光定量试剂盒购自日本TaKaRa公司;MTT试剂盒、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙锭(PI)试剂盒、BCA试剂盒、RIPA蛋白裂解液、SDS-PAGE试剂盒购自上海碧云天生物技术有限公司;抗体购自上海煊翎生物科技有限公司;载体质粒均由金瑞斯生物科技公司构建。
1.2方 法
1.2.1细胞培养:宫颈癌细胞SiHa用含10%胎牛血清的RPMI-1640培养基于37℃、5%CO2饱和湿度条件下培养,2d换液一次,待细胞融合至80%左右时,加入胰蛋白酶进行消化传代,选取对数生长期的细胞进行实验。
1.2.2药物处理与分组:当细胞融合至80%左右时,将细胞传代接种至96孔板中,并用不同浓度的普鲁卡因(0.0 mM/L、0.5 mM/L、1 mM/L、2 mM/L)处理SiHa细胞,实验分为普鲁卡因0.0 mM/L组、普鲁卡因0.5 mM/L组、普鲁卡因1 mM/L组、普鲁卡因2 mM/L组。将pcDNA、pcDNA-TRAIL转染至SiHa细胞,记为pcDNA组、pcDNA-TRAIL组;将si-NC、si-TRAIL转染至SiHa细胞后用2mM/L的普鲁卡因处理,分别记为普鲁卡因2mM/L+si-NC组、普鲁卡因2mM/L+si-TRAIL组,转染均采用Lipofectamine TM 2000转染试剂盒。
1.2.3MTT检测细胞增殖:在各组细胞培养至48h时加入20μL(5g/L)的MTT溶液,继续孵育4h;弃去多余培养基并加入150μL DMSO振荡反应10min,酶标仪检测490 nm处吸光度(OD)值。细胞增殖抑制率(%)=1-实验组OD值/空白对照组OD值×100%。每组重复3次。
1.2.4流式细胞术检测细胞凋亡:用不含EDTA的胰酶消化各组细胞,离心收集细胞,PBS漂洗2次,加结合缓冲液重悬细胞。依据试剂盒说明书,先后加入Annexin V-FITC和PI避光孵育。流式细胞仪检测激发波长488 nm和发射波长530 nm处的荧光强度。实验重复3次。
1.2.5qRT-PCR检测TRAIL mRNA的表达水平:收集不同浓度普鲁卡因处理组细胞,研磨充分后加入Trizol试剂提取总RNA,微量核酸测定仪检测RNA纯度和浓度。使用TaKaRa反转录试剂盒将RNA反转录成cDNA,按照TaKaRa 荧光定量试剂盒使用说明配制反应体系,以β-actin为内参进行PCR扩增,每个样品重复3次,循环条件为95℃ 30s,60℃ 30s;72℃ 30s,共40个循环;60 ℃延长5min。相对表达量采用2-△△Ct法计算。
1.2.6Western blot检测蛋白表达:收集各组细胞,加入RIPA裂解液裂解,4℃,12000 g离心15 min,收集蛋白上清液,BCA试剂盒测定蛋白浓度。将蛋白样品进行SDS-PAGE电泳后转至PVDF膜上,5%脱脂奶粉封闭液室温封闭1h。分别加入一抗(1:1000),4℃孵育过夜,TBST洗膜;加入二抗(1:2000)室温孵育2h,TBST洗涤3次,每次10min,后在暗室中曝光显影,再浸入定影,最后洗去残液晾干,将胶片用Quantity One凝胶分析软件处理,测定各组蛋白条带的吸光度,以目的条带和GAPDH条带的比值作为蛋白表达水平。每个蛋白样品重复3次。

2 结 果
2.1普鲁卡因对宫颈癌SiHa细胞增殖、凋亡的影响:Western Blot检测结果(图1A,表1)显示,与普鲁卡因0.0mM/L组相比,普鲁卡因0.5mM/L、1mM/L、2mM/L组宫颈癌SiHa细胞中CyclinD1、Bcl-2蛋白的表达水平逐渐显著降低,P21、Caspase-8、Bax蛋白的表达水平逐渐显著升高(P<0.05)。MTT法检测结果(表1)显示,与普鲁卡因0.0mM/L组相比,普鲁卡因0.5mM/L、1mM/L、2mM/L组宫颈癌SiHa细胞增殖抑制率逐渐显著升高,呈浓度依赖型(P<0.05)。流式细胞仪检测结果(图1B,表1)显示,与普鲁卡因0.0mM/L组相比,普鲁卡因0.5mM/L、1mM/L、2mM/L组宫颈癌SiHa细胞的凋亡率显著升高,呈浓度依赖型(P<0.05)。可见,普鲁卡因抑制宫颈癌SiHa细胞增殖、促进凋亡。A:增殖、凋亡相关蛋白表达;B:宫颈癌SiHa细胞的凋亡
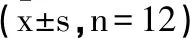
表1 普鲁卡因对宫颈癌SiHa细胞增殖的影响
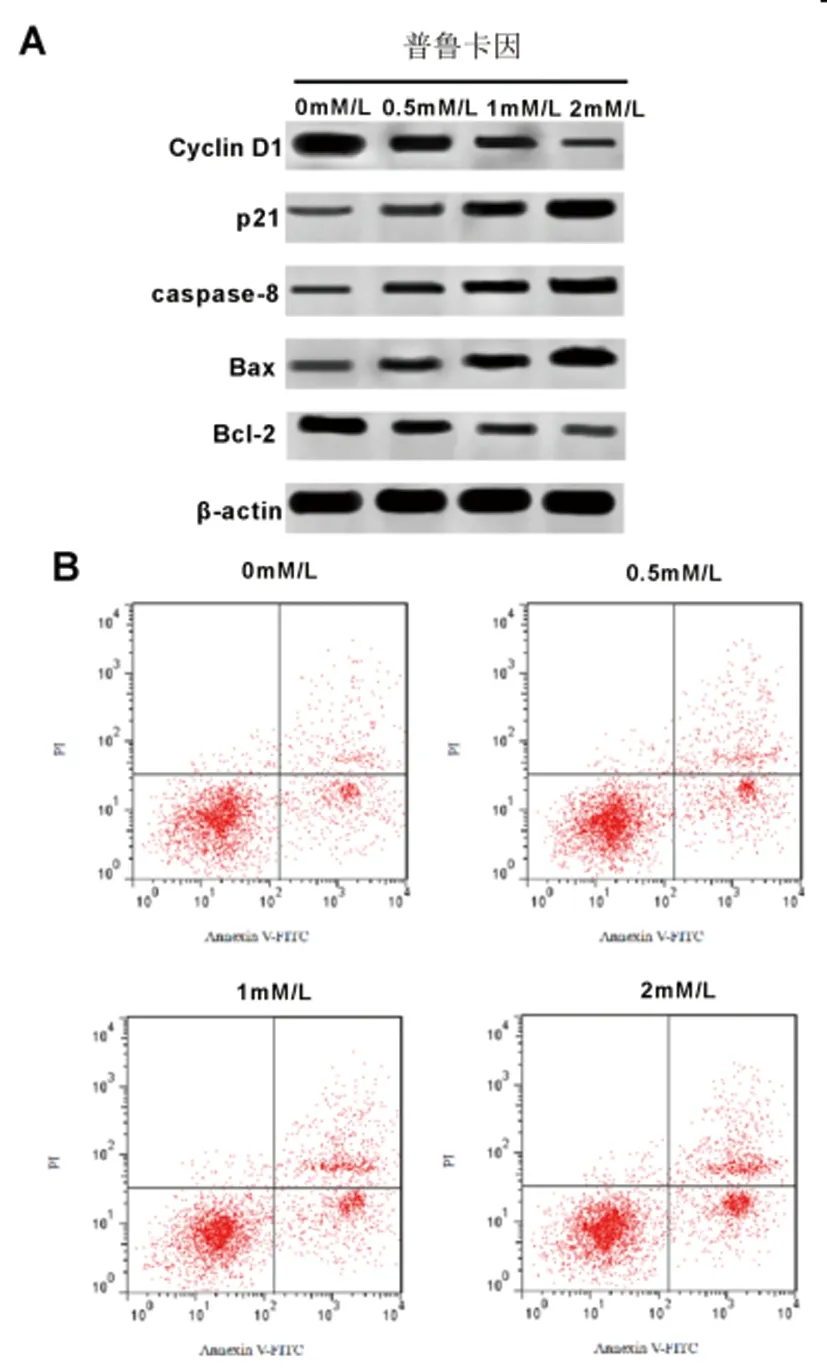
图1 普鲁卡因对宫颈癌SiHa细胞增殖、凋亡的影响
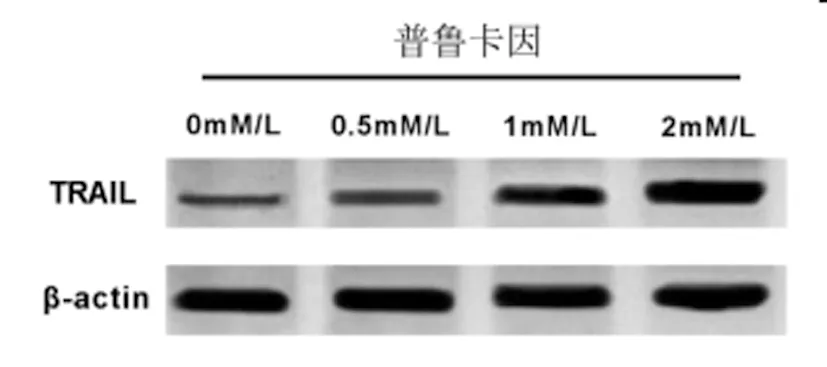
图2 TRAIL蛋白表达
2.2普鲁卡因对宫颈癌SiHa细胞中TRAIL表达的影响:qRT-PCR检测结果(表2)显示,与普鲁卡因0.0mM/L组相比,普鲁卡因0.5mM/L、1mM/L、2mM/L组宫颈癌SiHa细胞中TRAILmRNA的表达水平逐渐显著升高,呈浓度依赖型(P<0.05)。Western Blot检测结果(图2,表2)显示,与普鲁卡因 0.0mM/L组相比,普鲁卡因 0.5mM/L、1mM/L、2mM/L组宫颈癌SiHa细胞中TRAIL蛋白的表达水平逐渐显著升高,呈浓度依赖型(P<0.05)。可见,普鲁卡因促进宫颈癌SiHa细胞中TRAIL的表达。
表2 普鲁卡因对宫颈癌SiHa细胞中TRAIL表达的影响
2.3过表达TRAIL对宫颈癌SiHa细胞增殖的影响:Western Blot检测结果(图3,表3)显示,与pcDNA-NC组相比,pcDNA-TRAIL组宫颈癌SiHa细胞中CyclinD1蛋白的表达水平显著降低,P21蛋白的表达水平显著升高(P<0.05)。MTT法检测结果(表3)显示,与pcDNA-NC组相比,pcDNA-TRAIL组宫颈癌SiHa细胞增殖抑制率逐渐显著升高(P<0.05)。可见,过表达TRAIL抑制宫颈癌SiHa细胞增殖。

表3 过表达TRAI对宫颈癌SiHa细胞增殖的影响

表4 过表达TRAIL对宫颈癌SiHa细胞凋亡的影响
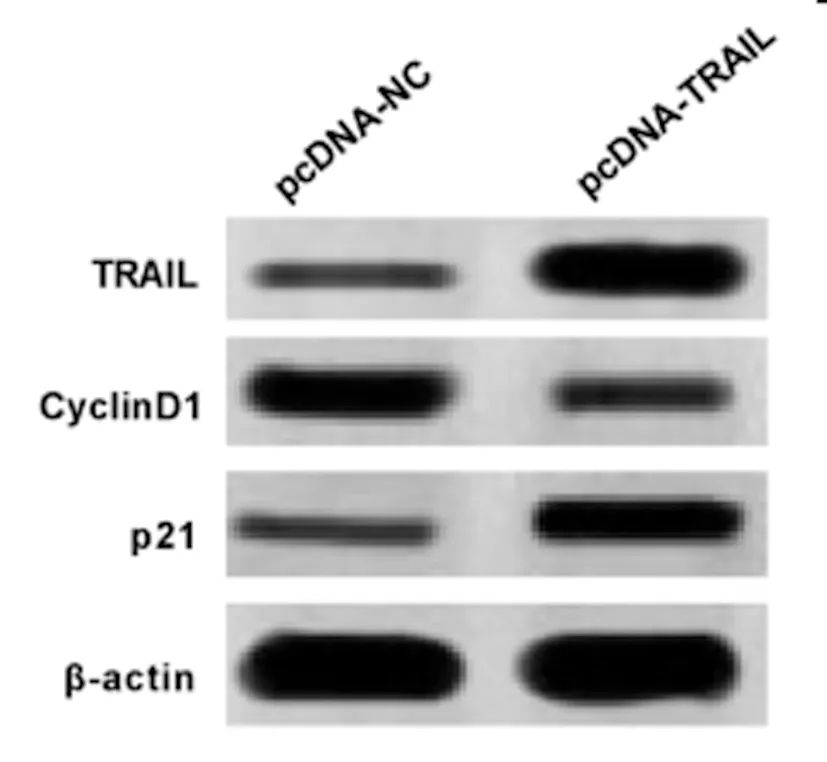
图3 TRAIL和增殖相关蛋白的表达
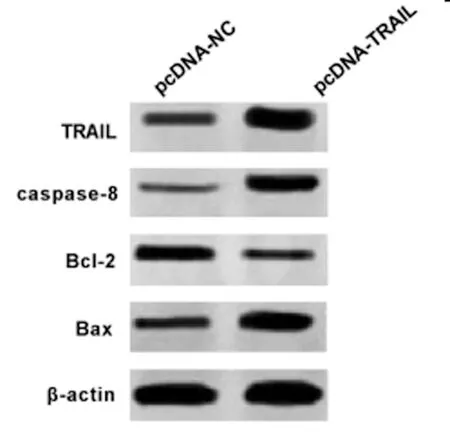
图4 TRAIL和凋亡相关蛋白的表达
2.4过表达TRAIL对宫颈癌SiHa细胞凋亡的影响:Western Blot检测结果(图4,表4)显示,与pcDNA-NC组相比,pcDNA-TRAIL组宫颈癌SiHa细胞中Bcl-2蛋白的表达水平显著降低,Caspase-8、Bax蛋白的表达水平显著升高(P<0.05)。流式细胞仪检测结果(表4)显示,与pcDNA-NC组相比,pcDNA-TRAIL组宫颈癌SiHa细胞的凋亡率显著升高(P<0.05)。可见,过表达TRAIL促进宫颈癌SiHa细胞凋亡。

图5 抑制TRAIL表达对宫颈癌SiHa细胞增殖、凋亡相关蛋白的影响
2.5抑制TRAIL逆转普鲁卡因抑制细胞增殖、促进细胞凋亡的作用:Western Blot检测结果(图5,表5,表6)显示,与普鲁卡因 0.0mM/L组相比,普鲁卡因 2mM/L组宫颈癌SiHa细胞中CyclinD1、Bcl-2蛋白的表达水平显著降低,P21、Caspase-8、Bax蛋白的表达水平显著升高;与普鲁卡因 2mM/L+si-NC组相比,普鲁卡因 2mM/L+si-TRAIL组宫颈癌SiHa细胞中CyclinD1、Bcl-2蛋白的表达水平显著升高,P21、Caspase-8、Bax蛋白的表达水平显著降低(P<0.05)。MTT法检测结果(表5)显示,与普鲁卡因 0.0mM/L组相比,普鲁卡因 2mM/L组宫颈癌SiHa细胞增殖抑制率显著升高;与普鲁卡因 2mM/L+si-NC组相比,普鲁卡因 2mM/L+si-TRAIL组宫颈癌SiHa细胞增殖抑制率显著降低(P<0.05)。流式细胞仪检测结果(表6)显示,与普鲁卡因 0.0mM/L组相比,普鲁卡因 2mM/L组宫颈癌SiHa细胞的凋亡率显著升高;与普鲁卡因 2mM/L+si-NC组相比,普鲁卡因 2mM/L+si-TRAIL组宫颈癌SiHa细胞的凋亡率显著降低(P<0.05)。可见,抑制TRAIL逆转了普鲁卡因抑制细胞增殖、促进细胞凋亡的作用。

表5 抑制TRAIL表达对宫颈癌SiHa细胞增殖的影响

表6 抑制TRAIL表达对宫颈癌SiHa细胞凋亡的影响
3 讨 论
宫颈癌严重地威胁广大女性生命健康,寻找多种有效治疗方法对治疗宫颈癌具有重要意义。研究发现普鲁卡因可抑制脂多糖诱导的结肠癌细胞肿瘤侵袭性行为[6]。普鲁卡因还可通过调节RhoA使ERK / MAPK / FAK通路失活来抑制结肠癌细胞的增殖和迁移[7]。盐酸普鲁卡因通过去ID4基因甲基化抑制白血病HL-60细胞增殖。本研究结果发现,普鲁卡因抑制CyclinD1、Bcl-2的表达,促进P21、Caspase-8、Bax的表达;抑制宫颈癌细胞SiHa的增殖,促进细胞凋亡;且还提高了TRAIL的表达水平。
TRAIL是一种凋亡分子,能与死亡受体特异性结合后选择性诱导癌细胞凋亡,在癌症的发生、发展和治疗方面扮演着重要的角色,是一种有潜力的抗肿瘤细胞因子[8]。研究发现TRAIL可明显抑制肿瘤生长,诱导黑色素瘤细胞凋亡[9]。TRAIL-R1的单克隆抗体通过激活caspase-8途径增强了TRAIL诱导的细胞凋亡[10]。阻止caspase-8激活可抑制TRAIL介导的癌细胞凋亡[11]。本研究发现,过表达TRAIL能促进Caspase-8蛋白的表达,抑制宫颈癌细胞SiHa的增殖,促进细胞凋亡,提示TRAIL通过Caspase-8途径影响了宫颈癌的凋亡。PI3K/mTOR双靶点抑制剂PI-103与TRAIL联合应用可使细胞周期停滞在S期,CyclinD1表达水平降低,抑制喉鳞癌细胞增殖。还有研究发现上调P21和TRAIL可抑制黑素瘤HTB-72细胞的生长。本实验结果显示,过表达TRAIL降低了CyclinD1蛋白的表达水平,提高了P21蛋白的表达水平[12]。提示,TRAIL可能通过影响CyclinD1和P21的表达水平影响细胞增殖。且本实验还发现抑制TRAIL表达逆转了普鲁卡因对宫颈癌细胞SiHa的增殖抑制和凋亡促进作用,提示普鲁卡因可能影响TRAIL表达影响宫颈癌的凋亡。
综上所述,普鲁卡因可抑制宫颈癌细胞SiHa的增殖,促进细胞凋亡,其机制可能与调控TRAIL有关。将可为宫颈癌的治疗提供新思路和新靶点。

