烟草开花期全基因组关联分析
孙滢 姜自鹏 刘洪泰 孙明铭 蒋彩虹 任民 刘旦 罗朝鹏 张剑锋 杨军 杨爱国 程立锐



摘要:烟草开花期影响烟叶的产量和品质,是决定生态适应性和产量的重要性状,与各种生物或非生物胁迫密切相关。研究烟草开花期的遗传规律,进而解析调控开花时间的分子基础,对烟草品种改良具有重要意义。本研究选用烟草MAGIC(Multiparent Advanced Generation Intercrossing)群体为材料,利用高密度烟草SNP(Single Nucleotide Polymorphism)芯片进行基因型分析,进而对开花期性状进行全基因组关联分析(Genome-Wide Association Study,GWAS)。结果表明,共检测到13个与烟草开花期性状显著关联位点,其中位于12号染色体109616410bp位置上的SNP为最显著关联位点。根据参考基因组,初步确定了控制开花期的关键候选基因Mab02790610,该基因与拟南芥控制开花的关键基因SOC高度同源,可能在控制烟草开花时间上起到关键作用。研究结果为进一步揭示烟草开花期遗传调控机制及育种改良奠定了基础。
关键词:单核苷酸多态性(SNP):全基因组关联分析(GWAS);烟草;开花期
烟草(Nicotiana tabacum L.)是我国重要的经济作物,在国民经济中具有十分重要的地位。作为茄科作物之一,其开花时间提前或延迟,不仅影响产品器官的产量和品质,还与各种生物或非生物胁迫密切相关。
开花期作为重要的烟草农艺性状,属于数量性状,遗传复杂,易受光周期、温度等环境影响。普通烟草的一个野生亲本林烟草为长日照植物,而另外一个野生亲本绒毛状烟草表现为短日照植物。其后代普通烟草大多数品种都为中性或者偏短日照。经典的遗传学研究表明,普通烟草的开花期受一对隐性基因控制。目前,关于烟草开花期遗传机制的报道,主要集中在控制开花的关键基因以及基因与环境互作上。FT、SOC(suppressor of overexpression of constans 1)、AGL24(gamouslike24)和LFY(e/)等都是成花过程中重要的调控基因,其中,FT是决定是否成花的最关键基因,最早在拟南芥晚花突体中发现。HARING等在烟草中鉴定到4个Fr同源基因FT、MF2、NF73和NFT4,并证明其只受短日照条件影响。SMYKAL等从烟草中克隆到SOC,过表达烟草会提前开花。李元元等克隆获得了MFLC全长序列,并分析了NC82品种移栽后不同时间进行低温处理该基因的表达特征,证明该基因与低温敏感、早花特性有关;白戈等从烟草中克隆了一个高度保守的MYB类启动子基因(NTMYB15),过表达该基因的烟草K326经低温胁迫出现晚花;杨永银等发现,低温会使抗坏血酸氧化酶(AO)表达水平增加,脱氢抗坏血酸(DHA)含量增加,而且DHA能诱导SOC1表达水平升高,使开花提前。
随着分子生物学技术的不断发展,在烟草上针对农艺、抗性和品质等重要性状,利用关联分析或连锁分析方法进行数量性状位点(QL)发掘和标记开发研究已有多篇报道131,但是有关烟草开花期的遗传定位研究报道很少。蔡长春等利用早花品种K326和迟花品种兴烟1号组合的D群体和遗传连锁图谱对烟草开花期进行了初步的遗传分析,检测到2个主效QL位点,表型变异贡献率分别为24.5%和17.3%。而针对烟草开花期的全基因组关联分析未见报道。
本研究利用8个不同类型烟草種质为亲本组配的MAGIC群体为材料,对烟草开花期性状进行全基因组关联分析,发掘与花期关联的SNP位点,预测候选基因,不仅为揭示烟草控制花期遗传机制提高烟草适应性提供理论基础,也为烟草广适性育种奠定基础。
1材料与方法
1供试材料与试验设计
1.1.1试验材料供试群体由本研究组配置
Beinhart1000-1、Florida301、Samsun、Basma、红花大金元、VAM、塘蓬和小花青等8个不同烟草类型种质的杂交组合,进而构建了基于有限亲本的高代互交系MAGIC群体(Multiparent Advanced Generation Inter-cross),群体材料有519个株系。
1.1.2试验地点2019年3月15日,在中国农业科学院烟草硏究所诸城试验基地种植8个亲本及MAGIC群体材料,行距60cm,株距为40cm,每材料种植1行10棵,2次重复。
1.2表型调查
以2019年3月15播种日期为T1,某株系内50%植株中心花开放的日期为T2,T2与T1之间间隔的天数即为该株系的开花期。
1.3MAGIC群体基因型鉴定
2019年8月18日针对8个亲本和MAGIC群体600个株系,选取株系内长势一致单株的鲜嫩叶片混合取样,利用DNA提取试剂盒提取DNA。应用高密度烟草SNP芯片(Gene Tian芯片,美国Affymetrix公司)对不同样品进行全基因组扫描。参照张剑锋等的方法略有调整,进行SNP芯片检测。并对Poly high resolution类型的位点数据进行相应处理和分析,共获得在亲本间具有多态性的高质量SNP位点124153个,用于群体基因型分析。
1.4全基因组关联分析
应用TASSEL5.0软件中的混合线性模型MLM(Mixed Linear Model)进行性状与标记之间的全基因组关联分析,以软件给出的p值作为显著关联的阈值。当标记的p≤0.0001时,则认为标记与性状之间存在关联。
2结果
2.1表型变异及SNP标记多态性
如图1所示,烟草开花期在亲本及群体中存在显著差异。亲本小花青和Samsun开花期较早,分别是132和133d;剩余6个亲本Basma、VAM、红花大金元、塘蓬、Beinhart1000-1、Florida301的开花时间很相近,分别在138、139、140、140、140.5、140.5d。供试群体开花期的最小值为124.5d,而最大值有152d,开花期的峰度和偏度的绝对值均小于1,说明开花期具有正态分布特征,呈现数量性状遗传特征。
2.2花期与SNP的全基因组关联分析(GWAS)
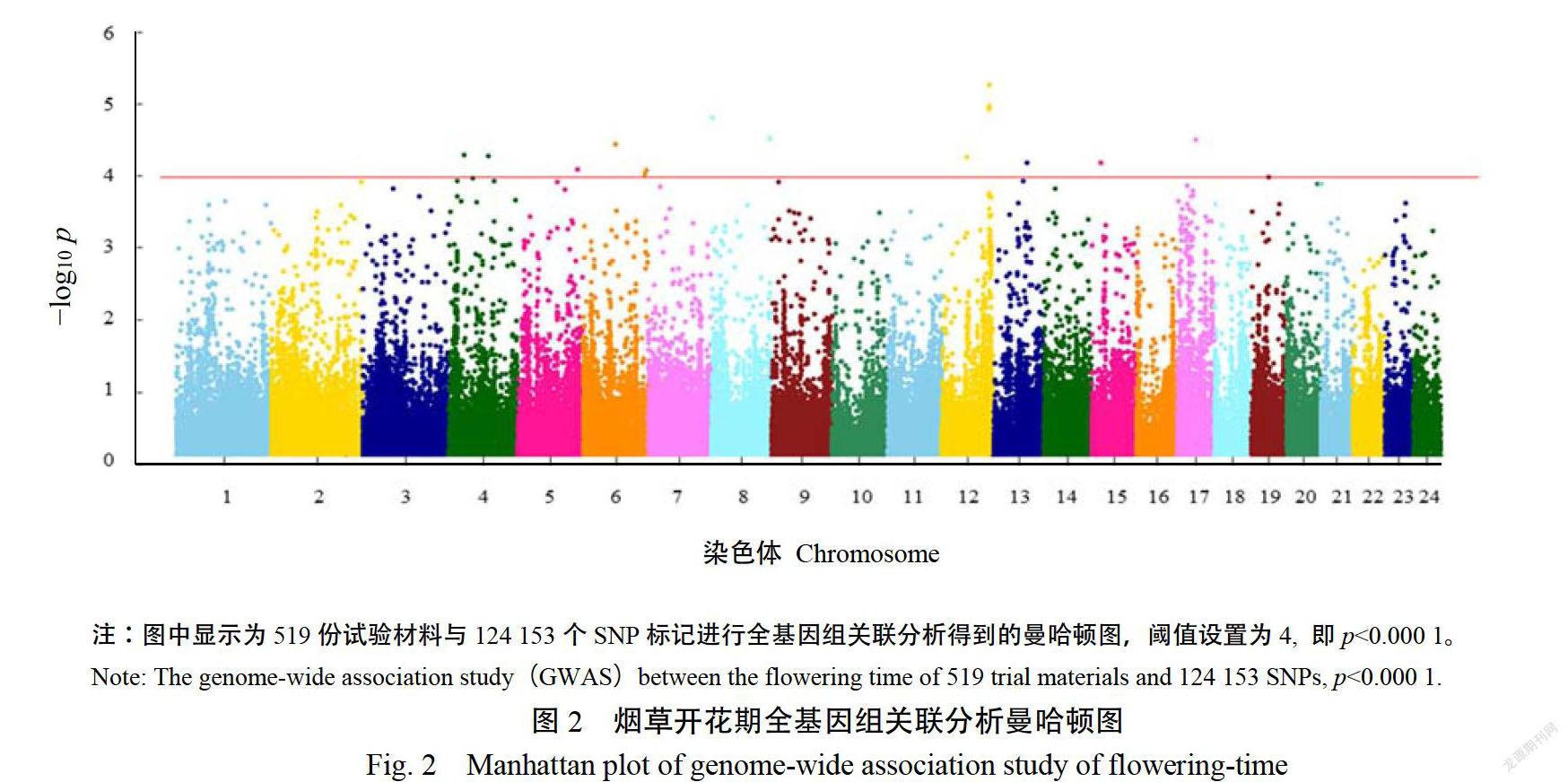
采用TASSELV5.0軟件MLM模型,对519份MAGIC群体材料进行开花期的全基因组关联分析,如图2、3所示。其中共检测到13个与开花期显著关联的位点p《000)(表1),分别位于烟草第4、5、6、8、12、13、15、17、19号染色体上,根据值排序,在烟草全基因组染色体上的物理位置分别为:12号染色体,109616410bp;8号染色体,2266918bp8号染色体,135192920bp;17号染色体,43342018bp6号染色体,74138868p:4号染色体,35423572bp:4号染色体,91394779bp2号染色体,57703873bp:13号染色体,76563713bp:15号染色体,21104329bp;5号染色体,138720068bp;6号染色体,146052300bp:19号染色体,40502891bp其中,4、6、8号染色体分别检测出2个显著性位点,12号染色体上109616410bp处的SNP位点显著性最高,p值为4.79;单个位点表型変异贡献率(R)范围为3.38~4.74%,其中最显著位点的表型贡献率为4.49%。
2.3预测候选基因
根据关联分析结果,位于12号染色体上的SNP位点AX-117626364最可能与开花期性状紧密关联。
因此,以QFT1上下500kb区间范围内进行候选基因筛选。如表2所示,目标区间内总共有19个编码基因,注释功能为细胞色素P450、突触结合、丝氨酸/苏氨酸蛋白激酶活性、羧酸酯酶活性MADS-box蛋白、溶血磷脂酰基转移酶、木质部丝氨酸蛋白酶、类草菌素蛋白酶、磷脂酶β1、过氧化物酶体生物发生蛋白等。其中Mab0279640和Mab0279620编码与拟南芥MADS-box转录因子功能相似蛋白,控制着花器官形成、发育等重要生理过程1Mab0279630、Mab02790610和Mab0279600与拟南芥(Arabidopsis thaliana)中的花卉整合子SOC1功能相似,调控上游CONSTANS基因(CO)影响开花时间2。其中Mab0279610距离最显著的SNP位点的物理距离仅为32.11kb,因此初步将其确定为控制烤烟开花期关键候选基因。
3讨论
3.1Magic群体
国际上早在2002年就已经提出包含有8个亲本的互交设计,又称为多亲本高世代互交(Multiparent Advanced Generation Inter-crossing,MAGIC)。2008年,CAVANAGEI等2向植物界引进了多亲本高代互交(Muli-parent advanced generation Inter-cross)群体,简称为MAGIC群体。
相比双亲群体和自然群体,MAGIC群体具有显著优势。本研究中以8个优质特色品种构建的烟草上第一套MAGIC群体,其中包含烤烟(红花大金元)、晾晒烟(小花青、塘蓬)、香料烟(Samsun、Basma)、雪茄烟(Beinhart1000-1、Florida301)和白肋烟(VAM)。与自然群体相比,MAGC群体没有群体结构问题,避免了关联分析结果出现假阳性。全基因组分析结果共有13个与花期显著相关的位点,群体遗传丰富性得到很好的体现参考烟草全基因功能注释,由最显著位点初步筛选到Mab0279610,该基因与拟南芥中控制开花关键基因SOC同源,也极大可能是控制烤烟开花时间的关键基因。由此看出,MAGIC群体的连续杂交,极大地提高了重组概率,加了定位的准确性。
结果表明,MAGIC群体相比双亲群体和自然群体,不仅在数量性状的关联分析及精细定位方面等具有极大的优势,而且群体规模越大,定位越准确。总而言之,由8个不同种质构建的MAGIC群体既可以弥补双亲群体重组发生有限、作图分辨率低的不足,又能控制群体结构,非常适合当前的遗传和育种研究,是理想的遗传和育种研究材料。
3.2SNP标记
单核苷酸多态性(Single Nucleotide Polymorphism,SNP)标记作为目前最具发展潜力的分子标记,包含有单碱基的转换、颠倒、插入及缺失等多种形式,在基因组中具有遗传稳定、数量多、分布广、易于检测等特点,适合于MAGIC群体的检测分析,满足全基因组关联分析对于大样本高密度标记的要求,可以大大提高关联分析的统计效率。
基于SNP标记的全基因组关联分析所定位的QTL,在MAS中可提高选择的目的性和准确性,进而提高育种效率,已成功应用于人类2、果蝇等2多种生物的遗传研究。但是在烟草中目前报道的关联分析研究大多采用SSR标记27-,分析群体的分子标记数目一般小于300个,如此少的标记数目很难实现全基因组分析。本研究利用高密度SNP芯片对MAGIC群体进行分析,总共获得了124153个多态性位点的基因型数据,多态性标记覆盖了烟草整个基因组,为开展烟草重要性状全基因组关联分析定了坚实的数据基础。
3.3SOCI
利用MAGIC群体和高密度SNP分子标记,我门对控制开花的关键位点进行了全基因组关联分析。研究结果表明,距离最显著的SNP位点32.113kb位置上有个与拟南芥SOC基因同源的基因。植 物经过长期的发育进化,形成了一套复杂而精细的基因调控网络,以确保植株能在最佳时间开花。MADS-box蛋白是一种转录调控因子,在控制植物开花时间、花器官形成等方面的信号转导过程中起着关键作用SOC1作为一个集成多个开花信号的整合子,已经被深入研究了十几年。SOC1作为一个MADS转录调控因子,在控制植物开花时间、花器官形成和分生组织特异性等方面的信号转导过程中起着关键作用,是构成花卉时序和花卉发育基础调控网络的主要枢纽。因此,根据我们的定位结果及候选基因分析,将Nab0279610初步确定为候选基因,相关功能验证正在开展中。
4结论
利用8个不同类型烟草种质为亲本构建了烟草MAGIC群体,结合124153個SNP标记,进行基因型分型结果和全基因组关联分析,共挖掘到10个与烟草花期相关联的位点(p《0.0001)。根据烟草全基因组数据库,初步将基因ab0279610确定为控制烤姻开花时间的关键候选基因,为进一步开展烟草开花期分子机制研究及分子育种奠定了基础。
参考文献
[1]张素芝,左建儒.拟南芥开花时间调控的研究进展[J].生物化学与生物物理进展,2006(4):301-309
[2]解敏敏,龚达平,孙榕,等.烟草成花素FT基因及其调控机制研究进展中国烟草科学,2018,39(3):98-102
[3]佟道儒.烟草育种学[M]北京:中国农业出版社,1997
[4] YOO S K, CHUNG K S, KIM J, et al. CONSTANS activates SUPPRESSOR OF OVEREXPRESSION OF CONSTANS I through FLOWERING LOCUS T to promote flowering inarabidopsisj Plant Physiology, 2005, 139(2): 770-778
[5] LEE J, OH M, PARK H, et al. SOCI translocated to the nucleus by interaction with AGL24 directly regulates leafy. Plant Journal2008,55(5):832-843
[5] TURCK F, FORNARA F, COUPLAND G, et al. Regulation and identity of florigen: flowering locus T moves center stage [J]. Annual eview of Plant Biology, 2008, 59: 573-594
[7] KOORNNEEF M, HANHART C J, VEEN JH, et al. A genetic and physiological analysis of late flowering mutants in Arabidopsis thaliana [J]. Molecular and General Genetics MGG, 1991, 229(1)
[8] HARIG L, BEINECKE F A, OLTMANNS J, et al. Proteins from the FLOWERING LOCUS T-like subclade of the PEBP family act antagonistically to regulate floral initiation in tobacco [J]. Plant ournal,2012,72(6):908-921
[9] SMYKAL P, GENNEN J, D et al. Flowering of hotoperiodic Nicotiana varieties in non-inductive conditions by transgenic approaches[J]. Plant Molecular Biology, 2007, 65(3)23-242
[10]李元元低温诱导烟草早花研究与烟草MADS-box基因的同源克隆[D]北京:中国农业科学院,2011
[11]白戈,杨大海,姚恒,等.烟草耐低温胁迫早花MB5的克隆及功能分析[J]分子植物育种,2018,16(1):3504-3508
[12]]杨永银,胞外脱氢抗坏血酸在低温诱导烟草早花过程中的参与机制[D]郑州:河南农业大学,2015
[13] DRAKE K, BAKAHER N, GOEPFERT S, et al. Multiple disease resistance loci affect soilborne disease resistance in tobacco (icotiana tabacum L.). Phytopathology, 2017, 107(9)1055-1061
[14]焦天雷.烟草(Nicotiana tabacum L.)赤星病抗性QL的定位分析[D]杭州:浙江大学,201
[15]牟建英,钱玉梅,任民,等烟草白粉病抗性基因的QL定位中国烟草学报,2013,19(4):105-108
[16]李茜.烟草遗传图谱构建与农艺性状和化学成分的QTL定位[D]北碚:西南大学,2015
[17]蔡长春,邓环,冯吉,等.烤烟生育期相关性状的初步遗传分析[J].中国烟草学报,2014,20(6):70-7
[18]张剑锋,罗朝鹏,何声宝,等.应用SNP标记分析24份烟草品种的遗传多样性[J].烟草科技,201750(11):1-8
[19]李元元,杨爱国,王鲁,等.烟草MADS-box家族基因保守片段的克隆与序列分析[J].中国烟草科学,201,32(3):21-27
[20]陆莹,刘艳华,任民,等.烟草CONSTANS同源基因的克隆与分析[J].中国烟草科学,2013,34(3):60-64.
[21] CAVANAGH C, MORELL M, MACKAY I, et al. From mutations to MAGIC: resources for gene discovery, validation and delivery in crop plants [J]. Current Opinion in Plant Biology, 2008, 11(2)215-221
[22] MARTIN W G, THOMAS A, MARION S, et al. SNP identification in crop plants [J]. Current Opinion in Plant Biology, 2009, 12(2)211-217
[23]陈秋玲,高建明,罗峰,等分子标记技术在禾本科作物基因定位上的研究进展[J]中国农学通报,2010,26(9):42-48CHENQL,GAOJM,
[24] PALAISA K A, MORGANTE M, WILLIAMS M, et al. Contrasting effects of selection on sequence diversity and linkage disequilibrium at two phytoene synthaseloc[J] The Plant Cell, 2003, 15(8)1795-1806.
[25] MICK E, MCGOUGH JJ, MIDDLETON F A, et al. Genome-wide association study of blood pressure response to methylphenidate treatment of attention-deficit/hyperactivity disorder[J]. Progress in Neuro-psychopharmacology and Biological Psychiatry, 2011, 35(2)466-472
[26] GERRARD D T, FRICKE C, EDWARD D A, et al. Genome-wide responses of female fruit flies subjected to divergent mating regimes. PLOS ONE, 2013, 8(6): e68136
[27]任民,张长静,蒋彩虹,等.基于高密度SSR连锁群的烟草致香物质关联分析[J]中国烟草学报,2014,20(4):88-93
[28]樊文强,孙鑫,杨爱国,等.基于关联分析发掘烟草高钾优异等位变异[J]中国烟草学报,2016,22(2):100-107
[29]童治军,陈学军,方敦煌,等.231份烤烟种质资源SSR标记遗传多样性及其与农艺性状和化学成分的关联分析[J]中国烟草学报,2017,23(5):31-61
[30]朱承广,任民,蒋彩虹,等以关联分析发掘烟草抗赤星病基因分子标记[J]中国烟草科学,2017,38(1):68-72
[31]姚琦园,李纷芬,张林成,等.植物MADS-bx转录因子参与调控非生物胁迫的研究进展[J].江西农业学报,2018,30(5):73-79YAOQY,LI
[32]陳娇.芥菜AGL24基因的启动子克隆与其互作因子SOC1遗传转化研究[D].北碚:西南大学,2016
[33] SIMPSON GG, DEAN C. Arabidopsis, the rosetta stone of flowering time?[J]. Science, 2002, 296(5566): 285-289

