Copan WASP全自动微生物前处理系统性能及其临床应用价值的评估
郑 恬,徐修礼,白 露,陈 潇,刘家云,郝晓柯
(空军军医大学第一附属医院检验科,西安 710032)
0 引言
随着电子科技和通信技术的进步以及成像技术在医学领域的应用[1-2],临床微生物检验自动化得到蓬勃的发展,微生物检验传统的手工接种方式发生了质的飞跃,为微生物检验发展创造了有利条件[3]。全自动微生物前处理系统在临床中的应用既降低了差错率,保证了生物安全,又提供了样本接种流程标准化的操作平台,降低了微生物检验人员的工作强度,使其摆脱重复、烦琐的操作,精于检验后流程的质量控制,确保结果数据的准确性及其可靠性[4-6]。当前,国内外研发了一批全自动微生物前处理系统,如意大利Copan公司的WASP、法国bioMerieux公司的PREVI®Isola、美国BD公司的Innova以及中国武汉迪艾斯科技有限公司的Diascie ProBact等[7-8],为临床微生物检验自动化奠定了坚实的基础[9]。我科于2014年在国内率先引进了Copan WASP全自动微生物前处理系统,经对系统参数的探讨、分析,设置优化样本处理方案,联接实验室信息系统(laboratory information system,LIS),利用条码识别对临床样本自动化接种,大大地提高了工作效率。然而,在临床应用中,如何正确使用仪器,以及如何应对ISO 15189对仪器性能评估的要求[10],目前报道较少。本文就我科使用的Copan WASP全自动微生物前处理系统的主要仪器的工作性能进行评估,并对临床样本分离培养效果与手工法(Manual)进行比较,探讨其在临床中的应用价值。
1 材料与方法
1.1 材料
1.1.1 样本来源
痰和中段尿标本各50份均采集自我院各病区。化脓链球菌ATCC19615、铜绿假单胞菌ATCC27853、金黄色葡萄球菌ATCC25923和大肠埃希菌ATCC 25922标准菌株购自卫生健康委员会临床检验中心。
1.1.2 仪器设备
Copan WASP全自动微生物前处理系统由意大利Copan公司生产,微生物鉴定分析系统Vitek-MS购自法国bioMerieux公司。
1.1.3 试剂耗材
痰消化剂Sputasol购自英国Oxoid公司,Copan12无菌痰管及挑痰棒购自意大利Copan公司,Vitek-MS基质液及靶板购自法国bio-Merieux公司,血琼脂平板、含万古霉素巧克力平板和麦康凯平板购自郑州安图生物工程有限公司。
1.2 方法
1.2.1 混合菌悬液配制
将化脓链球菌ATCC19615、铜绿假单胞菌ATCC27853、金黄色葡萄球菌ATCC25923、大肠埃希菌ATCC25922 4种标准菌株用无菌生理盐水配置为0.5标准麦氏浊度单菌悬液(1.5×108cfu/ml),并分别稀释成 1.0×107、1.0×106、1.0×105、1.0×104和 1.0×103cfu/ml系列单菌悬液,再按 1∶1、1∶1∶1 或 1∶1∶1∶1比例将单菌悬液配制为含2、3、4种菌株的不同浓度的混合菌悬液共16份,以评估前处理系统的性能。混合菌悬液配制方案见表1。

表1 混合菌悬液配制方案cfu/ml
1.2.2 样本处理、接种与培养
1.2.2.1 样本处理
使用挑痰棒挑取痰标本可疑部分,置于含1 ml痰消化剂的Copan12无菌痰管中,35~37℃孵育90 min,使痰液均质化,制成痰标本悬液;中段尿标本则倒入特定的无菌尿杯中,粘贴条码备用。
1.2.2.2 样本接种
仪器接种:痰标本采用4 Quadrants type 1模式四区划线;尿标本采用Single streak type 2模式连续划线;混合菌悬液采用4 Quadrants type 1模式四区划线。
手工接种:由同一位具有丰富工作经验、操作熟练的检验人员严格按照《全国临床检验操作规程》(第4版)接种步骤操作[11]。痰标本悬液使用无菌棉签蘸取并涂布于平板的第一区,再以接种环进行四区划线。痰标本接种于血琼脂平板、含万古霉素巧克力平板和麦康凯平板,尿液标本接种于血琼脂平板和麦康凯平板,混合菌悬液接种于单一的血琼脂平板,一式3份,且均使用1 μl接种环。
1.2.2.3 细菌培养
Copan WASP全自动微生物前处理系统由WASP接种划线模块和WASPLab孵育及镜像系统模块组成,两者通过轨道连接,经WASP接种划线模块接种完毕的平板直接运送入WASPLab孵育及镜像系统模块中进行培养、拍照。系统参数设置:痰标本和混合菌悬液的孵育环境为35℃、含5%CO2的二氧化碳孵箱,中段尿标本的孵育环境为35℃普通孵箱。手工法的培养环境同仪器法。
1.2.3 菌落鉴定
所有平板培养24 h后进行拍摄和菌落观察,当肉眼可见菌落生长时,挑取单个菌落均匀涂布于微生物鉴定系统Vitek-MS专用靶板,然后采用该仪器对菌落进行鉴定,并记录最终鉴定结果。
1.2.4 判读标准
中段尿及痰标本分别依定量方式与半定量方式判读。中段尿标本结果判读标准:菌落生长个数≤100,记为菌落个数 1.0×103cfu/ml;菌落生长个数>100,记为菌落个数>1.0×105cfu/ml。痰标本结果判读标准:一区生长≤10个菌落,记为菌落个数≤1.0×104cfu/ml;一区生长>10个菌落且二区生长≤5个菌落,记为菌落个数1.0×105cfu/ml;一区生长>10个菌落、二区生长>5个菌落且三区生长≤5个菌落,记为菌落个数1.0×106cfu/ml;一区生长>10个菌落、二区生长>5个菌落且三区生长>5个菌落,记为菌落个数≥1.0×107cfu/ml。
1.2.5 性能评估
1.2.5.1 重现性
使用1 μl接种环连续接种1.0×104cfu/ml浓度的大肠埃希菌悬液于10个血琼脂平板,根据单个菌落计数评估仪器的重现性。
1.2.5.2 交叉污染
采用1.0×105cfu/ml浓度大肠埃希菌悬液和无菌生理盐水3个循环交替采样(即悬液—生理盐水—悬液—生理盐水—悬液—生理盐水),并按连续划线模式接种于血琼脂平板,同等孵育条件下(35℃普通孵箱)培养后观察结果,根据无菌生理盐水在平板上有无细菌生长评定仪器是否存在交叉污染。如果接种无菌生理盐水的平板上有细菌生长,且为前一个标本中的细菌则为交叉污染试验阳性;如均无细菌生长,则为交叉污染试验阴性。
1.2.5.3 方法学一致性
16种混合菌悬液经手工法与仪器法划线,每种一式3份,接种于血琼脂平板,培养后,通过对生长的菌种数量、菌落计数的比较分析2种方法是否存在差异性。
1.2.5.4 临床应用评价
分别比较临床50份痰标本150块平板(血琼脂平板、含万古霉素巧克力平板和麦康凯平板各50块)及50份中段尿标本100块平板(血琼脂平板和麦康凯平板各50块)仪器法与手工法两者间的菌种数量、菌落计数及其单个菌落数量差异性,评价Copan WASP全自动微生物前处理系统在临床应用的可行性。
1.2.6 统计学方法
分别收集16份混合菌悬液及50份痰标本、50份中段尿标本在培养平板中的分离菌种数量、菌落计数以及单个菌落的数量,保存平板菌落分离效果图像。单个菌落数量以±s表示。采用SPSS 18.0统计软件Mann-Whitney U非参数秩和检验分析仪器与手工划线接种方法在菌种数量、菌落计数的一致性,单个样本t检验分析10个连续接种平板的菌落计数均值与理论值的一致性,ANOVA单因素方差检验对2种不同方法的单个菌落数量进行比较,以P<0.05表示差异有统计学意义。
2 结果
2.1 重现性
以1 μl接种环连续接种1.0×104cfu/ml浓度的大肠埃希菌悬液于10个血琼脂平板,培养后,菌落计数为8.0×103~1.4×104cfu/ml[(1.07±0.21)×104cfu/ml],与理论值差异无统计学意义(P=0.322>0.05),仪器具有高度的重现性。
2.2 交叉污染
采用1.0×105cfu/ml浓度大肠埃希菌悬液与无菌生理盐水交替采样并以连续划线模式接种于血平板,无菌生理盐水平板上均无细菌生长。
2.3 方法学一致性
16个不同浓度混合菌悬液接种48块平板(16×3)共 147(49×3)种菌株,培养后其回收的菌株和菌落计数结果分别如图1和表2、3所示。在48块平板(共含147种菌株)中,仪器法和手工法均可回收混合菌悬液中所有菌株的平板数量分别为17和22块(如图1所示),分离的菌株数量分别为114和106种,未能回收的菌株数量分别为33和41种(见表2)。仪器法与手工法差异无统计学意义(P=0.251>0.05),但仪器法仍可回收更多的菌株,其菌落分离能力较手工法提高了7.55%。同时,16个不同浓度混合菌悬液在48块平板中生长的菌落计数亦无统计学差异(P=0.492>0.05)。

图1 48块平板混合菌悬液2种接种方法不同菌种的平板回收情况
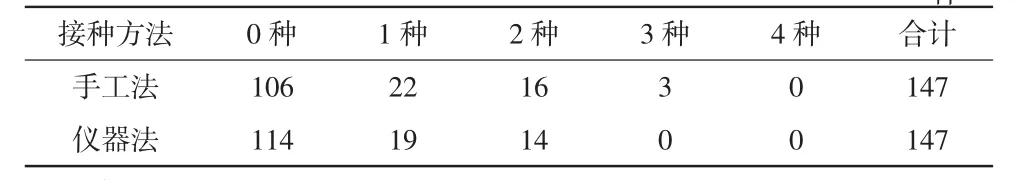
表2 混合菌悬液2种接种方法分离出不同种类菌株数量的未能回收情况(n=147)种

表3 混合菌悬液2种接种方法不同菌落计数的平板回收情况(n=48)块
2.4 临床应用评价
2.4.1 分离菌种数量
痰标本接种于血琼脂平板、含万古霉素的巧克力平板和麦康凯平板(共150块平板),而尿标本接种于血琼脂平板和麦康凯平板(共100块平板),培养后分离的菌种数量分布见表4。痰标本:仪器法和手工法分离出0种(无细菌生长)、1种、2种及≥3种菌株的平板数量分别为 8、11、60、71 及 11、16、58、65 块,2种方法间不同菌株种类数量采用Mann-Whitney U非参数秩和检验进行比较,差异无统计学意义(P=0.549>0.05)。尿标本:仪器法和手工法分离出0种(无细菌生长)、1种、2种及≥3种菌株的平板数量分别为 26、34、28、12 及 28、36、24、12 块,2 种方法间不同菌株种类数量差异无统计学意义(P=0.639>0.05)。
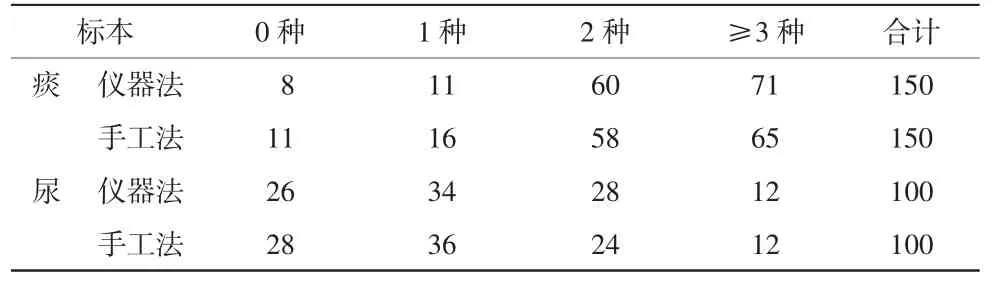
表4 50份痰及中段尿标本2种接种方法不同菌种数量的平板数块
2.4.2 菌落计数
痰和中段尿标本各50份分别采用手工法和仪器法划线接种,培养后分离的菌落计数分布见表5、6。仪器法与手工法2种方法间菌落计数采用Mann-Whitney U非参数秩和检验进行比较,痰和尿标本的菌落计数差异均无统计学意义(痰:P=0.154>0.05;尿:P=0.895>0.05)。

表5 50份痰标本2种接种方法不同菌落计数的平板数(n=150)块

表6 50份中段尿标本2种接种方法不同菌落计数的平板数(n=100)块
2.4.3 单个菌落数量
仪器法和手工法的划线接种效果如图2、3所示,仪器法菌落区间生长明显,单个菌落边缘、分界清晰,但手工法菌落略显密集生长。该现象可能由手工接种时检验人员用力不均所致。50份痰样本共150块平板及50份中段尿样本共100块平板不同方法之间的单个菌落计数统计结果见表7。两者的单个菌落数量采用ANOVA单因素方差检验进行比较,仪器法优于手工法,但差异均无统计学意义(痰:P=0.111>0.05;尿:P=0.532>0.05)。

图2 痰标本2种方法分离效果
3 讨论
临床微生物学是研究微生物的形态、结构、分类、生命活动规律的一门科学,是临床医学的基础之一,可为指导感染性疾病的诊断、治疗和预防提供专业依据和知识支持。目前,在检验其他专业领域(如临床检验、免疫检验、生化检验等)均普及全自动流水线的情形下,由于各种原因,大多数微生物实验室仍采用传统的手工方法对临床样本进行划线接种、培养、分离。但是由于手工方法因不同的操作人员其接种手法、习惯和熟练程度不同,对标本的菌落分离效果可能产生较为明显的影响,且在接种时可能发生样本“张冠李戴”的差错情况,生物安全亦存在着一定的风险。全自动微生物分离与培养流水线系统在临床中的广泛应用不但可弥补和改善手工方法的不足,对标本的接种进行标准化、规范化[12],而且由于全自动微生物流水线系统连接自动数字读板设备,采用条码识别功能,提高了标本的溯源性、样本接种的效率和菌落分离的效果,避免了人为的差错和手工烦琐重复劳动,减少了二次分离次数,加快了结果报告时间,同时实现了微生物培养的实时监视,即时为临床提供实验室微生物检验信息[13-14]。
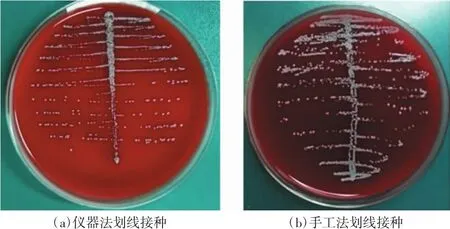
图3 尿标本2种方法分离效果
表7 50份痰标本(150块平板)和50份中段尿标本(100块平板)不同接种方法单个菌落数量统计结果(±s)个

表7 50份痰标本(150块平板)和50份中段尿标本(100块平板)不同接种方法单个菌落数量统计结果(±s)个
接种方法 痰 尿仪器法 26.28±5.31 9.74±4.49手工法 20.84±5.59 7.33±5.03
本文对当前广为使用的意大利Copan公司研发的WASP全自动微生物前处理系统的工作性能进行了评估,对10个血琼脂平板获得的菌落计数进行了统计学分析,其均值与理论值差异无统计学意义(P>0.05),表明仪器具有高度的重现性。同时,在无菌生理盐水平板上均无细菌生长,仪器无交叉携带污染,避免了假性结果。在16个不同浓度混合菌悬液接种的48块血琼脂平板共计147种菌株中,手工法与仪器法可回收菌株的数量与未回收菌株的数量差异无统计学意义(P>0.05),显示仪器法与手工法的一致性满足临床的需要,而且仪器法可回收更多的菌株,菌落分离能力提高了7.55%,从而进一步提高了细菌的阳性检出率。
在50份痰标本的临床应用中,菌株较多时仪器法的菌种分离数量比手工法略显优势。但手工法无细菌生长平板比仪器法多3块,这可能是由于痰标本在前处理过程中Copan WASP全自动微生物前处理系统的消化时间长并且有15 s振荡时间,使痰液充分液化,使得细菌完全释放,但2种方法之间差异无统计学意义(P>0.05),与王贺等[15]研究结果相一致。而在中段尿标本中,仪器法无细菌生长平板数(26块)却少于手工法(28块),这是由于尿液标本无需准备处理,本身均质性好,且杂菌少,此时更显仪器法规范化接种方式的优势。2种方法在尿标本菌株分离数量无明显差异(P>0.05)。
在菌落计数方面,CopanWASP全自动微生物前处理系统对痰标本分离出高浓度(≥1.0×107cfu/ml)平板明显高于手工法。可能是由于该前处理系统自动化程度高,划线接种与孵育培养的一体化装置使样本接种完毕无需平板转移,而是经轨道直接送入孵箱,并按照设置条件进行孵育。而手工法划线接种后则需要人为地将平板转入孵箱,对细菌培养可能具有一定的影响,尤其是标本的苛氧菌培养的生长。而对中段尿标本分离出的各浓度菌落的平板数量2种接种方法的差异无统计学意义(P=0.895)。
单个菌落生长情况及数量结果表明,手工法单个菌落生长密度相对集中,分离度稍差。尽管如此,无论在痰标本抑或中段尿标本中,仪器法与手工法的单个菌落平均数量差异无统计学意义(P均>0.05)。而提高单个菌落分离数量,可减少二次分离次数,便于及时进入菌落菌属鉴定及其药物敏感性试验的下一步操作程序,从而缩短报告流程时间[16-17],快速为临床提供准确的诊断依据。
综上所述,Copan WASP全自动微生物前处理系统主要性能指标表现突出,优于手工方法,样本处理充分、匀质性高,提高了微生物标本检验阳性率和工作效率,缩短了报告流转时间,实现了微生物检查划线接种的标准化和规范化,可替代手工法广泛地应用于临床。

