基于棉花亲水色谱从鸡蛋黄中分离纯化唾液酸化糖肽研究
韩健利 陈庆辉 邹美义 路宇 魏明 李成 王承健 黄琳娟 王仲孚

摘 要 鸡蛋黄中的唾液酸化糖肽(Sialylglycopeptide,SGP)的肽段部分由6个氨基酸(KVANKT)组成,其中天冬酰胺(N)被唾液酸化的复杂型N-糖链修饰。SGP主要从鸡蛋黄中分离获得,现有的SGP分离纯化方法操作繁琐,成本较高,难以规模化制备。本研究基于亲水相互作用色谱技术,用医用脱脂棉作为亲水色谱柱的固定相,建立了一种从鸡蛋黄中分离纯化唾液酸化糖肽的方法。首先将鸡蛋黄经苯酚处理得到唾液酸化糖肽的粗品,然后将糖肽粗品用水配成150 mg/mL的溶液,加入制备好的棉花亲水色谱柱中,依次用100%、95%、85%、75%(V/V)的乙腈-水溶液进行除杂,最后用去离子水洗脱唾液酸化糖肽。本方法操作简单,成本低廉。利用本方法从50个鸡蛋黄中制备得到了300 mg SGP,经高效液相色谱(HPLC)鉴定,其纯度高达95%,同时采用电喷雾电离质谱(ESI-MS)和串联质谱(MS/MS)对SGP及其糖链组成和糖基化位点进行了表征。
关键词 唾液酸化糖肽; 亲水色谱柱; 脱脂棉; 鸡蛋黄
1 引 言
糖基化(Glycosylation)修饰是蛋白质最普遍、最复杂的翻译后修饰之一,目前已知的蛋白质中约有一半以上发生了糖基化修饰[1]。与蛋白共价连接的寡糖链在细胞通讯、细胞粘附、病原体感染、个体发育及免疫应答等生物过程中发挥了关键作用[2~6]。由于糖链的生物合成具有结构的微观不均一性,导致了糖蛋白和糖肽功能上的显著差异。带有均一糖链的糖蛋白和糖肽是糖链结构和功能研究必不可少的材料。开发制备带有均一糖链的糖蛋白和糖肽的方法成为糖生物学的研究热点。
鸡蛋黄中唾液酸化糖肽(Sialylglycopeptide, SGP)的肽段部分由6个氨基酸(KVANKT)组成,其中天冬酰胺(N)被唾液酸化的复杂型N-糖链修饰[7~9]。该糖肽是一种人源化的糖肽,研究表明,这种唾液酸化糖肽在许多生物过程中具有重要作用。SGP在肠道疾病的治疗过程中具有一定作用,唾液酸化糖肽不仅可抑制沙门氏菌等细菌感染人类肠道表面细胞[10],也可抑制轮状病毒感染小肠上皮细胞,对于婴幼儿腹泻有较好的治疗效果[11]。同时, SGP中唾液酸化的α-(2→6)N-乙酰氨基乳糖残基在抗流感病毒方面也有重要作用,可作为与A型人流感病毒血凝素结合的配体,进而阻止病毒感染人体[12]。SGP也可作为糖基供体,用于合成带有N-糖链的亲脂类化合物,对药物的发现和开发具有重要意义[13]。由于唾液酸化糖肽具有重要的生物学活性和临床药用价值,该糖肽的制备和生产显得尤为必要。
唾液酸化糖肽结构复杂,很难用化学方法或生物工程方法进行合成获取。SGP是鸡蛋黄中的主要成分之一,从鸡蛋黄中提取是获取唾液酸化糖肽的主要途径。目前主要有两种纯化方法:其一是1997年Seko等[7]首次报道的从鸡蛋黄中分离纯化唾液酸化糖肽的方法。该方法对鸡蛋黄进行苯酚处理后,经过两次Sephadex G-50分离、Sephadex G-25除盐、DEAE-Toyopeael 650M离子交换柱纯化、Sephadex G-25除盐后,冻干得到样品,但上述方法具有步骤多、成本高、周期长、样品损失较大、上样量少等缺点; 其二是Zou等[14]报道的方法,先用苯酚处理新鲜的鸡蛋黄得到唾液酸化糖肽粗提物,再用Sephadex G-50进行分离,最后用活性炭柱进行纯化。该方法虽然简化了一些步骤,但纯化周期仍然较长,柱填料成本较高,且由于Sephadex G-50柱层析色谱上样量的限制,不适合大规模制备唾液酸化糖肽。
亲水相互作用色谱(Hydrophilic interaction chromatography, HILIC)由于能很好地纯化分离糖肽[15~17],在糖组学和糖蛋白组学中得到了广泛应用[18~20]。HILIC固定相的一个重要特征是它们是非离子的,可与糖肽上的糖链之间形成氢键,从而吸附糖肽,由于低保留率,未被糖基化修饰的肽段、脂质、盐被洗涤剂洗脫[21~23]。Wada等[24]报道了微晶纤维素柱可用于胰蛋白酶糖肽的纯化; Sha等[18]将溶胶-凝胶转化法制备的纤维素微球用于人免疫球蛋白(IgG)糖肽的纯化。虽然这些方法都实现了糖肽的纯化,但是微晶纤维素柱和合成的纤维素微球填料粒径小,装柱时易渗漏; 微晶纤维素柱需使用有强烈的刺激性气味的正丁醇,而纤维素微球合成产率低且未商品化生产。相比之下,棉花亲水色谱柱具有操作简单、不会渗漏、成本低廉等优点。目前尚未有将棉花亲水色谱柱用于鸡蛋黄中唾液酸化糖肽的规模化制备的研究报道。
唾液酸化糖肽的肽段部分较短,具有较好的亲水性,使得利用棉花亲水色谱对其进行分离纯化成为可能。本研究以医用脱脂棉为HILIC固定相,从鸡蛋黄中分离纯化SGP,对其结构和纯度进行鉴定,纯化效果良好。
2 实验部分
2.1 仪器、试剂与材料
LC-2010A高效液相色谱仪(日本Shimadzu公司); LTQ-XL型电喷雾电离质谱(美国Thermo Scientific公司)。
N-糖苷酶F(PNGase F, Sigma-Aldrich公司); 十二烷基硫酸钠(Sodium dodecyl sulfate, SDS)、二硫苏糖醇(Dithiothretol, DTT)、NP-40(上海阿拉丁试剂公司); 乙腈(Acetonitrile, ACN)等试剂均为国产分析纯; WondaSep C18和多孔石墨化碳固相萃取小柱(日本Shimadzu-GL Sciences公司)。医用脱脂棉购于西北大学校医院。实验用水为Milli-Q系统(美国Millipore公司)制备的超纯水。新鲜未受精鸡蛋购于本地农贸市场。
2.2 实验方法
2.2.1 鸡蛋黄的苯酚预处理 参考文献\[7\]的方法,用苯酚处理新鲜蛋黄,得到唾液酸化糖肽粗品。首先取50个新鲜未受精的鸡蛋蛋黄(约1 L),加入等体积的去离子水稀释,并搅拌均匀。向上述蛋黄溶液中加入10倍体积的苯酚-水 (1∶9, V/V)溶液,持续搅拌2 h,然后加入2 L 去离子水,混匀后,以8000 r/min离心30 min,将上清液用旋转蒸发仪减压浓缩至50 mL,再经冷冻干燥,即得到唾液酸化糖肽粗品,于20℃保存,备用。
2.2.2 棉花亲水色谱柱的准备 取医用脱脂棉150 mg均匀塞进1 mL的移液枪枪头中,并轻微压实,分别用10 mL水和乙腈清洗棉花柱。
2.2.3 唾液酸化糖肽的富集 将冻干的唾液酸化糖肽粗品配制成150 mg/mL的溶液,12000 r/min离心3 min。取上清液加入清洗好的棉花柱中,用乙腈、乙腈-水 (19∶1, V/V)、乙腈-水 (17∶3, V/V)和乙腈-水 (3∶1, V/V)各15 mL除杂质,用6 mL去离子水洗脱唾液酸化糖肽,冷冻干燥,得到唾液酸化糖肽纯品,采用ESI-MS进行分析。
2.2.4 唾液酸化糖肽的PNGase F酶解 5 mg样品溶于50 μL去离子水中,加入等体积的蛋白质变性液(0.17 mol/L SDS和0.4 mol/L DTT),100℃加热变性10 min。冷却到室温,向体系中加入60 μL 酶解缓冲液(0.5 mol/L Na3PO4,用H3PO4调节至pH 7.5)、60 μL NP-40溶液 (1∶9, V/V)和1.5 μL PNGase F酶(500 units/μL),37℃反应24 h [25,26]。反应结束后,反应液在13000 r/min离心3 min,上清液经C18柱和多孔石墨化碳固相萃取小柱纯化,用ESI-MS分析。
2.2.5 ESI-MS和MS/MS分析条件 ESI-MS参数设置如下:质谱进样口的定量环为2 μL; 流动相为甲醇-水(1∶1,V/V); 清洗时流速为200 μL/min; 毛细管温度300℃; 进样检测时流速为20 μL/min; 离子源电喷雾工作电压为4 kV; 毛细管透镜电压250 V; 辅助气(氮气)流速:鞘气(氮气)流速=1∶2(辅助气体流速一般选择10 arb); 毛细管电压37 V; 用LTQ Tune软件对数据进行采集。
多级质谱(MSn)检测参数设置为:在ESI-MS参数设置的基础上增加了碰撞气体为氦气; 狭缝宽度为 m/z 3; 碰撞时的能量选择30%~45%。
2.2.6 利用HPLC对唾液酸化糖肽进行纯度鉴定 对棉花亲水色谱柱纯化后的唾液酸化糖肽进行高效液相色谱分析,使用酰胺柱HILIC (250 mm×4.6 mm,TSK-GEL Amide-80)。流动相A为乙腈,流动相B为水。将样品瓶放置在相应位置,自动进样器进样10 μL。其中分离条件设置:流速0.8 mL/min; 线性梯度洗脱: 0~60 min,80%~20% A。柱温为25℃,检测波长214 nm。
3 结果与讨论
3.1 唾液酸化糖肽的纯化策略
鸡蛋黄经过苯酚处理后得到的唾液酸化糖肽粗提取物中含有大量的杂蛋白、脂质和盐等杂质,要得到较纯的唾液酸化糖肽,首先须除去上述杂质。Seko等[7]报道的纯化唾液酸糖肽的方法,主要采用连续两次Sephadex G-50纯化除去杂蛋白,然后用Sephadex G-25除盐处理3次,该方法操作繁琐,由于连续过柱纯化造成了样品损失严重。 Zou等[14]报道的纯化唾液酸糖肽的方法,同样采取Sephadex G-50除去杂蛋白,然后利用活性炭对唾液酸化糖肽表面糖链的吸附作用,将样品过活性炭柱进行水洗除盐,该方法相比文献\[7\]方法省略了很多步骤,但由于Sephadex G-50柱层析色谱存在上样量的限制,而且柱填料成本较高,不利于规模化制备。 本研究将除杂质过程简化为一步,利用棉花亲水色谱柱与糖肽表面糖链上的羟基形成次级化学键,体系中的杂蛋白和盐等杂质由于在色谱柱上不能保留而被洗脱除去。分离纯化唾液酸化糖肽的策略见图1,此纯化策略具有便捷、高效、柱填料成本低等优点,还可对柱体积进行放大处理,实现大规模纯化制备唾液酸化糖肽。
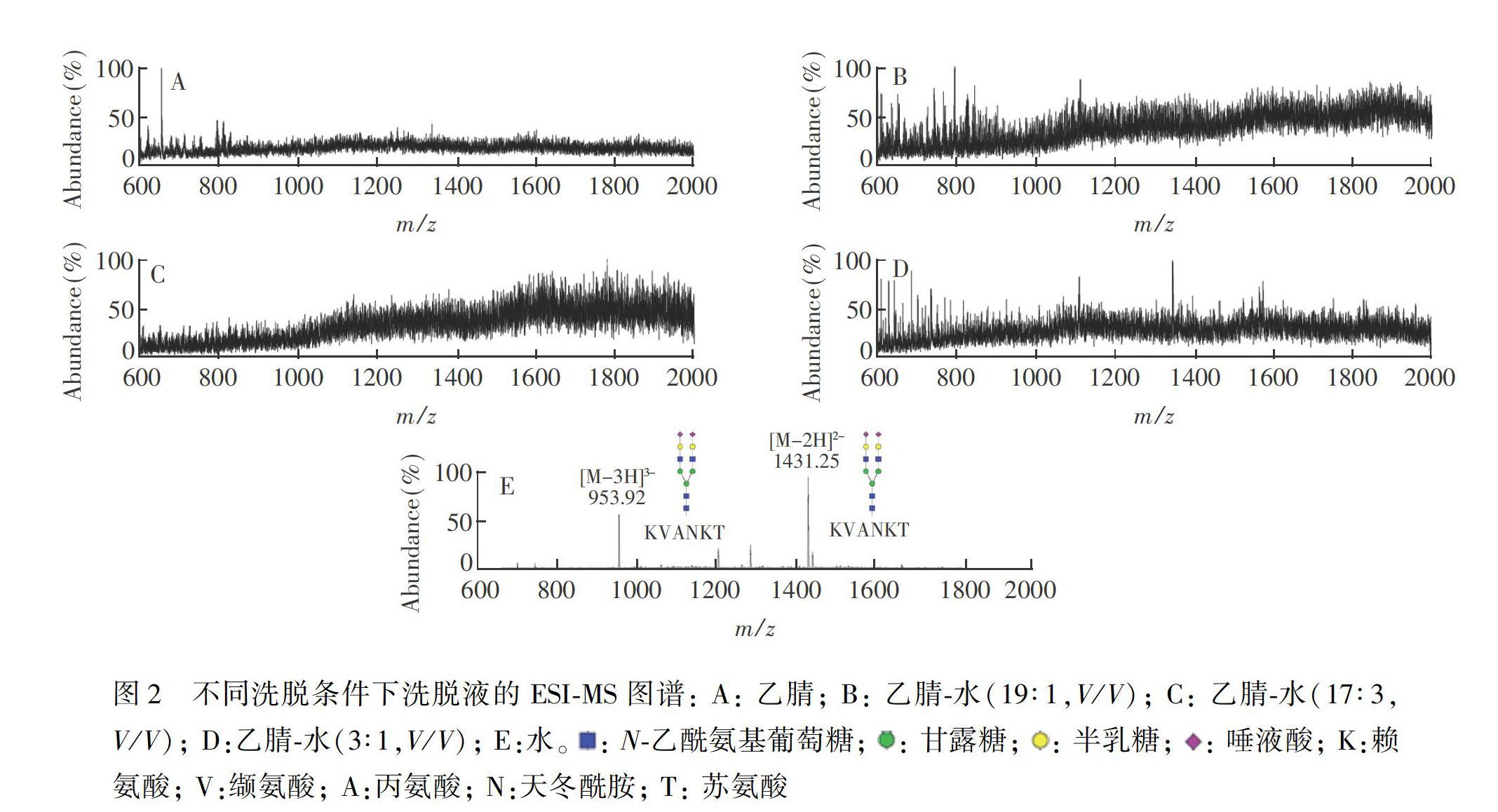
3.2 棉花亲水色谱柱纯化糖肽过程中洗脱液的ESI-MS图谱分析
洗脱剂中水的百分比对于亲水色谱柱的洗脱效果影响很大,含水量过高将会造成样品损失。依次用乙腈、乙腈-水(19∶1, V/V)、乙腈-水(17∶3, V/V)和乙腈-水(3∶1, V/V)对棉花亲水柱进行洗脱,除去体系中的盐和蛋白等杂质。对洗脱下来的液体进行ESI-MS(负离子模式下)实时检测。与图2A相比,图2B和图2C信噪比较差,基线较高,并且未检测到唾液酸化糖肽的质谱信号峰,表明大量杂质在乙腈-水(19∶1,V/V)或乙腈-水(17∶3,V/V)的洗脫条件下被洗脱下来。图2D的基线开始趋于平稳,同时有几条主峰出现, 表明在乙腈-水(3∶1, V/V)的洗脱条件基本接近临界值。以水对棉花色谱柱进行洗脱,目标产物的理论分子量为m/z 2866,由于所用质谱仪的检测分子量上限为2000 Da,在质谱检测中发现目标产物的双电荷峰m/z 1431.3\[M-2H\]2和三电荷峰m/z 953.9\[M-3H\]3,而且信噪比较好(图2E)。因此,上述结果表明,利用棉花亲水色谱柱可以很好地纯化并得到唾液酸化糖肽。
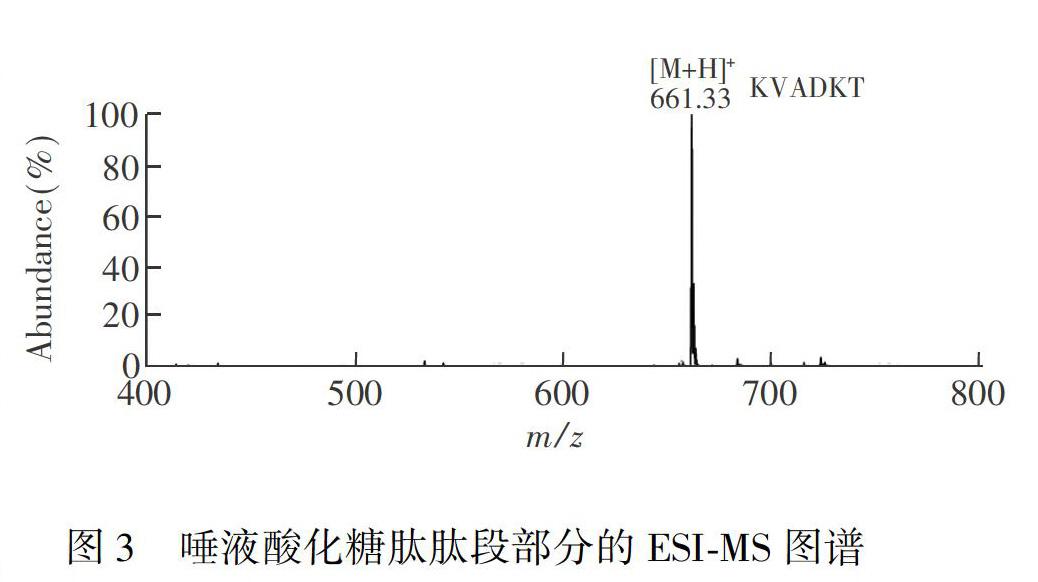
3.3 PNGase F酶处理唾液酸化糖肽后N-糖基化位点的鉴定与糖链结构分析
唾液酸化糖肽经PNGase F酶解,再通过C18和多孔石墨化碳固相萃取小柱纯化后,得到了肽段和糖链部分,分别进行ESI-MS分析。图3为肽段部分的质谱图,唾液酸化糖肽的氨基酸序列为(Lys-Val-Ala-Asn-Lys-Thr),理论分子量为659 Da,经PNGase F酶解作用后,天冬酰胺(N)变成天冬氨酸(D),分子量增加0.98 Da,理论分子量变成 660 Da。图3中的m/z 661质谱峰为正离子模式下目标肽段的单电荷\[M+H\]+峰,与理论分子量相吻合。
为进一步确认目标峰的氨基酸序列,进行了串联质谱(MS/MS)分析,结果如图4所示,对图中的b、y离子碎片进行归属, 发现m/z 643.25与肽段的分子量661 Da相差一个水分子,确定其为肽段失去一分子水的碎片峰(M-H2O); m/z 560.17(b5)为肽段失去一个苏氨酸残基质量101 Da所形成的碎片峰; m/z 414.17(b4-H2O)为b5失去一个赖氨酸残基质量128 Da和一分子水所形成的碎片峰; m/z 317.25(b3)为b4失去一个天冬氨酸残基质量115 Da所形成的碎片峰,这也符合在PNGase F酶解的过程中,天冬酰胺变成了天冬氨酸; m/z 246.72(b2)为b3失去一个丙氨酸残基质量71 Da而形成的碎片峰; m/z 533.17(y5)为肽段失去一个赖氨酸残基质量128 Da所形成的碎片峰; m/z 434.17(y4)为y5失去一个缬氨酸残基质量99 Da所形成的碎片峰; m/z 363.17(y3)为y4失去一个丙氨酸残基质量71 Da所形成的碎片峰; m/z 248.25(y2)为y3失去一个天冬氨酸残基质量115 Da所形成的碎片峰。结合上述分析结果,可以得出肽段的氨基酸序列为KVAN#KT(#表示糖基化位点),与理论序列一致,并确定了序列中的Asn是一个糖基化位点。
在質谱的负离子模式下对糖链结构进行解析,结果如图5所示,唾液酸糖链的理论分子质量为m/z 2223, 图5中的m/z 111109为目标糖链的双电荷\[M-2H\]2-峰,m/z 222264为其单电荷\[M-H\]峰,m/z 224473 为单电荷\[M+Na-2H\]峰。为进一步确定糖链结构,对图5中的m/z 224473进行ESI-MS/MS分析,结果如图6所示。对图6中的离子碎片峰进行解析,归属如下:m/z 204136是m/z 224473失去一个N-乙酰氨基葡萄糖残基(203 Da)形成的碎片峰; m/z 202355为m/z 204136失去一分子水形成的碎片峰; m/z 194018(0,2A6)为糖链发生穿环裂解形成的碎片峰; m/z 183855为m/z 204136失去一个N-乙酰氨基葡萄糖残基形成的碎片峰; m/z 173255为m/z 202355失去一个唾液酸形成的碎片峰; m/z 158927为m/z 204136失去一个唾液酸和半乳糖残基形成的碎片峰; m/z 152945为m/z 173255失去一个N-乙酰氨基葡萄糖残基形成的碎片峰。综上, 解析出糖链结构为H5N4A2(H:己糖; N:N-乙酰氨基葡萄糖; A:唾液酸),与文献\[14\]报道的一致,证明纯化得到的产物为唾液酸化糖肽。
通过高效液相色谱(HPLC)对棉花色谱柱纯化得到的唾液酸化糖肽进行纯度鉴定,色谱图如图7所示,在34 min处出现目标峰,对峰面积进行积分,鉴定其纯度达到95%以上。
4 结 论
采用苯酚对鸡蛋黄进行预处理, 获取唾液酸糖肽粗品,以脱脂棉制作的亲水色谱柱进行除杂,建立了一种操作简单、快速高效、可大量制备唾液酸化糖肽的方法。 用此方法从50个鸡蛋黄中提取到300 mg唾液酸化糖肽,对其进行结构解析和纯度鉴定。结果表明,糖链结构、氨基酸序列、糖基化位点均与理论值相吻合,通过HPLC鉴定其纯度>95%。本方法纯化唾液酸化糖肽分离步骤少,用时短, 固定相的成本低, 为规模化制备唾液酸化糖肽提供了解决方案,有良好的应用前景。
References
1 Apweiler R, Hermjakob H, Sharon N. Biochim. Biophys. Acta, 1999, 1473(1): 4-8
2 Agrawal P, Fontanals-Cirera B, Sokolova E, Jacob S, Vaiana C A, Argibay D, Castillo M. Cancer Cell, 2017, 31(6): 804-819
3 Dube D H, Bertozzi C R. Nat. Rev. Drug Disc., 2005, 4(6): 477-488
4 Haltiwanger R S, Lowe J B. Seminars Cell Develop. Biol., 2010, 21(6): 638-645
5 Arnold J N, Wormald M R, Sim R B, Rudd P R, Dwek R A. Annu. Rev. Immunol., 2007, 25(1): 21-50
6 Dwek R A, Butters T D, Platt F M, Zitzmann N. Nat. Rev. Drug Disc., 2002, 1(1): 65-75
7 Seko A, Koketsu M, Nishizono M, Enoki Y, Ibrahim H R, Juneja L R, Kim M, Yamamoto T. Biochim. Biophys. Acta, 1997, 1335(1-2): 23-32
8 Liu L, Prudden A R, Bosman G P, Boons G J. Carbohyd. Res., 2017, 452: 122-128
9 Peng W, de Vries R P, Grant O C, Thompson A J, McBride R, Tsogtbaatar B, Paulson J C. Cell Host Microbe, 2017, 21(1): 23-34
10 Sugita-Konishi Y, Sakanaka S, Sasaki K, Juneja L R, Noda T, Amano F. J. Agric. Food Chem., 2002, 50(12): 3607-3613
11 Koketsu M, Nitoda T, Juneja L R, Kim M, Kashimura N, Yamamoto T. J. Agric. Food Chem., 1995, 43(4): 858-861
12 Makimura Y, Watanabe S, Suzuki T, Suzuki Y, Ishida H, Kiso M, Katayama T, Kumagai H, Yamamoto K. Carbohyd. Res., 2006, 341(11): 1803-1808
13 Huang W, Ochiai H, Zhang X, Wang L X. Carbohyd. Res., 2008, 343(17): 2903-2913
14 Zou Y, Wu Z G, Chen L L, Liu X W, Gu G F, Xue M Y, Wang P G, Chen M. J. Carbohyd. Chem., 2012, 31(4-6): 436-446
15 Takegawa Y, Deguchi K, Keira T, Ito H, Nakagawa H, Nishimura S. J. Chromatogr. A, 2006, 1113(1-2): 177-181
16 Wohlgemuth J, Karas M, Jiang W, Hendriks R, Andrecht S. J. Sep. Sci., 2010, 33(6-7): 880-890
17 Selman M H J, Hemayatkar M, Deelder A M, Wuhrer M. Anal. Chem., 2011, 83(7): 2492-2499
18 Sha Q, Wu Y, Wang C, Sun B, Zhang Z, Zhang L, Liu X, Sun B, Lin Y. J. Chromatogr. A, 2018, 1569: 8-16
19 Zhang Q, Li H, Feng X, Liu B F, Liu X. PloS One, 2014, 9(4): e94232
20 Selman M H, McDonnell L A, Palmblad M, Ruhaak L R, Deelder A M, Wuhrer M. Anal. Chem., 2010, 82(3): 1073-1081
21 Ruhaak L R, Huhn C, Waterreus W J, de Boer A R, Neususs C, Hokke C H, Deelder A M, Wuhrer M. Anal. Chem., 2008, 80(15): 6119-6126
22 Wuhrer M, de Boer A R, Deelder A M. Mass Spectrom. Rev., 2009, 28(2): 192-206
23 Mysling S, Palmisano G, Hojrup P, Thaysen-Andersen M. Anal. Chem., 2010, 82(13): 5598-5609
24 Wada Y, Tajiri M, Yoshida S, Shumi Y. Anal. Chem., 2004, 76(22): 6560-6565
25 Packer N H, Lawson M A, Jardine D R, Redmond J W. Glycoconjugate J., 1998, 15(8): 737-747
26 LI Ling-Mei, WANG Cheng-Jian, HAN Jian-Li, LIU Ren-Dan, WEN Ya-Nan, WEI Ming, JIN Wan-Jun, HUANG Lin-Juan, WANG Zhong-Fu. Chem. J. Chinese Universities, 2018, 39(3): 427-434
李玲梅, 王承健, 韓健利, 柳人丹, 温娅楠, 魏 明, 晋万军, 黄琳娟, 王仲孚. 高等学校化学学报, 2018, 39(3): 427-434
Abstract The peptide portion of the sialylglycopeptide (SGP) in egg yolk is composed of six amino acids residues (KVANKT), in which asparagine (N) is modified by sialylated complex N-glycan. SGP is mainly obtained from egg yolk, and currently, the methods for separation and purification of SGP are cumbersome, expensive, and difficult to scale production. In this study, a simple and low-cost method for separation and purification of sialylated glycopeptide from egg yolk was developed based on the hydrophilic interaction chromatography by using medical absorbent cotton as stationary phase. Firstly, 50 egg yolks were treated with phenol to obtain crude sialylated glycopeptide. The obtained glycopeptide was then formulated into a 150 mg/mL solution and loaded onto the prepared cotton hydrophilic chromatographic column, followed by the treatment with 100%, 95%, 85% and 75% acetonitrile aqueous solution to remove the impurity. Finally, the sialyglycopeptide was obtained by eluting with deionized water. By this way, 300 mg SGP was obtained and its purity was identified by high-performance liquid chromatography (HPLC) to be 95%. The glycan composition and glycosylation site of SGP were further validated by electrospray ionization mass spectrometry (ESI-MS) and tandem mass spectrometry (MS/MS).
Keywords Sialylated glycopeptide; Hydrophilic column; Absorbent cotton; Egg yolk

