酸-冷交互胁迫对保护冷冻干燥发酵乳杆菌 活性的作用
杨 婕,郭金凤,李宝坤,卢士玲,王庆玲,董 娟,蒋彩虹,姬 华,王腾斌
(石河子大学食品学院,新疆植物药资源利用教育部重点实验室,新疆 石河子 832003)
乳酸菌为益生菌,人们常通过食用含该类活菌的制品或者含菌体组分及代谢产物的制品维持人体肠道内菌群的平衡[1],发酵乳制品因为具有丰富的营养价值与良好益生作用而受到消费者的青睐[2],其中乳酸菌发酵剂在乳制品发酵过程中起到至关重要的作用[3]。而在发酵剂中乳酸菌的细胞数量与细胞活力则是影响发酵乳制品质量的关键因。目前冷冻干燥技术被认为是最有利于保持菌种活性的方法[4],尽管使用冷冻干燥的成本较高,但能长时间保持菌种的活力,便于贮藏和应用。
在冷冻干燥过程中,乳酸菌发酵剂难以避免冷冻与干燥过程对其造成的各种损伤。低温使得菌体内酶活性降低以及酶发挥作用延迟,进而可能改变代谢通路;低温也可能降低一些代谢调节过程中的灵敏度,使代谢失衡或生长停滞[14]。这些损伤使得发酵剂中菌株的存活率降低,活力下降,造成生产成本增加以及产品质量不稳定等问题。近年来常通过添加合适的保护剂,调整冷冻干燥工艺或者各种迫提高乳酸菌的存活率和活力,但是利用交叉保护提高乳酸菌在冷冻干燥过程中冷冻抗性方面的研究较少,因探究运用交叉保护这一方法对于乳酸菌冷冻干燥活性的提高具有一定意义。
本实验室前期筛选出的发酵乳杆菌(Lactobacillus fermentum)ATm具有滞后时间短以及酸化速率快的特点[15], 能够缩短发酵时间、降低能耗,是1 株潜在的适合工业生产用的菌株,因选用该菌株为研究对象。通过比较不同迫条件下细胞的冷冻干燥存活率,研究不同迫条件影响发酵乳杆菌冷冻干燥后活性的差异性,为高活性乳酸菌发酵剂的生产提供实验依据。
1 材料与方法
1.1 材料与试剂
脱脂乳由新疆花园乳业提供;发酵乳杆菌ATm为石河子大学畜产实验室筛选分离,NCBI登录号为KY310724。
MRS培养基、固体MRS培养基均购自青岛海博技术生物有限公司;121 ℃灭菌20 min。
乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒 索莱宝生物公司;ATP酶试剂盒 南京建成生物公司;LIVE/DEAD™ BacLight™ Bacterial Viability Kit L7012 美国Life生物公司;海藻糖 南京奥多福尼生物科技有限公司。
1.2 仪器与设备
F D U-1 2 0 0 冷冻干燥机 日本E y e l a 公司;NEOFUGE15R/15高速冷冻离心机 郑州南北仪器设备有限公司;995超低温冰箱 美国赛默飞世尔公司;IX71倒置荧光显微镜 日本奥林巴斯公司;DK-8D恒温水浴锅 江苏金坛仪器有限公司;PHS-3C酸度计 上海雷磁仪器厂;ZXSD-1160全自动生化培养箱 上海智诚仪器有限公司;EON多功能酶标仪 美国BioTek仪器有限公司;VCX750超声波破碎仪 美国Sonics公司。
1.3 方法
1.3.1 冷冻干燥
将发酵乳杆菌ATm以3%的接种量,接种至MRS培养基中,于37 ℃培养18 h,将菌液于6 791h g离心10 min,去上清液,将菌泥用生理盐水洗涤2 次,加入等体积保护剂(脱脂乳12%海藻糖10%)。将混合有保护剂的菌悬液分装在无菌西林瓶中,每瓶1 mL,盖上橡胶塞,放入超低温冰箱中预冻4 h。将预冻好的品放入冷冻干燥机中,冷冻干燥12 h,真空压盖,品备用。
1.3.2 冷冻干燥存活率测定
将冷冻干燥后的菌粉用MRS培养基复水至冷冻干燥前相同体积,用平板计数法测定冷冻干燥前后活菌数。重复3 次实验,每次3 个平行。存活率计如式(1)所示:

式中:NA为冷冻干燥后的细胞数;NB为冷冻干燥前的细胞数。
将活化后的菌种培养液以3%接种量接入MRS培养基中,在37 ℃静置培养至对数末期,将菌种离心并重悬于磷酸盐缓冲液中。将重悬液在酸迫(pH 3.2、3.8、4.0、4.5、5.0)静置90 min,冷迫(4、10 ℃)静置180 min,将迫后的细胞进行冷冻干燥。
1.3.5 酸化曲线测定
将冷冻干燥复水后的菌种以3%接种量接种到新培养基中,每隔1 h取3 支试管测量其pH值,实验重复3 次,取平均值。以pH值为纵坐标,培养时间为横坐标,绘制酸化曲线。酸化曲线根据式(2)拟合[16]:
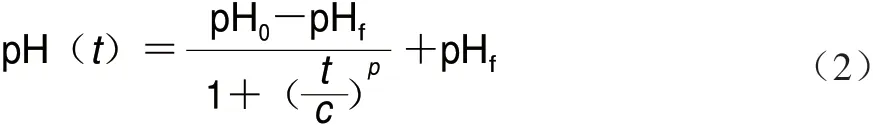
式中:t为培养时间/h;pH0为t=0时培养基的pH值;pHf为达到稳定期时的pH值;c为对应曲线中拐点的时间/h;p为指数拟合因子。
滞后时间为曲线上t=0点切线与t=c点切线的交点,酸化速率为指数阶段切线斜率的模量,按式(3)计:

式中:tc为滞后时间;tf为pH值达到稳定期的时间。
1.3.6 相关酶活性的测定
1.3.6.1 无细胞提取液的制备
将菌体复水后离心,并用0.85%生理盐水洗涤2 次。取5 mL于冰水浴中进行超声波破碎(超声时间3 s,间隔时间9 s),持续6.5 min。4 ℃、6 791h g离心10 min,取上清液进行相关酶活性测定。
1.3.6.2 LDH活性测定
采用索莱宝公司试剂盒进行测定。测定原理:LDH催化NAD氧化乳酸生成丙酮酸,丙酮酸进一步与2,4-硝基苯肼作用生成丙酮酸硝基苯腙,在碱性溶液中显棕红色,颜色深浅与丙酮酸浓度呈正比。每104个细菌或细胞每分钟催化产生1 nmol丙酮酸定义为1 个酶活性单位,LDH活性单位为U/104cell。
1.3.6.3 ATP酶活性测定
采用南京建成公司试剂盒进行测定。其中蛋白质浓度根据考马斯亮蓝法[17]测定。
1.3.7 细胞膜完整性测定
利用LIVE/DEAD™ BacLight™ Bacterial Viability Kit L7012试剂盒测定。将等体积的荧光染料碘化丙啶和免疫荧光染料(SYT09)均匀混合。取1 μL混合染料,加入到300 μL菌悬液中,均匀混合,室温避光孵育15 min。取5 μL已染色菌液滴加于载玻片并盖上盖玻片于倒置荧光显微镜下进行观察。
1.4 数据处理
数据采用SPSS 25.0软件进行分析,实验重复3 次,显著性分析采用Duncan检验。图像处理采用Origin 2018软件。
2 结果与分析
2.1 单因迫对冷冻干燥存活率的影响
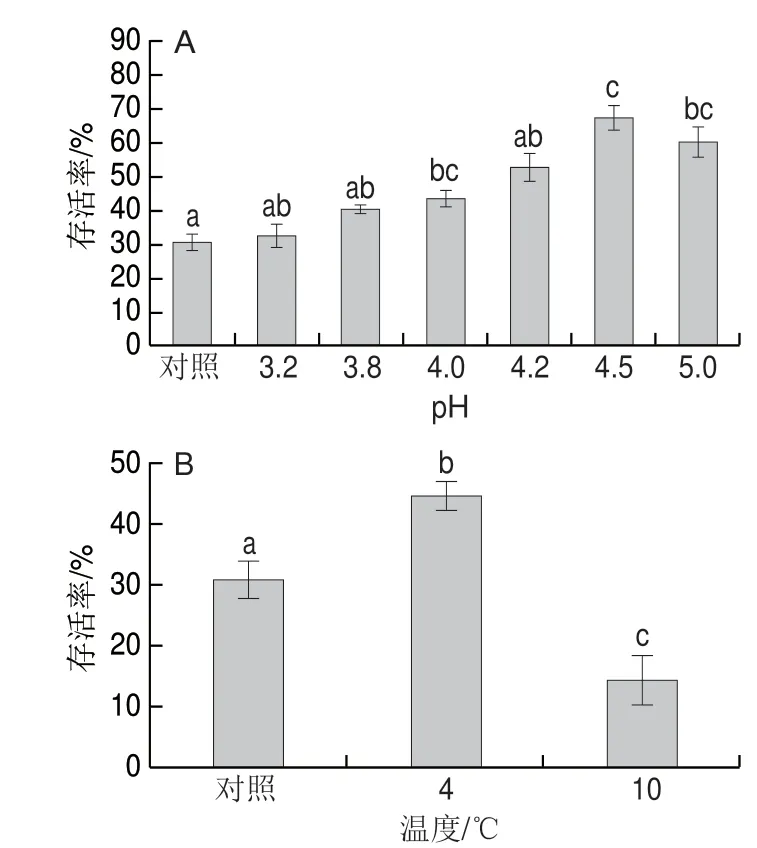
图 1 酸胁迫(A)和冷胁迫(B)对发酵乳杆菌ATm 冷冻干燥存活率的影响Fig. 1 Effect of acid stress (A) and cold stress (B) on the survival rate of freeze-dried L. fermentum ATm
2.2 交互迫对冷冻干燥存活率的影响
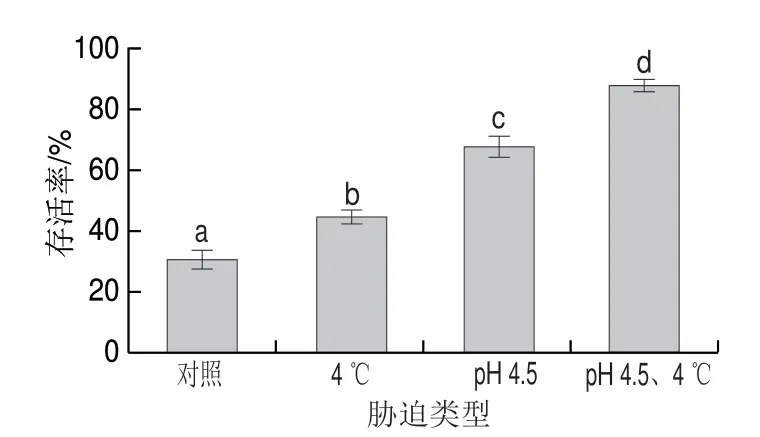
图 2 交互胁迫对发酵乳杆菌ATm冷冻干燥存活率的影响Fig. 2 Effect of cross-stress on the survival rate of freeze-dried L. fermentum ATm
2.3 交互迫对冷冻干燥发酵乳杆菌ATm酸化曲线的影响
冷冻干燥过程中的脱水会对细胞造成不同程度的结构损伤[25],但仅通过平板计数评估交互迫对乳酸菌活性保护的能力有局限性。因,对冷冻干燥后的乳酸菌进行酸化曲线测定可提供细菌修复损伤的能力和冷冻干燥后活性恢复的情况[16]。
菌株冷冻干燥并复水后,每小时测定细胞培养液pH值变化,选取迫处理菌株、未经冷冻干燥原始菌株和未经迫处理的冷冻干燥菌株(对照),得到菌株的酸化曲线(图3)。
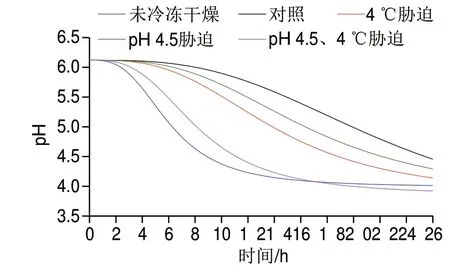
图 3 交互胁迫对冷冻干燥发酵乳杆菌ATm酸化曲线的影响Fig. 3 Effect of cross-stress on acidification curves of freeze-dried L. fermentum ATm
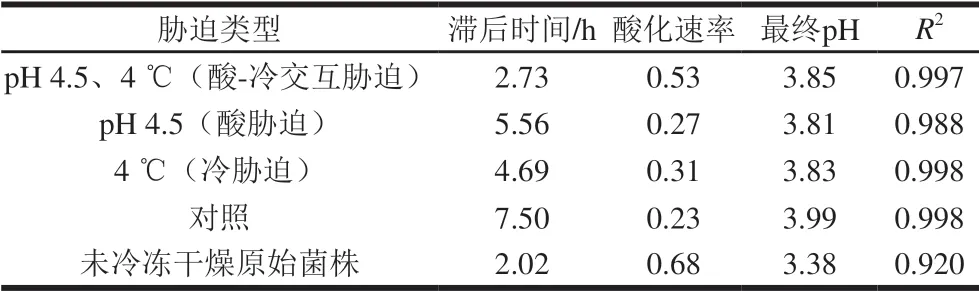
表 1 交互胁迫对发酵乳杆菌ATm生长动力学参数的影响 Table 1 Effect of cross-stress on growth kinetic parameters of freeze-dried L. fermentum ATm
如表1所示,未冷冻干燥的原始菌株滞后时间最短,酸化速率(每小时pH值变化量)最快,分别为2.02 h、0.68。相反,未经迫处理的冷冻干燥乳酸菌滞后时间最长,酸化速率最慢,分别为7.50 h、0.23。任何处理下冷冻干燥后微生物的滞后时间都有不同程度的延长,且酸化速率减慢。这可能是因为冷冻干燥的脱水过程使得乳酸菌的细胞膜受到损伤,以及酶活力下降[26],使得乳酸菌在冷冻干燥后的产酸能力受到影响。经过交互迫处理后的乳酸菌滞后时间和酸化速率与原始菌株相近,分别为 2.73 h、0.53,该处理比其他迫的保护方式更有效,说明用交互迫的前处理方式保护冷冻干燥乳酸菌的活性是很有必要的。
2.4 交互迫对冷冻干燥发酵乳杆菌ATm LDH活性的影响
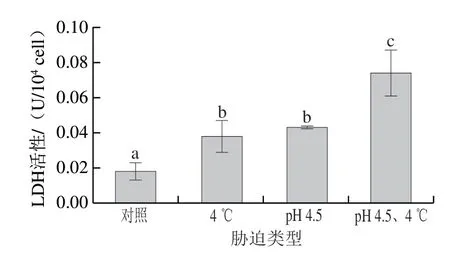
图 4 交互胁迫对冷冻干燥发酵乳杆菌ATm LDH活性的影响Fig. 4 Effect of cross-stress on LDH activity of freeze-dried L. fermentum ATm
2.5 交互迫对冷冻干燥发酵乳杆菌ATm ATP酶的影响
ATP酶是一种广泛分布的生物膜酶系统,对于维持细胞正常生理功能有至关重要的作用[20]。Na-KATP酶又称Na-K泵或者钠泵,镶嵌在细胞质膜的脂质双分子层中,能够催化ATP酶水解供给能量,有载体和酶的活性,在维持膜电位、调节渗透压以及为主动运输供能方面起着重要的作用[29]。Ca2-Mg2ATP酶能够调节Ca2和Mg2的浓度,也是重要的膜酶[30]。因ATP酶是冷冻干燥过程中损伤的关键酶之一,本研究测定冷冻干燥后 Na-KATP酶与Ca2-Mg2ATP酶的活性结果见图5。
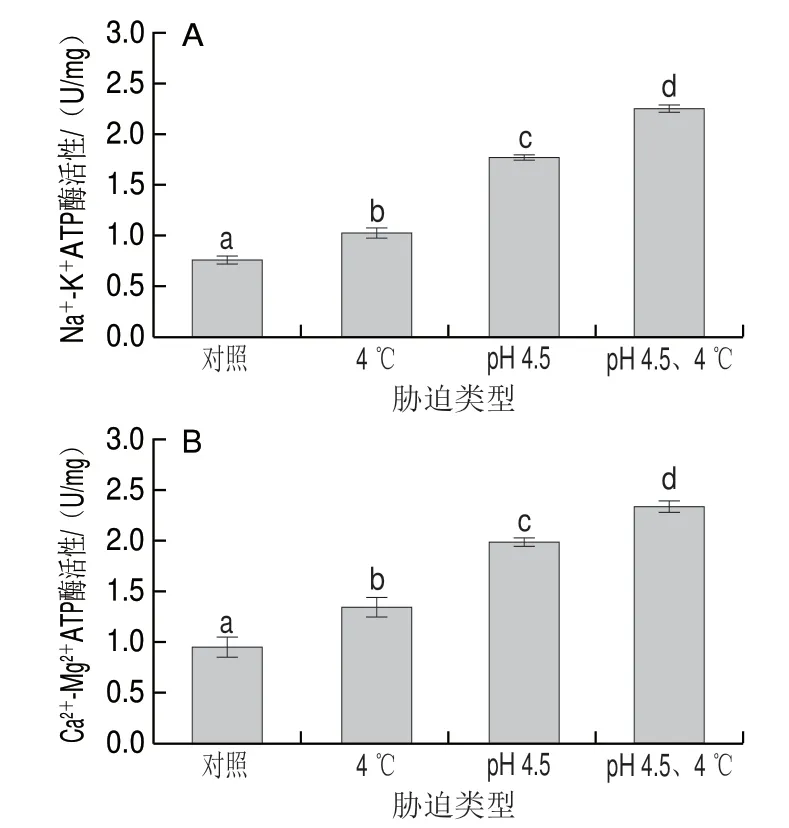
图 5 交互胁迫对冷冻干燥发酵乳杆菌ATm Na+ -K+ATP酶(A)和Ca2+-Mg2+ATP酶(B)活性的影响Fig. 5 Effect of cross-stress on Na+-K+ATPase (A) and Ca2+-Mg2+ATPase (B) activities of freeze-dried L. fermentum ATm
2.6 交互迫对冷冻干燥发酵乳杆菌ATm细胞膜完整性的影响
细胞膜能够将细胞内外的环境隔离开,对于细胞的生殖,能量传递及物质代谢等具有重要作用[31],是细胞遭受外界环境迫害的第一道防线,细胞膜的破坏会直接导致菌体的死亡,因细胞膜完整性真实地反映了菌体生理活性[32]。当细胞膜完整性被破坏时,碘化丙啶能够透过生物膜与核酸结合在绿光的照射下发出红色荧光,所以当荧光显微镜观察到细胞呈红色,说明细胞膜完整性被破坏[33]。
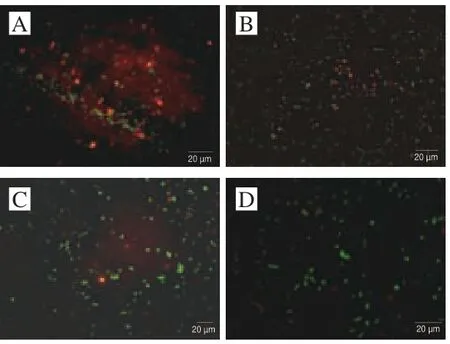
图 6 交互胁迫对冷冻干燥发酵乳杆菌ATm细胞膜完整性的影响Fig. 6 Effect of cross-stress on cell membrane integrity of freeze-dried L. fermentum ATm

