具抗氧化功能益生菌菌株筛选及其对丙烯酰胺 诱导肠上皮细胞氧化损伤的保护作用
李 桐,吴思琪,曹 鑫,宋静颐,张红星,谢远红,金君华
(食品质量与安全北京实验室,农产品有害微生物及农残安全检测与控制北京市重点实验室,北京农学院食品科学与工程学院,北京 102206)
丙烯酰胺具有多种生理毒性,可在淀粉类食物经高温烹调时产生,目前被世界卫生组织国际癌症研究机构认定为2A类致癌物[1]。丙烯酰胺可快速到达肠道,刺激肠上皮细胞产生过量的活性氧自由基,降低细胞内抗氧化酶的活性并破坏细胞膜的完整性,导致细胞内容物外泄,使细胞发生氧化损伤,最终可致肠上皮细胞凋亡或死亡,造成肠黏膜功能障碍[2]。
有报道显示乳酸菌作为肠道益生菌,可直接在肠道发挥抗氧化作用,通过维持肠道氧化还原平衡状态来维持肠道健康[3],但是乳酸菌的不同菌种或不同菌株间的特性存在显著差异。Amanatidou等[4]对19 株乳酸菌进行对比研究,结果显示多数乳酸菌的无细胞提取液对羟自由基有不同程度的清除能力,表明不同乳酸菌间的功能活性存在显著性差异。在单个菌株研究方面,Ahotupa等[5]的报道显示鼠李糖乳杆菌GG(Lactobacillis rhamnosus GG,LGG)具有较强的清除超氧离子自由基的能力。Eun等[6]研究证实短乳杆菌也具有较强超氧离子自由基清除能力。因,筛选出抗氧化活性高且耐受能力强的菌株对于扩大具有我国自主知识产权的益生菌菌库、增强发酵食品的功能性具有重要的意义。
目前国内外已有报道表明对丙烯酰胺导致的肠道上皮细胞损伤具有保护作用的活性物质主要是具有抗氧化活性的天然化合物,而乳酸菌是否具有该保护作用尚未见报道。广西巴马长寿村的居民平均寿命超过85 岁,经调查发现,发酵米粉是他们每日必食的食物。因,本研究对发酵米粉中的乳酸菌进行分离后通过体外抗氧化模型实验进行筛选,检测菌株清除1,1-苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的抗氧化能力,探讨DPPH自由基清除能力强的菌株——植物乳杆菌GBE17、唾液乳杆菌GBE29对丙烯酰胺所致肠上皮Caco-2细胞氧化损伤的保护作用,并对其肠道迫环境耐受能力进行评价,以期获得对丙烯酰胺诱导肠上皮细胞氧化损伤具有保护作用的潜在益生菌菌株。
1 材料与方法
1.1 材料与试剂
菌株:植物乳杆菌GBE17、唾液乳杆菌GBE29 (表1);参考菌株:鼠李糖乳酸杆菌(L G G,ATCC53103)由中国农业大学食品科学与营养工程学院提供;人结肠腺癌细胞系Caco-2 武汉普诺赛生命科技有限公司。

表 1 不同来源的乳酸菌Table 1 Lactobacillus strains isolated from different sources
细菌基因组提取试剂盒 天根生化科技(北京)有限公司;MEM细胞培养液、0.25%胰酶(含0.02% EDTA)、胎牛血清 美国Sigma公司;细胞培养瓶及培养板 美国Corning公司;青链霉混合液(100×)、甲基亚砜(dimethyl sulfoxide,DMSO) 美国Solarbio公司;磷酸盐缓冲液(phosphate buffer saline,PBS) 美国HyClone公司;噻唑蓝(methyl thiazol tetrazolium bromide,MTT)、非变性细胞裂解液、BCA蛋白浓度测定试剂盒 生工生物工程(上海)股份有限 公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、谷胱甘肽(glutathione,GSH)试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒 南京建成生物工程研究所。其余试剂均为国产分析纯。
1.2 仪器与设备
1.3 方法
1.3.1 菌液准备
将菌株以2%的接种量接种于MRS肉汤中,37 ℃恒温培养12 h,并传至3 代备用。将活化好的菌液,6 000h g、4 ℃离心10 min,收集上清液,经0.22 μm滤膜过滤所得滤液即为发酵上清液;菌体沉淀用无菌PBS(pH 7.4)洗涤3 次,重悬于PBS中,调整细菌的浓度约为1h 109CFU/mL,并用细胞破碎仪冰浴超声进行破碎,400 W间歇4 s,破碎5 min后,12 000h g离心10 min,收集上清液即为无细胞提取物[2]。
1.3.2 DPPH自由基清除实验
参照文献[7]所述方法,略有改进,其中空白调零,蒸馏水-乙醇(1∶1,V/V)。反应时,2 mL待测液中加入0.2 mmol/L DPPH溶液2 mL,室温下避光反应30 min。 3 500h g离心10 min,取上清液,用紫外-可见分光光度计在517 nm波长处测定吸光度。
1.3.3 16S rDNA序列分析
将筛选出抗氧化性强的菌株进一步做16S rDNA序列分析。采用细菌基因组提取试剂盒说明书方法提取试验菌株基因组D N A。以试验菌株D N A 为模板,根据细菌的16S rDNA序列设计引物。上游引物:AGAGTTTGATCCTGGCTCAG,下游引物:TACGGCTACCTTGTTACGACTT。PCR扩增体系及反应条件参见文献[7],引物和扩增产物由生工生物工程(上海)股份有限公司合成和测序。将PCR产物测序结果与GenBank中已知16S rDNA序列进行同源性比较,从GenBank中选择近缘菌株的16S rDNA基因序列,用MEGA 6.0软件构建系统发育树。
1.3.4 细胞培养
Caco-2细胞以MEM完全培养液(含20%胎牛血清和1%青链霉双抗溶液)于37 ℃、5% CO2的饱和湿度环境中静置培养,每2 d换液一次。
1.3.5 Caco-2细胞氧化损伤模型的建立
参照文献[8],采用MTT法确定构建氧化损伤模型所需丙烯酰胺浓度,具体操作如下:将处于对数生长期的Caco-2用胰蛋白酶消化成单层细胞,制成单个细胞悬液,以2h 104个/mL的细胞密度接种于96 孔板中培养,待细胞贴壁后开始实验。PBS清洗3 次,向每孔加入1.25、2.5、5.0、10.0、20.0 mmol/L的丙烯酰胺100 μL,处理24 h。吸取培养液,PBS清洗3 次后,每孔加入20 μL终质量浓度为0.5 mg/mL MTT溶液,继续培养4 h,终止培养,吸去孔内MTT,每孔加入150 μL DMSO,37 ℃低速振荡10 min,在490 nm波长处测量各孔OD值,并计IC50,确定丙烯酰胺的最佳诱导浓度。细胞存活率计公式如下:

1.3.6 试验细胞分组
待细胞贴壁铺满板底80%以上,胰酶消化,取对数生长期增殖活跃的细胞随机分组。试验细胞分组如表2、3所示。治疗组中,除空白对照外,各处理组均用含9.8 mmol/L丙烯酰胺的MEM基础培养基作用24 h,弃上清液,PBS清洗细胞3 次,孵育4 h。干预组中,各处理组先用丙烯酰胺与细胞预处理4 h后,3 500h g离心10 min收集上清液,经0.22 μm滤膜过滤后所得的滤液孵育细胞24 h。
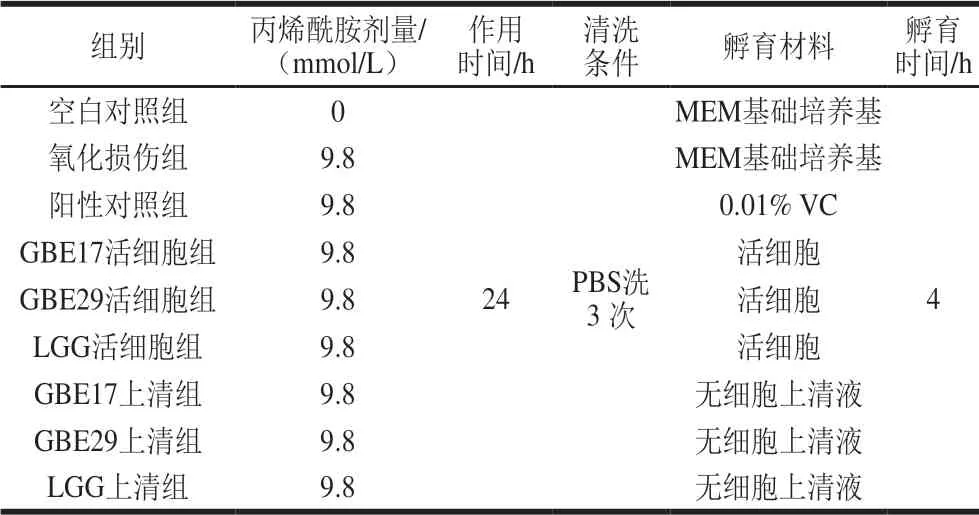
表 2 治疗组细胞分组处理方式Table 2 Experimental grouping for therapeutic effect evaluation

表 3 干预组细胞分组处理方式Table 3 Experimental grouping for preventive effect evaluation
1.3.7 乳酸菌对氧化损伤的细胞形态学的影响
参照文献[9],将处于对数生长期的Caco-2细胞用胰酶消化收集,制成105个/mL的细胞悬液,接种于12 孔板,常规培养待细胞贴壁后按表2模型的方法分组处理后,在倒置显微镜下观察细胞形态并拍照,比较空白对照组、氧化损伤组、干预组及上清组细胞形态的不同。
1.3.8 测定指标
收集各组细胞培养上清液。每孔用无菌PBS迅速洗涤3 次,均加入150 μL非变性细胞裂解液,充分混匀,冰浴30 min。12 000h g离心5 min,收集上清液即为细胞裂解液。细胞培养上清液与细胞裂解液按试剂盒说明书步骤测定SOD、CAT、GSH和LDH活性,以及胞内总蛋白含量。
调pH值:用0.1 mol/L盐酸溶液将MRS肉汤的pH值调为3.0、2.5,以pH 6.5的MRS肉汤作为对照组。
调胆盐浓度:将配制好的MRS肉汤按质量分数0.05%、0.1%加入胆盐。
平板计数:将活化好的植物乳杆菌GBE17和唾液乳杆菌GBE29三代菌液在4 ℃、5 000h g离心10 min,菌体分别用pH值为3.0、2.5及胆盐质量分数为0.05%、0.1%的MRS肉汤洗涤1 次后,重悬于对应pH值和胆盐浓度的等体积MRS肉汤中,37 ℃培养。取培养时间为0、1、2、3、4 h进行梯度稀释,选取合适的梯度进行平板计数。
1.4 数据统计分析
实验数据采用f s表示,组间均数比较采用SPSS 16.0统计软件,单因方差分析并用LSD法进行多重比较,采用GraphPad Prism 6与MEGA 6.0作图。差异显著,P<0.05。
2 结果与分析
2.1 乳酸菌的DPPH自由基清除能力
由表4可知,不同试验菌株的DPPH自由基清除能力之间具有差异,同一株菌不同组分的清除能力也具有显著区别,发酵上清液的抗氧化能力均比无细胞提取物强,表明本研究试验菌株中具有DPPH自由基清除能力的活性物质主要为胞外代谢产物,分布在发酵上清液中,这与黄玉军等[10]的实验结果一致。为了排除培养基质对实验结果的影响,本研究也对MRS培养基的DPPH自由基清除率进行测定,表明其不具有显著的抗氧化性,这与刘天祎等[11]实验中发现培养基中的营养物质对清除率影响很小的结果一致。
菌株发酵上清液清除率测定结果显示:植物乳杆菌GBE17(89.44%)、唾液乳杆菌GBE29(79.24%)>植物乳杆菌N1大(36.53%);而在破碎细胞的抗氧化能力上,植物乳杆菌GBE17(82.54%)>植物乳杆菌N1大(30.34%)>唾液乳杆菌GBE29(17.15%)。由推断,发酵上清液与破碎细胞的抗氧化能力者之间不存在直接相关性,在同一菌属下的不同菌株在抗氧化的能力上也存在显著性的差异,乳酸菌抗氧化能力的强弱与其所在菌属无相关性。
本研究中植物乳杆菌GBE17(89.44%)和唾液乳杆菌GBE29(79.24%)的DPPH自由基清除能力均显著高于其他18 株菌。刘少敏[12]研究利用相同的检测方法,发现鼠李糖乳杆菌ATCC53103发酵上清液中的DPPH自由基清除率为53.21%,可见本试验菌株具有较好的清除DPPH自由基能力。
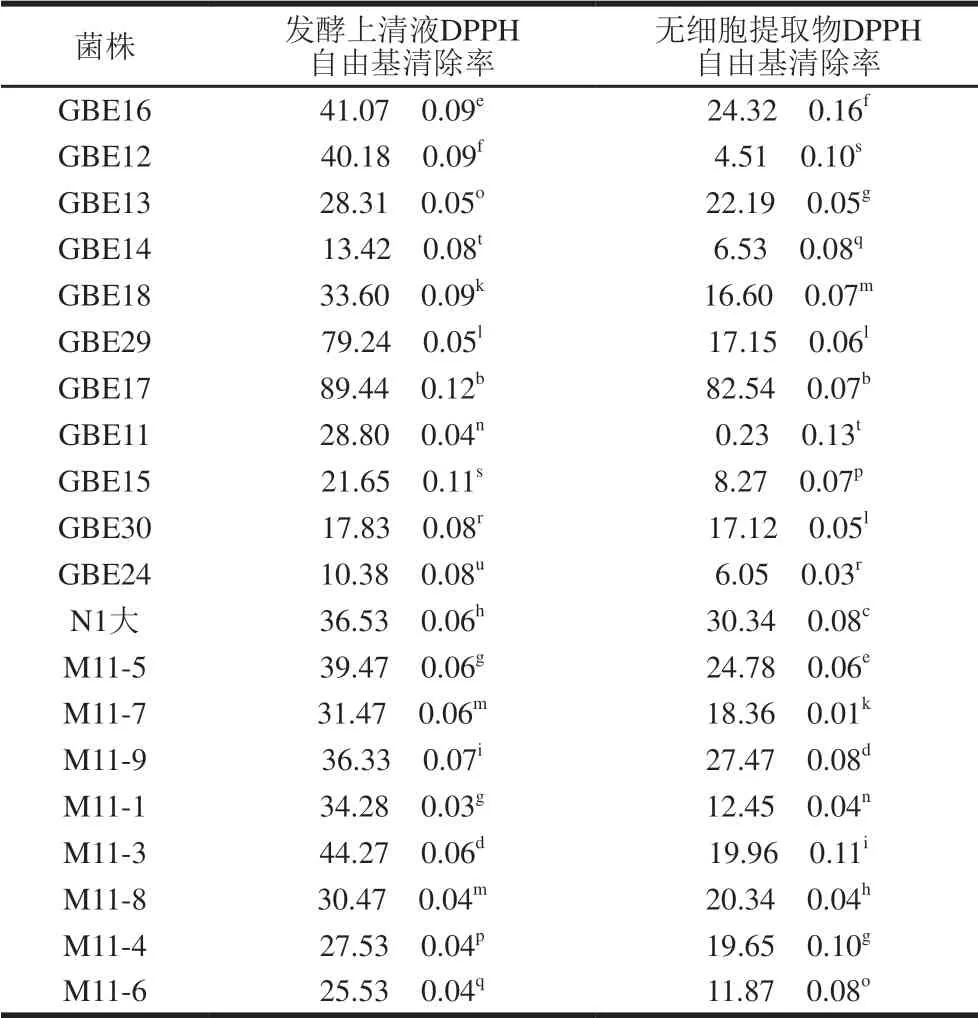
表 4 试验菌株DPPH自由基清除率测定结果Table 4 DPPH radical scavenging activity of Lactobacillus %
2.2 16S rDNA序列分析
菌株GBE17和GBE29扩增后得到1 600 bp左右的DNA序列。将结果在NCBI数据库中比对并构建系统发育树,见图1、2。由系统发育树可知,菌株GBE17与L. plantarum strain KAI9(KM485570.1),GBE29与 L. salivarius strain L5(KP317678.1)有最接近的亲缘关系,相似度达到99%。

图 1 基于16S rDNA序列的GBE17系统发育树Fig. 1 Phylogenetic tree of strain GBE17 based on 16S rDNA sequence

图 2 基于16S rDNA序列的GBE29系统发育树Fig. 2 Phylogenetic tree of strain GBE29 based on 16S rDNA sequence
2.3 模拟肠道的耐受性评价
由图3可知,3 株菌在pH 6.5的条件下,经过4 h的培养,菌落数均有显著增加,存活数均高于109CFU/mL,可见该pH值条件适合乳酸菌的生长。在低pH值和高胆盐浓度的培养条件下,经过4 h,3 株菌的存活数均高于107CFU/mL,可见试验菌株仍能够耐受一定的液酸度和胆盐浓度,在肠道内存活并定植,发挥良好的益生功能。
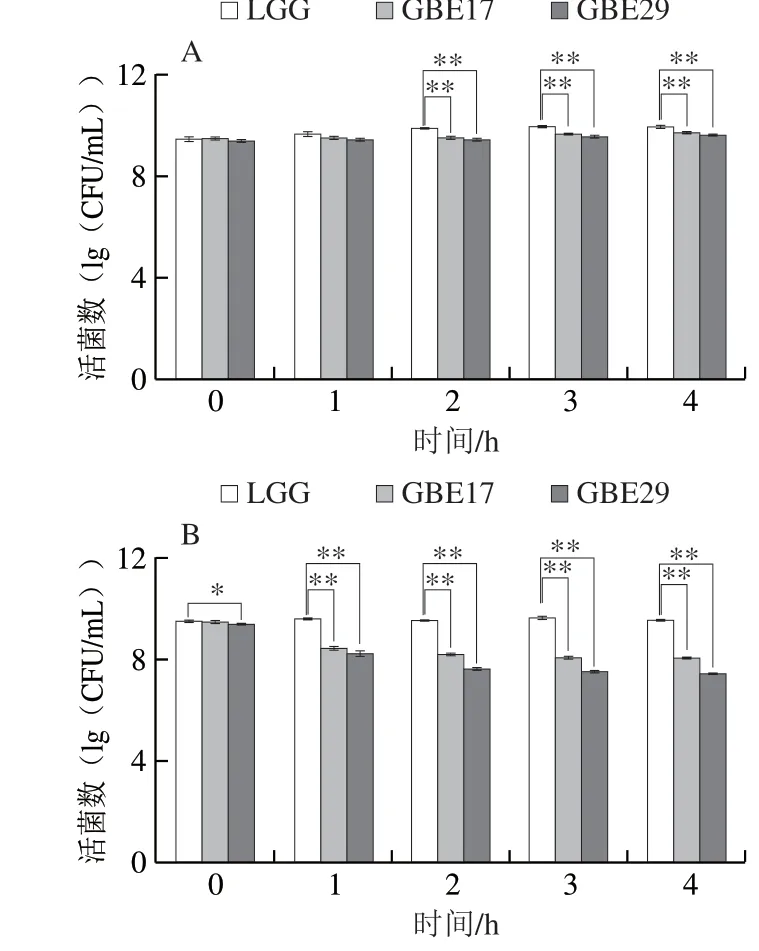

图 3 试验菌株对不同pH值和胆盐的耐受性Fig. 3 Acid and bile salt tolerance of Lactobacillus
2.4 植物乳杆菌GBE17和唾液乳杆菌GBE29对丙烯酰胺诱导Caco-2细胞损伤的保护作用
2.4.1 丙烯酰胺浓度对Caco-2存活率的影响
采用浓度为0.0(空白对照组)、1.25、2.5、5.0、10.0、20.0 mmol/L丙烯酰胺处理Caco-2细胞24 h,构建氧化损伤细胞模型,结果如图4所示。
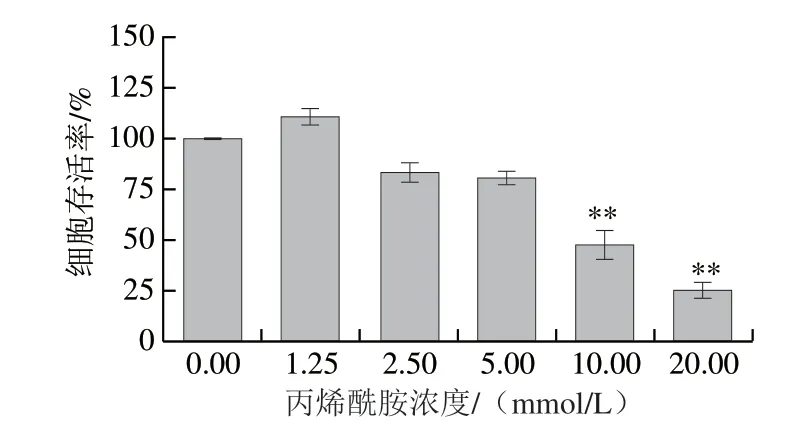
图 4 丙烯酰胺对Caco-2的氧化损伤Fig. 4 Acrylamide induced oxidative damage in Caco-2 cells
由图4可知,1.25 mmol/L丙烯酰胺处理24 h可刺激细胞的增殖,这与陆惠萍[17]和沈洋[18]的研究结果一致,可能与低浓度的丙烯酰胺刺激细胞生长的信号通路有关。2.5、5.0、10.0 mmol/L及20.0 mmol/L的丙烯酰胺均可对Caco-2细胞造成不同程度的损伤,表现在Caco-2存活率降低,且存活率与丙烯酰胺呈剂量相关性变化。经计可得,丙烯酰胺对Caco-2细胞的半致死剂量约为9.80 mmol/L,因本实验选取9.80 mmol/L丙烯酰胺作为最佳诱导浓度,构建Caco-2氧化损伤模型,时细胞存活率为50%。
2.4.2 试验菌株对氧化损伤的细胞形态学的影响

图 5 分组处理后Caco-2细胞形态图(×400)Fig. 5 Morphology of Caco-2 cells subjected to different treatments (× 400)
由图5可见,正常的Caco-2细胞贴壁生长,细胞形态呈铺路石状,无接触抑制,密度均匀。经9.80 mmol/L丙烯酰胺作用24 h后,部分细胞漂浮,细胞出现皱缩、变圆或椭圆形,折光率增强,细胞成团或簇状分布[17],表明细胞受到严重不可逆的损伤。植物乳杆菌GBE17上清组和干预组对Caco-2细胞造成的损伤程度较模型组明显减小,细胞形态更为正常,大部分细胞贴壁,皱缩程度减轻,密度均匀。由可知,植物乳杆菌GBE17上清组和干预组均可保护细胞膜的完整性,减轻丙烯酰胺所致Caco-2细胞的氧化损伤。
值得注意的是,形态学方法无法观察到乳酸菌上清组与干预组以及各菌株之间的显著差异,且乳酸菌完整菌体组因乳酸菌菌体的干扰,无法观察到Caco-2细胞,因具有一定的局限性。为了进一步探究不同乳酸菌及其发酵产物对Caco-2细胞抗氧化损伤的干预及保护作用,对细胞培养上清液、细胞裂解液中的抗氧化物酶和抗氧化物质进行测定。
2.4.3 细胞培养上清液及细胞裂解液的抗氧化活性
细胞在凋亡或者坏死过程中细胞膜的结构会遭到破坏,致使胞浆内的LDH释放到培养液中,胞外LDH水平在一定程度上能反映出细胞受损程度,因而常作为判断细胞氧化损伤程度的重要参数[16]。抗氧化防御系统中的SOD可清除超氧离子自由基,使之发生歧化反应,生成氧化活性较低的H2O2和H2O,是细胞防御氧化应激最主要的作用。CAT是防止氧化酶氧化失活的一种重要酶类,也可同其他氧化酶将H2O2还原成H2O,减少机体的损伤。GSH是一种低分子自由基清除剂,是谷胱甘肽过氧化酶(glutathione peroxidase,GPX)、谷胱甘肽巯基转移酶(glutathione S-transferase,GST)2 种酶的底物,为这2 种酶分解氢过氧化物所必需[19]。通过以上指标的测定,可以很好地反映出对细胞氧化损伤的保护作用。
针对胞外上清液中LDH测定结果(表5)显示,氧化损伤组中Caco-2上清液LDH活性(12.22 U/L)显著高于空白对照组(1.11 U/L),表明9.80 mmol/L的丙烯酰胺对Caco-2细胞造成了损伤,破坏了细胞膜结构,胞内LDH释放到上清液中,模型建立成功;VC阳性对照组、乳酸菌治疗组(除去GBE29上清组)及干预组均显著低于氧化损伤组,表明乳酸菌可以保护丙烯酰胺所致的Caco-2细胞氧化损伤。

表 5 细胞上清液的抗氧化活性Table 5 Antioxidant capability of cell culture supernatants
针对Caco-2胞外上清液的SOD、CAT测定结果 (表5)显示,乳酸菌治疗组活细胞组>乳酸菌干预组> 乳酸菌治疗组上清组,这些处理组的SOD、CAT活性不仅显著高于模型损伤组(0.55、0.05 U/mL),还显著高于阳性对照组(1.04、0.14 U/mL)及空白处理组(1.88、3.03 U/mL)。其中,乳酸菌治疗组中GBE17及GBE29活细胞的SOD活性分别高达9.62 U/mL和8.77 U/mL, CAT活性分别高达4.14 U/mL和4.67 U/mL。对于同一株菌而言,乳酸菌治疗组中,各菌株活细胞的SOD、CAT水平显著高于各对应菌株的上清液组,可能因为活细胞结构完整,其胞内包含了一整套抗氧化酶系统,其抗氧化作用高于胞外分泌物。对于不同菌株而言,SOD水平的高低不能反映CAT水平的高低,如乳酸菌干预组中,GBE17的SOD水平显著低于GBE29,但CAT水平却高于GBE29。因细胞内自身的抗氧化酶系统的内源性调节是个极为复杂的过程[18],不同的抗氧化酶发挥其抗氧化作用的方式和清除能力也不同,所以者水平的高低之间无必然联系。
针对Caco-2胞外上清液的非酶抗氧化物质GSH测定结果(表5)显示,乳酸菌治疗组中GBE17和GBE29的活细胞组显著高于氧化损伤组(1.35、1.14 μmol/L)。 上清组中,GBE29的GSH水平虽然小于氧化损伤组,但差异不显著,不具有统计学意义(P>0.05)。乳酸菌干预组中GBE17和GBE29的GSH水平(2.54、2.23 μmol/L)显著高于氧化损伤组(1.35 μmol/L)。同时研究发现,在乳酸菌治疗组中,GBE17上清组的SOD、CAT和GSH水平高于GBE29,LDH水平低于GBE29,这与GBE17的体外DPPH自由基清除率高于GBE29相吻合,提示体外DPPH自由基清除率可能反映体内的抗氧化酶和抗氧化物质水平,关于其具体的关系需要进一步地探讨。
为了检测胞内抗氧化物质和酶活的变化,对各处理组中细胞裂解液进行测定。针对细胞裂解液中的SOD测定结果(表6)显示,GBE17和GBE29治疗组及预防组均显著高于氧化损伤组。针对CAT测定结果显示,虽然GBE17、GBE29完整菌体组和GBE29上清组的水平低于氧化损伤组,但差异不显著,不具有统计学意义 (P>0.05)。结果表明,当细胞受到氧化损伤时,GBE17和GBE29能够通过提高胞内抗氧化酶SOD活性,减轻丙烯酰胺造成的细胞氧化损伤。
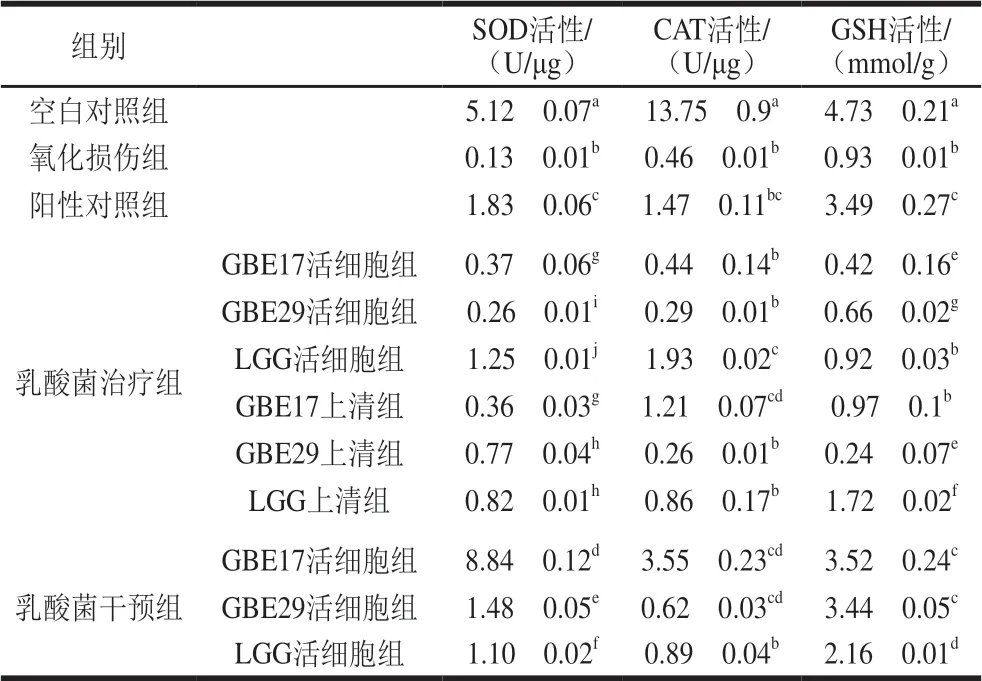
表 6 细胞裂解液的抗氧化活性Table 6 Antioxidant capability of cell lysates
针对非酶抗氧化物质GSH测定结果发现,GBE17、GBE29完整菌体组和GBE29上清组均显著低于氧化损伤组(P<0.05)。已有研究表明,当受到酸、冷迫时,细胞通过消耗少量的GSH抵御迫[20-21],因推断当细胞受到氧化迫时,GSH同以“自杀式”消耗方式发挥其在迫条件下的保护作用,关于GSH在氧化迫条件下发挥其作用方式的具体机制还需更深入地研究[15,22-23]。研究发现,因菌株具有菌种特异性,其抗氧化物质存在的部位不同、清除自由基的活性成分不同[24-25],对于丙烯酰胺诱导的Caco-2细胞氧化损伤的治疗与预防效果也大不相同,因不能判断何种方式对细胞的保护效果最佳。
综上所述,当细胞受到丙烯酰胺诱导的氧化损伤时,GBE17的治疗组与干预组和GBE29的干预组均可降低LDH的释放,提高细胞内外抗氧化酶SOD、CAT活性。可能通过消耗部分非酶抗氧化物质GSH保护氧化损伤的细胞,体外DPPH自由基清除率结果可能反映出体内的抗氧化酶和抗氧化物质水平。
3 结 论
本研究通过测定不同乳酸菌的无细胞发酵上清液及细胞内容物的DPPH自由基清除率,筛选出2 株抗氧化能力强的菌株,为植物乳杆菌GBE17和唾液乳杆菌GBE29,其自由基清除能力远高于ATCC标准菌株。细胞形态观察及细胞内外的抗氧化物活性测定结果表明,丙烯酰胺可以导致肠上皮细胞的氧化损伤,GBE17的治疗组与干预组和GBE29的干预组均可降低LDH的释放,提高细胞内外抗氧化酶SOD、CAT活性。同时两株乳杆菌在pH 3.0和胆盐质量分数0.1%的环境下处理4 h,存活数均高于107CFU/mL,综上所述,植物乳杆菌GBE17和唾液乳杆菌GBE29对丙烯酰胺引起的细胞氧化损伤具有明显的抑制作用,能够改善丙烯酰胺导致的肠道损伤。本研究结果为预防和缓解丙烯酰胺致毒提供了新的思路和方法,同时为开发功能性乳酸菌提供一定的科学依据。

