DTI 在颅脑胶质瘤术前分级中的应用
潘 虹,陈燕萍,易云平
(1.广州中医药大学第二附属医院影像科,广东 广州 510120;2.南方医科大学南方医院影像科,广东 广州 510515)
胶质瘤是颅内最常见的原发性肿瘤,其特点为肿瘤沿白质纤维束呈浸润性生长,且与正常脑组织无明显分解;偏良性者生长较缓慢,病程长,而恶性肿瘤生长迅速,病程短。因此,胶质瘤的术前准确分级对于临床治疗具有重要意义。fMRI 越来越多地运用于临床,如PWI、DTI、扩散峰度成像、SWI、体素内不相干运动(IVIM)及MRS 等不仅可提供精细的解剖学信息,还可提供功能和代谢方面的信息。近年来已有部分学者运用DTI 研究胶质瘤术前分级,但其准确性尚无定论。本文通过分析经手术病理证实的40 例胶质瘤的DTI 图像及其相关参数,探讨DTI 在颅脑胶质瘤术前分级中的应用价值,为胶质瘤的术前分级及治疗方案的选择提供相关影像学依据。
1 资料与方法
1.1 一般资料 收集广州中医药大学第二附属医院2017 年1 月至2018 年6 月经手术病理证实且资料完整的40 例颅脑胶质瘤,均行常规MRI 平扫+增强扫描及DTI 检查;男21 例,女19 例,年龄13~63岁,平均40.5 岁。临床主要症状:颅高压症状,如头痛、头晕、呕吐等,部分患者继发肢体运动障碍和感觉异常、癫痫发作及局灶性神经缺失症状。
根据WHO 2016 版中枢神经系统肿瘤分级标准,将40 例分为高级别组18 例和低级别组22 例,其中WHO Ⅲ~Ⅳ级为高级别组,WHO Ⅰ~Ⅱ级为低级别组(表1)。
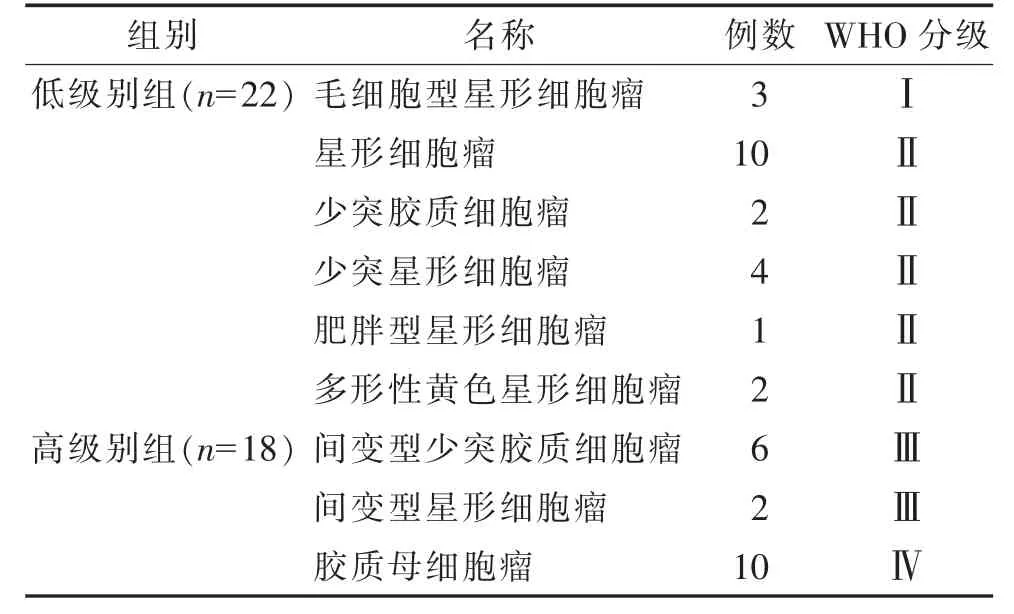
表1 40 例颅脑胶质瘤具体病理分型及分级
1.2 仪器与方法 采用GE Signa Excite HD 3.0 T超导MRI 扫描仪,头颅线圈,常规扫描序列包括轴位T2WI、轴位T1WI、轴位压水序列、冠状位T2WI 和矢状位T1WI;增强扫描序列为矢状位、描轴位、冠状位T1WI。
DTI 扫描参数:采用SE-EPI 序列TE 85 ms,TR 12 000 ms,25 个扫描方向,FOV 240 mm×240 mm,矩阵192×192,b 值为0 和1 000 s/mm2,层距1.5 mm,层厚5.0 mm。
1.3 DTI 图像后处理及分析 将DTI 原始数据导入后处理工作站,对DTI 数据校正后,得到相应ADC图及FA 图,参考病灶横轴位T1WI、T2WI 及增强T1WI图像,区分肿瘤强化明显的实性部分和瘤周水肿区,主要测量肿瘤周边1 cm 内的水肿;测得上述ROI 的ADC 值及FA 值。
1.4 统计学分析 采用SPSS 13.0 统计学软件对2组肿瘤实性部分和瘤周水肿区DTI 参数进行统计学分析。2 组瘤周水肿及肿瘤内囊变坏死发生率比较行χ2检验;2 组年龄及肿瘤实性部分、瘤周水肿区ADC值、FA 值比较行两独立样本t 检验。以P<0.05 为差异有统计学意义。
2 结果
高级别胶质瘤的发病年龄高于低级别胶质瘤(P<0.05)。高、低级别胶质瘤均可发生囊变坏死及瘤周水肿,发生率差异均无统计学意义(均P>0.05)(表2)。

表2 2 组囊变坏死、瘤周水肿发生率及发病年龄比较
高级别肿瘤实性部分ADC 值低于低级别肿瘤实性部分(P<0.05),而瘤周水肿区ADC 值高于低级别肿瘤(P<0.05);高级别肿瘤实性部分及瘤周水肿区FA 值均低于低级别肿瘤相应区域(均P<0.05)(表3,4)。
高级别胶质瘤实性部分与瘤周水肿区FA 值差异无统计学意义(P>0.05)。
2 组MRI 平扫、增强扫描及DTI 表现见图1,2。
3 讨论
胶质瘤是颅内最常见的原发性肿瘤,在组织学上按恶性程度可分为4 级,其中Ⅰ~Ⅱ级为低级别肿瘤,偏良性,生长缓慢;Ⅲ~Ⅳ级为高级别肿瘤,偏恶性,生长迅速,侵袭性高,易侵犯瘤周脑组织;因此胶质瘤恶性程度不同,其临床治疗方法也有差异,且预后明显不同;通常低级别肿瘤采取手术切除,预后多较好,多无需辅助放化疗[1],而高级别肿瘤侵袭性高,预后较差,无论切除与否,均需采取辅助放化疗,所以术前确定胶质瘤的级别对治疗和预后具有重要意义。
表3 2 组不同区域ADC 值差异性比较(×10-3 mm2/s,±s)

表3 2 组不同区域ADC 值差异性比较(×10-3 mm2/s,±s)
表4 2 组不同区域平均FA 值差异性比较(±s)
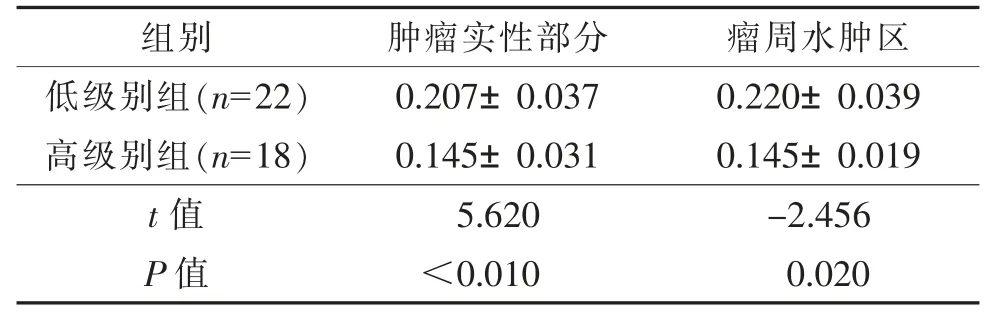
表4 2 组不同区域平均FA 值差异性比较(±s)
传统MRI 通过分析肿瘤生长特点、是否出血、强化程度等征象,可初步判断肿瘤级别,但准确率不高,仅55.0~83.3%[2]。DTI 能无创反映活体内水分子运动,可从量和方向上反映活体脑组织内水分子的扩散特征,通过后处理技术,有效评价脑白质的各向异性[3-4],其中细胞外间隙的大小主要由ADC 值反映,白质纤维束的完整性主要由FA 值体现。胶质瘤由于浸润性生长,相应脑组织及神经纤维束的完整性受到破坏,导致水分子扩散能力及各向异性发生不同程度变化;通常情况,恶性程度越高,相应脑组织及神经纤维束破坏越严重;同时肿瘤细胞极易侵犯周围正常脑组织,导致瘤周水肿[5-7]。
国内外已有研究通过DTI 技术评价胶质瘤肿瘤级别,但结论尚不统一。韩武等[8]发现,高级别胶质瘤肿瘤实性部分的FA 值高于低级别肿瘤实性部分,而ADC 值低于低级别肿瘤区;徐晨阳等[9]发现,瘤周水肿FA 值与ADC 值均低于低级别肿瘤。王佳等[10]发现,高、低级别胶质瘤肿瘤实性部分ADC 值无差异,高级别肿瘤实性部分FA 值低于低级别肿瘤;而Lee 等[11]研究发现,高、低级别神经胶质瘤FA 值无显著差异,原因可能是未精确测量肿瘤不同区域的FA 值,因为FA 值与诸多因素有关,如细胞外间隙含水量、肿瘤细胞密度程度、肿瘤细胞是否浸润瘤周水肿区、肿瘤细胞破坏白质纤维束程度、轴突结构是否崩解及细胞外基质成分[12]。
本研究结果显示:高级别胶质瘤的肿瘤实性部分及瘤周水肿区FA 值和ADC 值与低级别胶质瘤相应区域的FA 值和ADC 值差异均有统计学意义(均P<0.05)。①高级别胶质瘤实性部分及瘤周水肿区FA 值较低级别胶质瘤相应区域FA 值低;有研究[11]认为,这与肿瘤细胞中神经轴突排列顺序和方向性的丧失及神经纤维髓鞘结构丢失、肿瘤细胞微结构的破坏有关;在特定方向上,病变组织中水分子各向异性能力减低与限制水分子运动的细胞膜和髓磷脂鞘减少有关。②高级别胶质瘤实性部分ADC 值低于低级别胶质瘤实性部分ADC 值,这与肿瘤细胞分布及排列有关,高级别肿瘤核浆比更高、细胞间隙更小、肿瘤细胞异质性更高及倍增时间更短,均造成水分子弥散愈发受限;高级别胶质瘤瘤周水肿区(本研究仅讨论瘤周1 cm 内的水肿)ADC 值高于低级别胶质瘤瘤周水肿ADC 值,这是由于瘤周水肿区ADC值大小主要与血管源性水肿、水肿区肿瘤细胞数量、水肿区髓鞘破坏严重程度的综合作用所致;高级别肿瘤瘤周水肿区受肿瘤侵犯,细胞外间隙增宽,髓鞘破坏严重,产生的血管源性水肿占主导作用,水分子受限程度减低较低级别肿瘤明显。上述结果与高兴锋等[3,13]研究结果基本一致。
综上所述,DTI 检查通过测量肿瘤不同区域的FA 值和ADC 值,能有效区分脑胶质瘤的级别,可为临床治疗方案的选择提供影像学依据。本研究不足之处:颅内胶质瘤种类多样,本研究未囊括所有病种,且样本量相对较少,测量数据会有一定误差,有待扩大样本量进一步研究;高、低级别肿瘤坏死囊变区FA 值有差异,可能与其成分有关,有待进一步分析。

图1 女,32 岁,毛细胞型星形细胞瘤(WHO Ⅰ级),肿瘤位于右侧半卵圆中心近大脑镰,信号不均匀 图1a T1WI 呈不均匀低信号 图1b T2WI 呈不均匀高信号 图1c 增强扫描明显不均匀强化,周围见小片状水肿区无强化 图1d ADC 图呈不均匀高信号 图1e FA 图示肿瘤及周围水肿区FA 值减低图2 男,61 岁,胶质母细胞瘤(WHO Ⅳ级)。肿瘤位于左侧颞枕叶,信号不均匀 图2a T1WI 呈不均匀等稍低信号 图2b T2WI 呈不均匀高信号 图2c 增强扫描明显不均匀强化,周围斑片状水肿无强化 图2d ADC 图呈不均匀稍高信号 图2e FA 图示肿瘤及周围水肿区FA 值减低

