候选无细胞百白破-Sabin株灭活脊髓灰质炎联合疫苗在大鼠上的免疫保护效果研究
姬秋彦,江文文,梁疆莉,顾琴,高娜,马艳,牟大超,史荔,孙明波
论著
候选无细胞百白破-Sabin株灭活脊髓灰质炎联合疫苗在大鼠上的免疫保护效果研究
姬秋彦*,江文文*,梁疆莉,顾琴,高娜,马艳,牟大超,史荔,孙明波
650118 昆明,中国医学科学院北京协和医学院医学生物学研究所云南省重大传染病疫苗研发重点实验室
观察候选无细胞百白破-Sabin 株灭活脊髓灰质炎联合疫苗(DTaP-sIPV)在大鼠中的免疫保护效果,为疫苗临床前研究提供依据。
将候选疫苗 DTaP-sIPV、无细胞百白破-灭活脊髓灰质炎-b 型流感嗜血杆菌联合疫苗(DTaP-IPV/Hib)、吸附无细胞百白破-b 型流感嗜血杆菌联合疫苗(DTaP/Hib)、百日咳疫苗效力参考品(全细胞疫苗,wP)按 0、30、60 d 3 剂免疫程序免疫 Wistar大鼠,检测各组大鼠每剂免疫后的血清中各组分抗体水平。在免疫完成后 3 周,用百日咳 18323 株通过气雾攻击的方式感染大鼠。在感染后的第 3、7、14、21 和 28 天检测各组白细胞数、肺部菌落克隆形成数以及百日咳疫苗组分抗体变化水平。
候选疫苗组 3 剂次免疫完成后 PT 抗体几何平均滴度(GMT,log2)为16.74,FHA 抗体 GMT 为18.44,PRN 抗体 GMT 为 10.75,DT 抗体GMT 为 17.34,TT 抗体 GMT 为 17.84,针对 3 种 Sabin 脊髓灰质炎病毒株(I、II 和 III 型)的抗体的 GMT 分别为 7.57、8.41 和 9.70,均达到 100% 阳转。候选疫苗抗原组分抗体除了 PRN 和 I 型 IPV 外,其他组分抗体水平均与疫苗对照组相比无显著性差异。在基础免疫完成后 3 周对大鼠进行百日咳杆菌气雾攻击,各疫苗组均表现较好的保护效果,白细胞水平都呈现平稳状态,虽然在肺部也检测到少量细菌定植,但各疫苗组间差异不明显,且在感染后第 28 天都清除至检测限;而空白对照组在肺部则检测到了大量细菌定植,且在感染后第 28 天都并未清除至检测限,百日咳特异性的 FHA 和 PRN 抗体在感染后的第 14 天也出现了相应的升高。
候选疫苗在 Wistar 大鼠模型上具有较好的免疫保护效果。
无细胞百白破-Sabin株脊髓灰质炎联合疫苗; 免疫; 感染; 保护效果
百日咳是一种主要由百日咳博德特氏菌(Bordetella pertussis)引起的急性呼吸道传染病。疫苗使用之前,百日咳是全球婴幼儿死亡的主要原因[1]。20 世纪 30 年代研制成功的全菌体百日咳疫苗(whole-cell pertussis vaccine,wP)在 40 年代得到大规模的使用,大大降低了百日咳的发病率和死亡率[2]。到 70 年代,发达国家几乎消除了百日咳[3]。由于全菌体百日咳疫苗副反应较强,90 年代,含百日咳毒素(pertussis toxin,PT)和丝状血凝素(filamentous haemagglutinin,FHA)或少量百日咳杆菌黏附素(pertactin,PRN)等组分的无细胞百日咳疫苗(acellular pertussis vaccine,aP)上市后便广泛替代 wP 使用至今[4]。aP 的不良反应发生率低于 wP,而且其抗体反应和诱导的保护时间比 wP 更快[5-6]。aP 根据抗原纯化工艺的不同,又分为共纯化疫苗和组分疫苗。组分苗相对于共纯化苗可更好地控制抗原成分的组成、含量和质量[7-9]。我国目前使用共纯化无细胞百日咳疫苗,国外进口组分苗价格昂贵,因此对自主研发的组分苗有强烈需求。本研究以中国医学科学院医学生物学研究所研制的无细胞百白破-Sabin 株脊髓灰质炎(脊灰)联合疫苗(DTaP-sIPV)组分苗和已上市的无细胞百白破-灭活脊灰-b 型流感嗜血杆菌联合疫苗(DTaP-IPV/Hib)组分苗、吸附无细胞百白破-b 型流感嗜血杆菌联合疫苗(DTaP/Hib)共纯化苗以及国家百日咳效力参考品(wP)分别免疫 Wistar 大鼠,在 3 针基础免疫后,采用百日咳杆菌气雾攻击,通过抗体水平、菌落清除时间、白细胞数等指标评价新研制 DTaP-sIPV 组分苗的免疫应答和保护效果。
1 材料与方法
1.1 材料
1.1.1 疫苗 DTaP-sIPV 由中国医学科学院医学生物学研究所自主研制,制备工艺简述如下:将百日咳杆菌、白喉杆菌、破伤风梭状杆菌分别经发酵、柱层析提纯的百日咳抗原 PT、FHA 和 PRN 组分,精制白喉类毒素(DT)和精制破伤风类毒素(TT)分别用氢氧化铝佐剂吸附制成原液;将 Sabin 株脊灰病毒接种于微载体培养的 Vero 细胞,培养后收获病毒液,经纯化和甲醛灭活后制成单价病毒原液;将吸附好的 PT、FHA、PRN、TT、DT按照所需量加入,最后加入 sIPV I、sIPV II、sIPV III。DTaP-IPV/Hib 购自深圳赛诺菲巴斯德生物制品有限公司;DTaP/Hib 购自北京民海生物科技有限公司;第七代百日咳疫苗效力国家标准品(wP)购自中国食品药品检定研究院。各疫苗配方见表 1。
1.1.2 实验动物 SPF 级 Wistar 大鼠,180 ~220 g,7 ~ 9周龄,由中国医学科学院医学生物学研究所动物实验中心提供。
1.1.3 试剂 百日咳攻击菌(菌株号:18323/CMCC58030)购自中国食品药品检定研究院;兔抗大鼠辣根过氧化物酶标记抗体为美国 Abcam 公司产品;包被抗原 PT、FHA、PRN、DT、TT 为中国医学科学院医学生物学研究所保存;单组 TMB 底物显色液为中国索莱宝公司产品;Bordet-Gengou agar base 购自海博生物技术有限公司;脱纤维羊血购自南京乐诊生物技术有限公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1 实验动物免疫及感染 将 Wistar 大鼠随机分为 5 组(DTaP-IPV/Hib 组、DTaP/Hib 组、DTaP-sIPV 组、wP 组和空白对照组),每组 8 只,雌雄各半。分别经大鼠的左右腓肠肌进行接种,0.5 ml/剂。DTaP-IPV/Hib 和 DTaP/Hib 接种时分别只接种 DTaP-IPV 和 DTaP 抗原。每组每只大鼠注射 3 剂次,每剂次间隔 30 d,免疫前及每剂次免疫后 30 d 采血,分离血清,–20 ℃储存。在最后一次免疫的三周后对各组大鼠进行百日咳杆菌的呼吸道感染(1011CFU/ml)[10]。于感染后的 3、7、14、21 和 28 d 取样,每次 1 只/组,对肺部细菌进行计数。
1.2.2 血清抗体效价测定 通过 ELISA 法检测针对白喉、破伤风和百日咳的抗体anti-PT、anti-FHA、anti-PRN、anti-DT 和 anti-TT。免疫原性判定标准:以空白对照组血清的450均值的 2.1 倍为 Cutoff 值,450值≥ Cutoff 值孔的血清稀释度为抗体滴度,计算各组抗体的 GMT。根据世界卫生组织推荐的方法,由本所的质量控制实验室通过微中和试验测量I ~III 型脊髓灰质炎病毒的中和抗体[11]。
1.2.3 感染后白细胞计数 气雾攻击各组大鼠,于攻毒前、攻毒后 3、7、14、21 d 尾静脉采血,采全血 200 μl,EDTA 抗凝,血球计数仪检测白细胞数。
1.2.4 感染大鼠肺部菌落计数 每组每个采样点随机数字表法挑选 1 只大鼠,分离肺组织,称取

表 1 3 种含 DTaP 联合疫苗的抗原及佐剂配方
注:- 不含该成分;*DTaP中百日咳为共纯化疫苗,含 PT、FHA 和 PRN 组分,总含量为 9 μg 蛋白氮/剂。
Notes:- Does not contain this ingredient;*Pertussis in DTaP is a co-purified vaccine containing PT, FHA and PRN components with a total content of 9 μg protein nitrogen per dose.
1.3 统计学处理
采用 SPSS 22.0 软件进行数据分析。组间比较采用 One-way ANOVA 分析,以< 0.05 表示差异有统计学意义。
2 结果
2.1 免疫后抗体水平
3 针基础免疫后,与对照组相比,各无细胞疫苗组对百日咳、白喉和破伤风都产生了较高的体液免疫反应(图 1A)。在所有无细胞疫苗组中第一次免疫后便观察到了针对 PT、FHA、DT 和 TT 100%的血清阳转率(图 1B)。候选疫苗 DTaP-sIPV 组在第二次免疫后观察到针对 PRN 的血清转换率大于 80%,虽然略低于 DTaP/Hib 组和 wP 组,但在基础免疫完成后也达到了 100% 的血清阳转率(图 1B3)。候选疫苗 DTaP-sIPV 组在基础免疫完成后,anti-PT 的几何平均滴度(GMT,log 2)为 16.74,anti-FHA 的为 18.44,anti-PRN 的为 10.75,anti-DT 的为 17.34,anti-TT 的为 17.84,与 DTaP-IPV/Hib、DTaP/Hib 和 wP 疫苗对照组相比,除了 anti-PRN 外,诱导的疫苗 GMT 均没有显著性差异(> 0.05)。
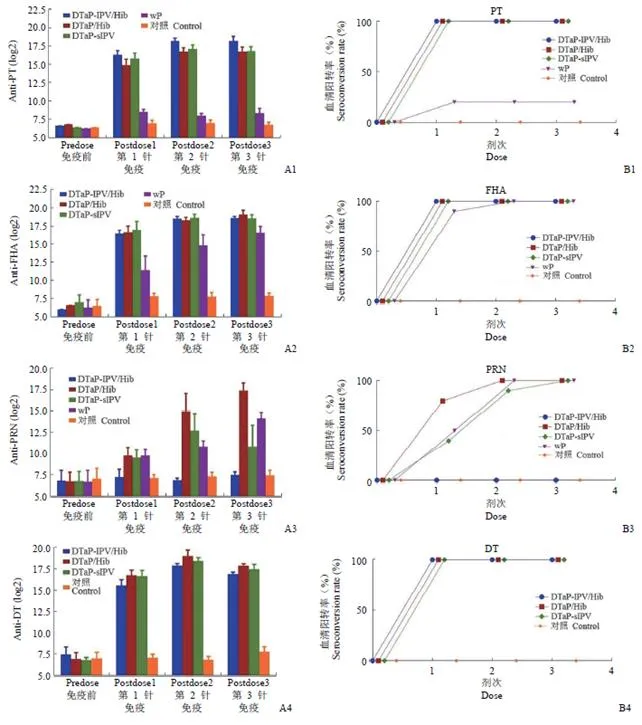
Figure 1 Dynamic profiles of the antibodies in rat immunized with the different vaccines [A:Antibody levels in serum (log 2);B:Seroconversion rates;*< 0.05,**< 0.01,***< 0.001]
候选疫苗 DTaP-sIPV 基础免疫完成后诱导的针对 3 种 Sabin 脊髓灰质炎病毒株(I、II 和 III 型)的抗体的 GMT(log 2)分别为 7.57、8.41 和 9.70;其中 I 型 IPV 的 GMT 与 DTaP-IPV/Hib 组相比稍低(< 0.05),II 型和 III 型的 GMT 与之相比无统计学差异(图 1A6-A8)。但在第一次免疫后,DTaP-sIPV 组针对 I 型 IPV 的中和抗体呈现 100%血清阳转率,高于 DTaP-IPV/Hib 组(图 1B6)。与 DTaP-IPV/Hib 组相比,DTaP-sIPV 组在第一次和第二次免疫后针对 II 型脊髓灰质炎病毒的血清阳转率均较低,但在第三次免疫完成后血清阳转率均达到了 100%(图 1B7)。针对 III 型 IPV,DTaP-IPV/Hib 和 DTaP-sIPV 组在第二次免疫完成后便达到了 100% 的血清阳转率(图 1B8)。
2.2 感染后大鼠白细胞变化和肺部菌落定植情况
百日咳杆菌气雾攻击小鼠后第 3 天,空白对照组白细胞数出现了明显的升高,并在感染后的第 7 天达到峰值,而各疫苗组白细胞呈平稳状态(图 2A)。此外,在感染后的第 3 天,空白对照组肺部检测到大量的百日咳杆菌存在,并在感染后第 7 天达到峰值,随后缓慢下降;其余 4 组疫苗组肺部也检测到少量百日咳杆菌的存在,且组间的肺部菌落克隆数无明显差异(图 2B)。
2.3 感染后针对百日咳组分抗体变化情况
所有无细胞疫苗组在每个时间点均诱导较高PT 抗体滴度且呈平稳状态,而 wP 不诱导 PT 的高抗体水平,这与空白对照组的 PT 抗体变化趋势一致(图 3A)。wP 组的 FHA 抗体水平在感染后的第 7 天略有升高之后趋于平稳,其余几组疫苗组在感染后的 FHA 抗体水平呈平稳状态(图 3B)。候选疫苗 DTaP-sIPV 组的 PRN 抗体水平在感染后的第 14 天到第 28 天明显升高(< 0.05),而其余几组疫苗感染后的 PRN 抗体水平呈平稳状态(图 3C)。空白对照组针对 FHA 和 PRN 的抗体滴度在感染后的第 14 天显著增加并且在随后的时间点仍保持高水平(图 3B-3C)。

图 2 各组感染后大鼠白细胞变化情况(A)和肺部百日咳杆菌菌落计数(B)(*P < 0.05,***P < 0.001)
Figure 2 The change of WBC (A) and colony counting (B) of five groups in post-infection (*< 0.05,***< 0.001)

Figure 3 Changes of antibody levels against vaccine components of pertussis in Wistar rats after infection (A:The change of anti-PT levels; B:The change of anti-FHA levels; C:The change of anti-PRN levels;*< 0.05,**< 0.01,***< 0.001 versus the 3rd day after challenge from the same group)
3 讨论
疫苗免疫后抗体水平是反映机体体液免疫的主要评价指标,本研究中对候选 DTaP-sIPV 的各组分抗体滴度进行了检测。结果显示在基础免疫完成后,对于百白破的 5 个组分 PT、FHA、PRN、DT 和 TT 来说,除 anti-PRN 外,候选疫苗 DTaP-sIPV 与 DTaP-IPV/Hib、DTaP/Hib 和 wP 疫苗对照组相比,诱导的 GMT 均没有显著性差异。对于 PRN 抗体,DTaP-IPV/Hib 配方里不含 PRN 组分,DTaP-sIPV 组在基础免疫完成后,anti-PRN 水平低于相应 DTaP/Hib 疫苗对照组。候选疫苗 DTaP-sIPV 与 DTaP/Hib 两种疫苗生产工艺不同,可能是造成这两种疫苗 anti-PRN 水平不同的原因之一。此外,疫苗组中只有 DTaP-IPV/Hib 组和候选疫苗 DTaP-sIPV 组含有 IPV 抗原,3 针免疫完成后,DTaP-IPV/Hib 组的 I 型 IPV 抗体滴度高于候选疫苗 DTaP-sIPV 组,而两组间的 II 型和 III 型 IPV 抗体滴度没有统计学差异。以上结果都说明候选疫苗 DTaP-sIPV 在大鼠体内具有较好的免疫原性,且疫苗各组分间无明显的干扰或减弱现象。
在基础免疫完成后,对各组大鼠进行百日咳气雾攻击,结果发现 4 个疫苗组能够抵御百日咳攻击,其白细胞呈现较平稳的状态,无明显升高,而空白对照组显示不能抵御百日咳攻击,其白细胞在感染后的第 3 天明显升高并在第 14 天达到峰值。此外,空白对照组在百日咳感染后肺部形成大量百日咳杆菌克隆,在感染后的第 7 天达到峰值,并且在感染后的第 28 天还未清除至检测限。而其余 4 组疫苗虽然大鼠肺部也检测到了少量百日咳杆菌的存在,但组间的肺部菌落克隆数无明显差异,并且在感染后的第 28 天已被清除至检测限。
另外,在百日咳杆菌感染后,我们还检测了各组大鼠血清中针对百日咳疫苗抗原特异性的抗体水平。各组的 PT 抗体基本呈现较平稳的状态;wP 组的 FHA 在感染后的第 7 天略有升高,随后保持平稳,空白对照组,在感染后的第 14 天出现了明显升高,并且随后的检测时间点一直保持较高水平,其余疫苗组在感染后未出现明显变化趋势;对于 PRN 抗体,除了对照组在感染后的第 14 天出现了明显升高外,候选疫苗 DTaP-sIPV 在感染后的第 14 天也出现了升高。这可能是由于前面所提到的 DTaP-sIPV 组在基础免疫完成后 PRN 抗体水平较低有关。PRN 由于其介导对呼吸道上皮的黏附作用,因而被包含在无细胞百日咳疫苗中[12-13]。尽管在临床试验中,含有 PRN 比不含 PRN 的无细胞疫苗更有效,但目前关于 PRN 及其特异性抗体的作用还不是很清楚[14-16]。
本研究在 Wistar 大鼠模型上评价了候选疫苗 DTaP-sIPV 的免疫原性和对百日咳杆菌感染的保护效果。实验结果表明,DTaP-sIPV 在大鼠上不仅能够诱导机体产生具有保护作用的抗体水平,还能够直接抵御百日咳杆菌气雾感染。总的来说,Wistar 大鼠模型评价结果显示,候选疫苗 DTaP-sIPV 免疫保护效果不劣于实验中所使用目前市售疫苗。
[1] Bouchez V, Guglielmini J, Dazas M, et al. Genomic sequencing of bordetella pertussis for epidemiology and global surveillance of whooping cough. Emerg Infect Dis, 2018, 24(6):988-994.
[2] Guiso N, Wirsing von Konig CH. Surveillance of pertussis:methods and implementation. Expert Rev Anti Infect Ther, 2016, 14(7):657- 667.
[3] Pertussis vaccines:WHO position paper. Wkly Epidemiol Rec, 2010, 85(40):385-400.
[4] Choe YJ, Park YJ, Jung C, et al. National pertussis surveillance in South Korea 1955-2011:epidemiological and clinical trends. Int J Infect Dis, 2012, 16(12):e850-e854.
[5] Pitisuttithum P, Chokephaibulkit K, Sirivichayakul C, et al. Antibody persistence after vaccination of adolescents with monovalent and combined acellular pertussis vaccines containing genetically inactivated pertussis toxin:a phase 2/3 randomised, controlled, non-inferiority trial. Lancet Infect Dis, 2018, 18(11):1260-1268.
[6] McGirr A, Fisman DN. Duration of pertussis immunity after DTaP immunization:a meta-analysis. Pediatrics, 2015, 135(2):331-343.
[7] Pan SN, Sheng YB, Xiao ZR. Status and development trend of pertussis vaccine in China. Prog Microbiol Immunol, 2012, 40(5):72-77. (in Chinese)
潘殊男, 盛玉博, 肖詹蓉. 中国百日咳疫苗的现状及研发趋势初探. 微生物学免疫学进展, 2012, 40(5):72-77.
[8] Wang LC, Hou QM, Zhang SM. Progress in research on combined vaccine home and abroad. Chin J Biologicals, 2012, 25(4):516-519. (in Chinese)
王丽婵, 侯启明, 张庶民. 国内外联合疫苗的研究新进展. 中国生物制品学杂志, 2012, 25(4):516-519.
[9] Vidor E, Soubeyrand B. Manufacturing DTaP-based combination vaccines:industrial challenges around essential public health tools. Expert Rev Vaccines, 2016, 15(12):1575-1582.
[10] Mou DC, Liang JL, Gao N, et al. Aerosol challenge model in murine by Bordetella pertussis. J Med Postgrad, 2017, 30(8):808-812. (in Chinese)
牟大超, 梁疆莉, 高娜, 等. 百日咳杆菌气雾感染小鼠模型的建立. 医学研究生学报, 2017, 30(8):808-812.
[11] Sun M, Ma Y, Xu Y, et al. Dynamic profiles of neutralizing antibody responses elicited in rhesus monkeys immunized with a combined tetravalent DTaP-Sabin IPV candidate vaccine. Vaccine, 2014, 32(9):1100-1106.
[12] Hewlett EL, Burns DL, Cotter PA, et al. Pertussis pathogenesis--what we know and what we don't know. J Infect Dis, 2014, 209(7):982-985.
[13] Martin SW, Pawloski L, Williams M, et al. Pertactin-negative Bordetella pertussis strains:evidence for a possible selective advantage. Clin Infect Dis, 2015, 60(2):223-227.
[14] Poolman JT, Hallander HO. Acellular pertussis vaccines and the role of pertactin and fimbriae. Expert Rev Vaccines, 2007, 6(1):47-56.
[15] Casey JR, Pichichero ME. Acellular pertussis vaccine safety and efficacy in children, adolescents and adults. Drugs, 2005, 65(10):1367-1389.
[16] Mattoo S, Cherry JD. Molecular pathogenesis, epidemiology, and clinical manifestations of respiratory infections due to Bordetella pertussis and other Bordetella subspecies. Clin Microbiol Rev, 2005, 18(2):326-382.
Immunoprotective effect of a candidate diphtheria, tetanus, acellular pertussis and Sabin strain inactivated poliovirus combined vaccine in rat model
JI Qiu-yan, JIANG Wen-wen, LIANG Jiang-li, GU Qin, GAO Na, MA Yan, MOU Da-chao, SHI Li, SUN Ming-bo
We aim to observe the immunoprotective effect of a candidate diphtheria, tetanus, acellular pertussis and Sabin strain inactivated poliovirus combined vaccine (DTaP-sIPV) in rat model for further preclinical research.
Candidate diphtheria, tetanus, acellular pertussis and Sabin strain inactivated poliovirus combined vaccine (DTaP-sIPV), diphtheria, tetanus, acellular pertussis, inactivated poliovirus and Haemophilus type b combined vaccine (DTaP-IPV/Hib), diphtheria, tetanus, acellular pertussis and Haemophilus type b combined vaccine (DTaP/Hib), and national potency standard for pertussis vaccine (whole pertussis vaccine, wP) were immunized with Wistar rats (8/group) according to the 0, 30, and 60-day immunization schedules. The serum antibody levels of each component in each group were measured. Three weeks post immunization, the rats were infected with pertussis 18323 via aerosol injection using aerosol apparatus. The numbers of white blood cells, bacterial counting of lung, colony-forming units (CFU) from the lung tissue and specific antibodies were detected at 3, 7, 14, 21 and 28 days after infection.
In the candidate vaccine group, the geometric mean titer (GMT, log2) of anti-PT, anti-FHA, anti-PRN anti-DT, and anti-TT was 16.74, 18.44, 10.75, 17.34, and 17.84, respectively. The GMT of the antibodies against the Sabin poliovirus strains (types I, II and III) were 7.57, 8.41 and 9.70, respectively, both achieving 100% positive conversion. In addition to PRN and type I - IPV, the antibody levels of the candidate vaccine antigen components were not significantly different from those of the vaccine control group. The rats were challenged withthree weeks after the completion of basic immunization. Each vaccine group showed better protection, and white blood cell levels were stable. Although a small amount of bacterial colonies were detected in the lung tissues, there no obvious difference in the vaccine groups, and the bacterial colonies were cleared to the detection limit on the 28th day after infection. However, a large number of bacterial colonies were detected in the lung tissues of the control group and they were not cleared to the detection limit on the 28th day after infection. And there was also a corresponding increase in pertussis-specific FHA and PRN antibodies on the 14th day after challenge.
The candidate vaccine shows a good immunoprotective effect in the Wistar rat model.
Diphtheria, tetanus, acellular pertussis and Sabin strain inactivated poliovirus combined vaccine; Immunization; Infection; Protective effect
SUN Ming-bo, Email:smb@imbcams.com.cn
10.3969/j.issn.1673-713X.2020.01.005
Author Affiliation:Yunnan Key Laboratory of Vaccine Research & Development on Severe Infections Diseases, Institute of Medical Biology, Chinese Academy of Medical Science & Peking Union Medical College, Kunming 650118, China
国家科技重大专项(2015ZX09101031);中国医学科学院医学与健康科技创新工程重大协同创新项目(2016-I2M-1-019)
孙明波,Email:smb@imbcams.com.cn
2019-08-02
*同为第一作者

