万古霉素药物暴露量阈值与肾毒性的相关性分析
张 韧, 陈 铭, 陆杰久, 吕春乐, 刘滔滔
万古霉素作为治疗耐甲氧西林金黄色葡萄球菌(MRSA)等细菌的一线抗菌药物已使用五十余载[1],但由于其治疗窗窄,临床中高剂量用药时易产生不良反应,其中肾毒性最为常见,其发生率达5%~35%[2],因此对高危患者进行治疗药物监测必不可少[3]。近年来有证据显示,药物暴露量可能较稳态谷浓度更能准确且灵敏地监测万古霉素相关肾毒性[4]。目前国外已出现对万古霉素药时曲线下面积(AUC)阈值相关研究的文献报道,但因人种、算法等差异使得万古霉素AUC的阈值跨度很大,尚未明确其与肾毒性相关的AUC范围[4-7],并且还未有针对中国人群的万古霉素与肾毒性相关AUC阈值的研究报道。为此,本研究利用分类和回归树(CART)分析并建立中国成人患者万古霉素与肾毒性相关的阈值,以达到在临床应用万古霉素时可更为准确地预测和评估其肾毒性的目的。
1 材料与方法
1.1 材料
1.1.1 病例选择 本研究按前瞻性队列研究进行设计,收集2018年5月-2019年1月在广西医科大学第一附属医院接受万古霉素静脉注射治疗的住院患者信息。该方案经医院伦理委员会批准,患者或患者家属知情并同意。
纳入标准:年龄>18岁,接受万古霉素静脉注射时间≥72 h,至少进行一次万古霉素稳态谷浓度测定。
排除标准:中性粒细胞绝对值<1 000×109/ L,弥散性血管内凝血,治疗前30 d内接受过万古霉素静脉注射治疗,血清肌酐(SCr)基线水平≥176.8 μmol/L,因肾衰竭末期需血液透析治疗或多器官衰竭,缺乏能判断肾毒性和估算AUC指标的患者及体重信息缺失患者。
1.1.2 药品、试剂与仪器 注射用盐酸万古霉素,规格:每瓶500 mg,批号:WM20181等。生产企业:Eli Lilly Japan K.Kseishin Laboratories;浙江医药股份有限公司新昌制药厂。万古霉素检测试剂盒:Emit®2000 Vancomycin Assay(Newark, DE, USA),生产批号:4W048ULJ4等。西门子Viva-E检测仪(Siemens Viva-E®Drug Testing System, Newark, DE, USA)测定万古霉素血药浓度,Hitachi 7600全自动生化分析仪(HITACHI 7600; Hitachi co., Ltd. Tokyo, Japan)测定生化指标。
1.2 方法
1.2.1 数据收集及观测指标 在患者接受万古霉素治疗时开始收集患者的人口学资料和临床资料,包括年龄(AGE)、体重(BW)、万古霉素给药方案、给药时间、血药浓度、采血时间及用药前和用药期间SCr和胱抑素C(CysC)等。
肾毒性定义[8]:①在万古霉素治疗的7 d内,连续2次检测结果提示SCr较用药前基线水平增加44.2 μmol/L或SCr升高≥50%;②万古霉素治疗48 h内SCr绝对值升高26.5 μmol/L。根据肾毒性发生与否,将患者分为肾毒性组和未发生肾毒性 组。
万古霉素血药浓度测定均采用相酶放大免疫法。SCr和CysC水平分别采用颗粒增强透射免疫比浊法和氧化酶法进行测定。患者的肾小球滤过率(GFR)由基于CysC的Hoek公式[9]进行估算。万古霉素暴露量通过本课题组建立并发表的一房室模型[10]进行贝叶斯最大后验概率法进行估算。其中AUCss0-24为稳态时万古霉素的AUC,万古霉素治疗中,3~5剂后达稳态。前期建立模型公式如 下:
CL(L·h-1)= [5.07×(GFR/105.5)0.524×(AGE/48.5)-0.309×(BW/60)0.491]
V(L)= 46.3
1.2.2 统计学分析 统计分析用SPSS 22.0软件完成。非正态分布资料采用中位数(四分位数)[M(P25,P75)]表示。通过CART进行万古霉素相关肾毒性AUC阈值的确定。CART衍生出的阈值预测性能和对万古霉素相关肾毒性的诊断价值由阴性、阳性预测值和受试者工作特征(ROC)曲线评估。
单因素分析:分类变量使用χ2检验或Fisher精确检验方法进行分析,连续变量采用Studentst检验或U检验进行分析。所有统计检验方法均用双侧检验,P<0.05表示差异有统计学意义。多因素分析:将单因素分析中P<0.05的变量纳入logistic回归分析,计算比值比(OR)及95%CI。
2 结果
2.1 一般资料
根据条件筛选,最终纳入155例成人患者,其中13例患者发生肾毒性(13/155),表1列出了发生肾毒性和未发生肾毒性患者的人口学和临床资料,并进行了双变量比较。未发生肾毒性组(142例)和肾毒性组(13例)患者,中位年龄分别为54(38,66)岁和48(36,60)岁(P=0.183);男/女分别为87/55例(61.3%,38.7%)和5/8例(38.5%,61.5%)(P=0.097);体重分别为60.0(52.0,68.0)kg和57.0(41.6,68.4)kg(P=0.420);两组患者SCr基线水平分别为65.0(54.0,80.0)μmol/L和63.0 (53.5,78.5)μmol/ L(P=0.496);两组间比较差异均无统计学意义(P>0.05)。肾毒性组患者AUC0-24、AUC24-48、AUCss0-24明显高于未发生肾毒性组,差异均具有统计学意义(P<0.05)。
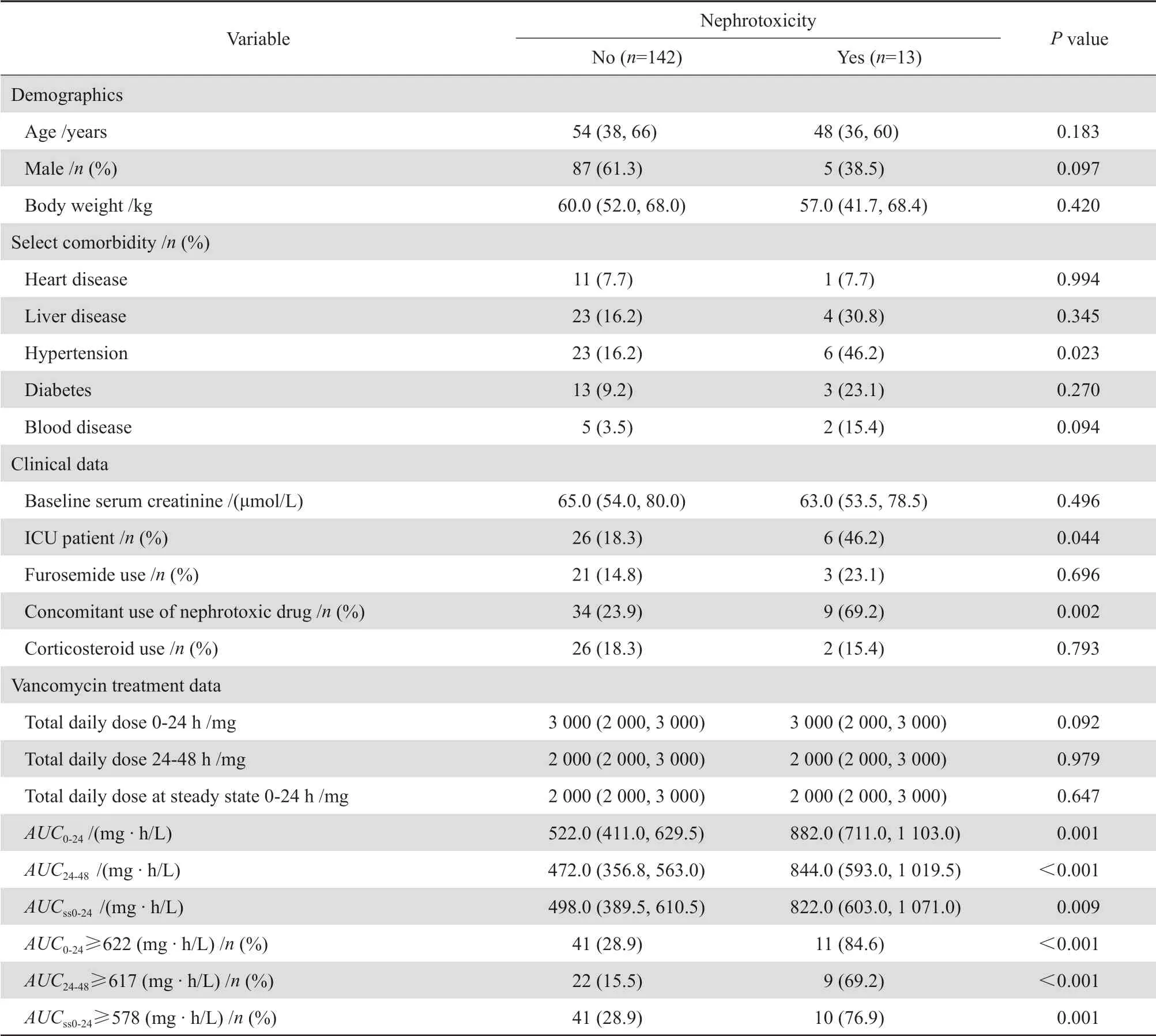
表1 肾毒性与非肾毒性患者人口学和临床特征的双变量比较Table 1 Bivariate comparison of demographic and clinical characteristics between nephrotoxic and non-nephrotoxic patients
2.2 万古霉素AUC阈值的判定
经C A RT 分析,万古霉素相关肾毒性在AUC0-24≥622 mg·h/L、AUC24-48≥617 mg·h/L、AUCss0-24≥578 mg·h/L的患者中发生率显著高于其他患者(表1,图1)。通过绘制ROC曲线以及阳性、阴性预测值评估CART衍生阈值对肾毒性的预测,见表2。因阴性预测值分布在96.5%~98.8%,差异较小,因此主要观察各阈值的阳性预测值,其中AUC0-24、AUC24-48、AUCss0-24在上述阈值处有最大的ROC曲线下面积和较高的PPV,因此最具预测性。且上述阈值点均具有较佳的灵敏度和特异 度。
2.3 万古霉素相关肾毒性的临床危险因素分析
根据单因素分析结果,患者是否有高血压病史、是否入住ICU、治疗中是否联用肾毒性药物等,两组差异均有统计学意义(P<0.05),见表1。
将单因素分析中差异有统计学意义的变量纳入至具有AUC0-24、AUC24-48、AUCss0-24阈值的logistic回归分析,结果显示:万古霉素AUC超过阈值(P≤0.01)和联合使用肾毒性药物(P<0.01)是发生万古霉素相关肾毒性的独立危险因素,差异具有统计学意义,见表3。

图1 由CART 分析确定AUC 阈值上下的肾毒性发生率对比Figure 1 Incidence of nephrotoxicity by classifi cation and regression tree (CART)-derived AUC thresholds

表2 由CART 衍生的肾毒性AUC 阈值的预测性能及诊断价值Table 2 Predictive performance and diagnostic value of CART-derived AUC toxicity thresholds
3 讨论
自万古霉素治疗药物浓度监测开展以来,其主要监测指标以谷浓度为主,目标谷浓度设定为10~20 mg/L。但有最新证据表明,万古霉素稳态谷浓度与治疗效果并无高度相关性,其对肾毒性的预测具有一定指导作用[11]。有多中心研究得到中国人群的万古霉素肾毒性相关的谷浓度阈值点为13 mg/L[12],然而谷浓度的评价标准存在一定不足,即过窄的治疗窗将会增大临床中平衡治疗效果和肾毒性风险的难度。Chavada等[4]研究显示,万古霉素AUC较谷浓度相比可更加准确且灵敏地预测肾毒性。近期国外研究中关于万古霉素药动学及药效学的证据也引发了将万古霉素治疗药物监测对象转变为AUC的趋势[3,13-15],但因AUC估算方法尚未统一且存在人种差异,导致研究所得的AUC阈值范围跨度较大(563~1 300 mg·h/L),该类型研究报道中尚未对万古霉素肾毒性相关的上限阈值进行定义,限制了对AUC监测的广泛实施。目前尚无对中国患者万古霉素肾毒性相关AUC上限阈值确定及建立的报道。
本研究结合前期建立的基于CysC的万古霉素群体药动学模型[10]与贝叶斯最大后验概率法来完成万古霉素初始剂量及稳态的AUC计算。由于SCr易受到年龄、性别、饮食等因素干扰,导致其在老年患者、营养不良患者、卧床患者等特殊患者的肾毒性监测中受到影响,而血清CysC受外界因素干扰小,且是一项优于尿素氮和SCr用于监测万古霉素早期肾损害的良好指标[16-22],因此在该研究中选择使用基于CysC建立的万古霉素群体药动学模型以更准确的估计患者万古霉素暴露量。
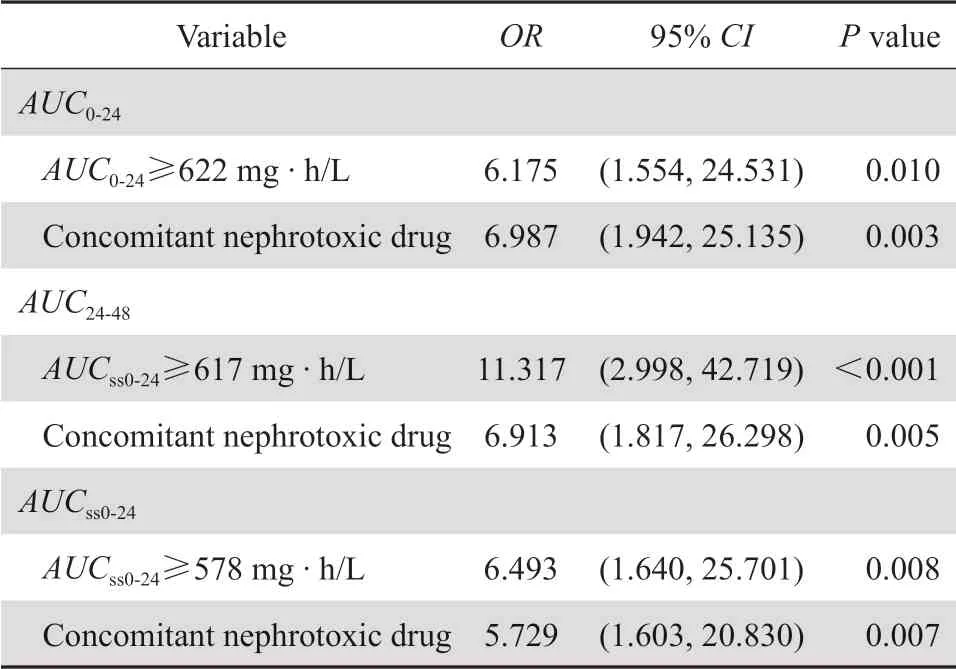
表3 万古霉素AUC 阈值与肾毒性的logistic 回归分析Table 3 Logistic regression analysis of the risk factors for vancomycin-related nephrotoxicity
通过CART分析得出其衍生出的多个阈值,通过阴性、阳性预测值和ROC曲线对其预测性能和诊断价值的比较,CART衍生出的阈值阴性预测值差异不大,在保证ROC曲线下面积大的同时选择阳性预测值较大的点。最终筛选出≥622 mg·h/ L、≥617 mg·h/L、≥578 mg·h/L分别作为AUC0-24、AUC24-48、AUCss0-24的肾毒性相关最佳阈值,AUC超过该阈值时肾毒性发生率显著提高。使用logistics回归分析量化了万古霉素暴露量超过阈值的风险,当AUC0-24、AUCss0-24超过各自阈值时,发生肾毒性的风险增加了6倍。AUC24-48超过阈值时,肾毒性发生风险增加了11倍。本研究万古霉素初始剂量暴露量阈值结果与Zasowski等[5]进行的多中心研究所得AUC0-24≥677 mg·h/L和AUC24-48≥683 mg·h/L相似,差异可能来自人种和所使用模型的差异。稳态万古霉素AUC阈值结果与Chavada等[4]研究所得阈值≥563 mg·h/L相似。
本组资料显示影响万古霉素肾毒性发生的相关因素除万古霉素暴露量外还可能与患者自身因素及药物联合使用相关。经单因素分析,患者有无高血压病史、是否入住ICU以及是否联用肾毒性药物均与万古霉素肾毒性的发生存在相关性,而患者的基线肾功能即SCr水平在两组中基本持平,差异无统计学意义,显示在本研究中该指标不能作为万古霉素肾毒性发生的独立风险因素。经logistic回归分析,显示联合使用肾毒性药物与万古霉素相关肾毒性的产生独立相关,可能会增加其5~6倍的发生风险。因此在万古霉素治疗中应对高危患者进行合理的药物联用,可有效降低肾毒性的发生风险。本研究为单中心研究,所得结果有一定局限性,未来可进一步完善多中心研究明确中国人群万古霉素AUC阈值。
综上所述,万古霉素AUC阈值与肾毒性的发生密切相关,其阈值的确定对万古霉素治疗药物监测的进行有重大临床意义,所以对AUC的监测将会成为往后万古霉素治疗药物监测工作的重点。将初始剂量的AUC和稳态时的AUC控制在所得阈值以下,可有效降低万古霉素相关肾毒性的发生率,以达到安全给药的目的。

