两株乳酸菌的发酵特性及在发酵驴肉肠中的应用
,*
(1.河北农业大学食品科技学院,河北保定 071001;2.承德市农产品加工服务中心,河北承德 067000;3.承德市农业农村局科教站,河北承德 067000)
肉类是我国饮食中的重要组成部分[1-2],驴肉营养丰富,古人将其喻为龙肉。研究显示驴肉的蛋白质含量、多不饱和脂肪酸含量、矿物元素铁(Fe)的含量高于人们日常食用的牛肉、猪肉、羊肉[3-4]。从营养学角度来看,驴肉的低脂肪、低胆固醇含量以及丰富的蛋白质含量,较高的胶原蛋白[5]是很理想的动物性食品。
发酵香肠,相较于未发酵的香肠,有着丰富的发酵滋味[6],弹性和咀嚼性均有显著增大。发酵使香肠的pH降低[7],从而使蛋白质的结构发生变化[8-9]。这一过程改变了香肠的内部结构,香肠的持水力发生改变,从而使得香肠的结构更致密,同时提高了其贮藏性[10-11]。发酵菌种的选择是影响发酵过程及发酵结果的重要因素,在李彩凤等[12-13]的研究中,明确了在保证发酵安全性的前提下,还需要考察菌种对发酵环境(盐浓度、硝酸盐浓度等)的适应性。故将所选菌种进行了生长曲线和产酸的测定。周才琼等[14-15]研究了自然发酵肉中存在的微生物,结果表明发酵肉中优势菌群主要是乳酸菌中的片球菌属和乳杆菌属,此类发酵微生物的增殖代谢活动直接影响酸肉风味的丰富性。Blom等[16]利用从干酪乳杆菌(Lactobacilluscasei,L.c)代谢产物中提取的蛋白酶加入到发酵香肠中,与添加发酵剂L.c的香肠做对比,产品风味基本无差别。戊糖片球菌(Pediococcuspentosaceus,P.p)在发酵香肠发酵过程中,不仅会快速降低发酵香肠的pH,还会增加香肠的蛋白质含量,优化香肠的口感,提升感官品质[17]。杨帆[18]的研究表明L.c在发酵肉中混合发酵可以使肉的pH快速降低,可以明显的抑制腐胺的生成,提高了发酵香肠的安全性。
本研究对P.p和L.c两种乳酸菌进行发酵试验,将所选菌种进行了生长曲线和产酸的测定,对菌种是否具有耐盐性、耐硝酸盐进行了试验,并探究了其能否作为混合发酵剂发酵驴肉香肠,然后以驴肉为发酵基料,研究发酵驴肉肠混合乳酸(LAB)发酵剂的菌液浓度、添加量、发酵温度、发酵时间,为进一步制作发酵驴肉肠提供更好的发酵剂。
1 材料与方法
1.1 材料与仪器
驴肉(2~3岁健康粉驴,卧宰,选用符合卫生检疫要求并解僵完成的新鲜驴肉) 河北河间朴康源驴肉制品有限公司;复合磷酸盐 河南隆霄生物科技有限公司;大豆分离蛋白(纯度98%) 天津市光复精细化工研究所;干酪乳杆菌、戊糖片球菌 河北农业大学菌种保藏实验室;乳酸细菌培养基(MRS) 北京奥博星生物技术有限责任公司;琼脂 索莱宝生物制剂有限公司;革兰氏染色液试剂盒 北京陆桥试剂有限公司;其他配料(如马铃薯淀粉、五香粉等) 均为食品级;所用溶剂均为国产分析纯。
MGB绞肉灌肠机 上海知信实验仪器技术有限公司;UV-2800紫外分光光度计 上海尤尼柯仪器有限公司;BH2-UMA光学显微镜 OLYMPUS;STARTER3100精密pH计 上海奥豪斯仪器有限公司。
1.2 实验方法
1.2.1 发酵剂特性测定
1.2.1.1 菌种活化 接种针蘸取菌液后在MRS平板上划线,35 ℃厌氧培养24 h,挑取单菌落接入10 mL MRS液体培养基,35 ℃静置培养24 h,取100 μL培养物用稀释平板法测定发酵液活菌数(CFU/mL)。将测得发酵液菌液浓度稀释至1×103CFU/mL后取100 μL接种于MRS培养液中35 ℃静置培养24 h,用稀释平板法测定发酵液活菌数(CFU/mL),待用[19-20]。
1.2.1.2 生长曲线的测定 将1.2.1.1中活化好的菌株以1%的接种量接入到MRS液体培养基中,于35 ℃培养,同时以新鲜的培养基为空白对照,每隔2 h于紫外分光光度计下660 nm处测定OD值,平行测定三次,取平均值[21]。
1.2.1.3 产酸率的测定 将P.p和L.c分别接种于MRS培养基,菌液浓度均为1×103CFU/mL,接入量为1%,于35 ℃,培养24 h,然后测量出pH的变化,来观察两种菌的产酸情况。
1.2.1.4 耐盐性的测定 在将活化好的菌株L.c和P.p按1%的接种量分别接入到添加不同含量(0%、2%、4%、6%)食盐的MRS培养基中,在35 ℃培养箱培养48 h,然后于紫外分光光度计下660 nm处测定OD值的变化,来判断两种菌的生长情况。
1.2.1.5 耐亚硝酸盐性的测定 用添加了不同梯度含量(0、50、100、150 mg/kg)亚硝酸盐的MRS培养基,将已知菌液浓度的L.c和P.p菌液浓度稀释至1×103CFU/mL后分别接种,接入量为1%于35 ℃培养24 h,然后于紫外分光光度计下660 nm处测定OD值的变化,来判断两种菌的生长情况。
1.2.1.6 相互作用 将活化好的菌种P.p和L.c以不同的混合比(10∶1、1∶1、1∶10)接入到MRS培养基中,接种量为1%,同时将P.p和L.c单独接入MRS培养基为对照,将已知菌液浓度的L.c和P.p菌液浓度稀释至1×103CFU/mL后分别接入P.p、L.c及P.p和L.c的混合菌(10∶1、1∶1、1∶10),接入量为1 mL(混合菌P.p和L.c各0.5mL)于35 ℃,培养48 h,然后测定其OD值和pH,来判断两种菌的生长情况。
1.2.2 发酵驴肉肠的制备
1.2.2.1 工艺流程

图1 工艺流程Table 1 Technological process
1.2.2.2 基础配方 瘦肉∶肥膘(9∶1),食盐2%,葡萄糖1%,大豆分离蛋白1.5%,亚硝酸钠0.01%,大蒜末0.1%,五香粉0.2%,味精0.05%,复合磷酸盐0.2%,姜粉0.5%,蔗糖1%,淀粉8%,水10%,不同比例和浓度的发酵菌液。
1.2.2.3 操作要点 将驴后腿、臀部肥瘦肉分离,去除瘦肉中可见筋膜、脂肪,将处理好的瘦肉和肥膘分别过6 mm孔板绞碎;将食盐、复合磷酸盐拌匀,加入瘦肉、肥膘质量比9∶1的肉中,混匀搅拌后于-4 ℃条件下腌制24 h,再加入其他配料,注意配料添加过程中大豆分离蛋白需复水后再加入;接种用喷壶均匀淋在肉馅表面;肉馅混匀搅拌8 min后送入灌肠机中灌制,每节肠15 cm左右;发酵时间12 h,温度在30~37 ℃度之间;烘烤温度控制在(65±1) ℃,烘烤480 min,然后将其放入温度为105 ℃的烤箱中焙烤10 min结束;将香肠自然冷却至室温后用经过紫外杀菌15 min的真空袋进行真空包装。

表2 发酵驴肉肠感官评分表Table 2 Sensory scoreTable of fermented donkey sausage
1.2.3 发酵驴肉肠发酵工艺的优化
1.2.3.1 混合发酵剂不同菌种配比对发酵驴肉肠品质的影响 发酵温度选取35 ℃,发酵时间为24 h,发酵剂菌液浓度为1×106CFU/mL,发酵剂添加量为1%,将P.p和L.c发酵剂按照体积比为4∶1、2∶1、1∶1、1∶2、1∶4进行发酵试验,探究不同菌种配比对发酵驴肉肠品质的影响。
1.2.3.2 混合发酵剂菌液浓度的对发酵驴肉肠品质的影响 发酵温度选取35 ℃,发酵时间为24 h,发酵剂添加量为1%,菌种配比为1.2.3.1的较适菌种配比,选取的发酵剂菌液浓度分别为1×103、104、105、106、107CFU/mL进行试验,探究不同菌液浓度发酵对发酵驴肉肠品质的影响。
1.2.3.3 混合发酵剂添加量对发酵驴肉肠品质的影响 选取1.2.3.1的较适菌种配比和1.2.3.2的菌液浓度,发酵温度选取35 ℃,发酵时间为24 h,探究发酵剂添加量(质量分数)1%、2%、3%、4%、5%、6%对发酵驴肉肠品质的影响。
1.2.3.4 混合发酵剂发酵温度对发酵驴肉肠品质的影响 选取1.2.3.1的较适菌种配比和1.2.3.2的菌液浓度和1.2.3.3的添加量,发酵时间为24 h,探究发酵温度分别为20、25、30、35、40 ℃对发酵驴肉肠品质的影响。
1.2.3.5 混合发酵剂发酵时长对发酵驴肉肠品质的影响 发酵剂菌种配比、菌液浓度、发酵温度和发酵剂添加量分别选取上述较佳水平,探究发酵时间分别为14、16、18、20、22、24 h对发酵驴肉肠品质的影响。
1.2.3.6 正交试验 根据以上单因素实验结果,固定发酵剂比例为1∶1,采用L9(34)正交表,以产品的pH和感官评价为最终指标来筛选出最佳的发酵工艺参数。正交试验的因素水平见表1。

表1 正交试验因素水平表Table 1 Factors and levelsTable of orthogonal test
1.2.4 感官指标的测定
1.2.4.1 pH的测定 参考GB 5099.237[22]的方法。
1.2.4.2 感官评分 接受过食品感官评价培训的研究生8名(4男4女)和2名老师组成感官评定小组,以形态、色泽、香气和滋味为指标,为发酵驴肉肠进行评分。选择下午三点进行评定试验,每次试验之前将发酵驴肉肠置于20 ℃培养箱中30 min。驴肉发酵肠感官评分表如下表2所示。
1.3 数据分析
采用IBM SPSS Statistics 22统计分析软件进行单因素方差分析(one-way ANOVA)和Duncan’s法显著性分析(P<0.05);用Microsoft Excel 2007软件绘制图表。重复测定3次,取平均值。
2 结果与分析
2.1 发酵剂特性测定
2.1.1 生长曲线 由图2可以得出,两种LAB的菌体密度随着培养时间的延长而逐渐增大,L.c在2 h后进入对数生长期,菌体密度迅速增多,在培养14 h后进入了稳定生长期,此时的菌体密度基本达到最大值,是菌体的最佳收获期。P.p在培养4 h后进入对数生长期,经过菌体数量快速累积后于16 h进入稳定生长期。P.p和L.c在肉汤培养过程中均经历了短暂的延滞期后开始指数式增长,这样有利于其在发酵过程中快速适应发酵环境,迅速发展成为优势菌群进行代谢产酸,抑制了其他杂菌或者有害菌的生长,保证发酵食品的安全性。又因为代谢作用形成代谢产物的累积以及原有成分的分解,赋予了制品特殊的发酵风味。

图2 两种LAB的生长曲线Fig.2 Growth curve during of two kinds of LAB
2.1.2 产酸率 乳酸菌分解营养物质产酸[23],由表3可以看出P.p在刚开始的4 h内pH下降缓慢,在4~16 h之间,pH由5.94下降到了4.62以下,在16 h之后pH缓慢的降低,L.c在最初的4 h内pH变化相较4~16 h不明显,在4~16 h内变化显著,pH迅速降低,而在16 h之后,变化不显著。此结果与Baka等结果一致[24-25],pH下降菌体处于延滞期时pH下降缓慢,在对数期内pH迅速下降,pH的变化情况和菌体生长情况趋势一致。由于菌体在此阶段快速生长,代谢速率加快,大量利用营养物质导致产酸显著增加,pH急速降低,当菌体的生长进入稳定生长期后,pH下降缓慢,此结果与樊明明等[26]的对发酵微生物产酸研究结果一致,由于微生物增殖代谢过程中消耗大量的营养物质且有某些代谢产物的累积,改变了其环境组成,不利于LAB进行大量增殖产酸活动的进行。
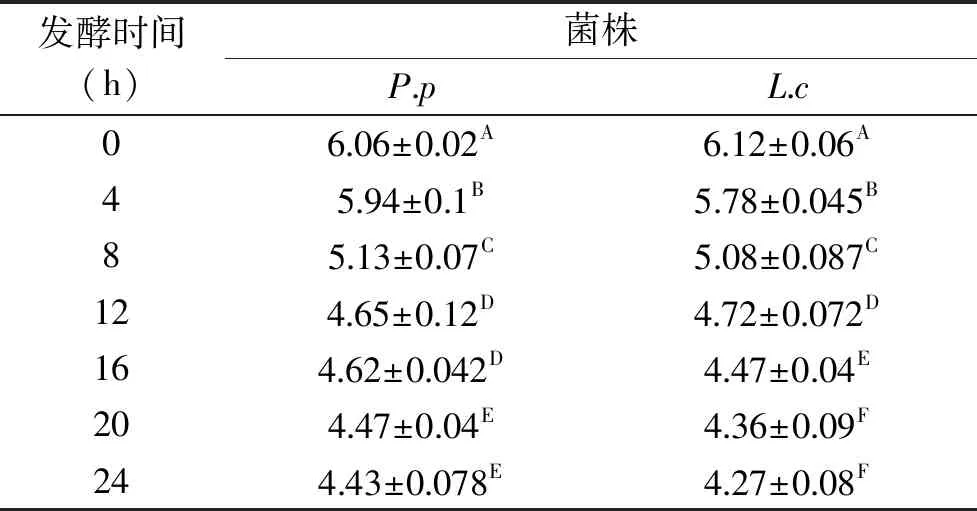
表3 两种LAB的pH变化Table 3 Changes on pH value of two kinds of LAB
注:同列不同大写字母表示差异极显著(P<0.01);表4、表5同。
2.1.3 耐盐性 由表4可知,P.p和L.c在0到6%的食盐含量中均可进行生长代谢,但每个梯度的吸光值有明显的降低,L.c在2%的食盐添加量下OD值下降了1%,在4%的食盐添加量下OD值下降了3%,在6%的食盐添加量下OD值下降了11%,不同添加量下的差异均极显著(P<0.01)。P.p在不同的食盐浓度梯度下,OD值也处于下降的趋势,在6%水平下OD值下降了16%,且在不同添加量食盐条件下,P.p的菌液浓度有极显著的差异(P<0.01)。这与Drosinos[27]的结果相同,高浓度食盐对P.p和L.c的生长代谢有着显著地抑制性。

表4 不同食盐浓度下两种LAB的OD值(660 nm)Table 4 OD value of two kinds of LAB at different salt concentrations(660 nm)
2.1.4 耐亚硝酸盐性 由表5可看出随着亚硝酸盐含量的增加,两种菌的OD值明显的减小,当亚硝酸盐含量为150 mg/kg时,L.c下降了20%,P.p下降了28%,且每个不同浓度梯度的OD值差异性极显著(P<0.01),说明较高亚硝酸盐对两株LAB的生长代谢有显著抑制作用,但于最大亚硝酸盐含量下,P.p和L.c的OD值为0.542和0.609,经涂布试验表明还有一部分菌存活。

表5 不同亚硝酸盐浓度下各菌的OD值(660 nm)Table 5 The optical density of various strains under different nitrite concentrations(660 nm)
2.1.5 相互作用 由表6可知,在不同比例混菌培养的条件下,菌株均可以进行生长、代谢产酸。相比于L.c和P.p的单菌培养,混菌培养的pH下降较慢,但在24 h之内也下降到了4.8左右,达到了常规要求的5.20以下,说明混菌培养可以满足在肉制品中发酵的条件。

表6 L.c、P.p以及混合菌种培养的pH变化Table 6 Changes on pH value of P.p,L.c and mixed LAB
注:同行肩标小写字母不同表示差异显著(P<0.05);表7~表11同。

表7 两种LAB的拮抗反应Table 7 Antagonism between two kinds of LAB
注:此表数值为菌液浓度的对数(lg CFU/mL)。

表8 不同配比发酵剂对发酵驴肉肠pH和感官品评的影响Table 8 Effect of different proportions of starter on pH value and sensory evaluation of fermented donkey sausage
由表7可知,当P.p和L.c以不同的比例混菌培养与单菌培养来比较,单菌培养的菌落总数显著高于混菌培养(P<0.05),此结果说明两种菌株之间存在拮抗,但不同比例下的混菌均由接种时的1×103CFU/mL增长至1×107CFU/mL以上,混合LAB还是可以进行发酵产酸。
P.p和L.c之间的拮抗性可能由于菌种在培养过程中产生的代谢产物有抑制对方的作用,导致两种菌在混合培养时最终pH相较于单菌培养较高,菌落计数相较于单菌培养相差一个数量级,王恺[28]研究的三种LAB在发酵香肠中关于P.p和L.c之间的拮抗关系与本文试验结果一致。
2.2 发酵驴肉肠发酵工艺优化试验
2.2.1 发酵剂不同菌种配比对发酵驴肉肠品质的影响 由表8可看出,两组单菌发酵的香肠在经过24 h后pH均显著(P<0.05)低于混菌发酵的香肠,说明两种菌混合培养时由于代谢产物的形成对混菌培养过程中的增殖产酸产生了抑制。
从图3感官评分结果来看,单菌发酵的两组香肠评分极显著(P<0.01)低于其余五组混菌发酵,而混菌发酵的五组之间差异并不显著。

图3 不同配比发酵剂对发酵驴肉肠感官品评的影响Fig.3 Effects of different ratio starter cultures of the mixed LAB on the sensory evaluation of fermented donkey sausage
经过多次重复试验,混菌发酵的五组香肠感官评分并无明显的差异性,却极显著(P<0.01)高于两组单菌发酵香肠,表明混菌发酵香肠的风味物质更充沛,感官评分较高。固将发酵剂配比选为P.p∶L.c=1∶1进行混菌发酵试验。
2.2.2 发酵剂菌液浓度对发酵驴肉肠品质的影响 由表9可知,随着菌液浓度的不断升高,菌体的产酸能力不断增强,在菌液浓度为107CFU/mL时,发酵24 h后香肠的pH下降至4.36,而添加菌液浓度为103CFU/mL的香肠在发酵24 h后香肠的pH由最初的6.39下降至4.61,远低于世界卫生组织及我国发酵肉标准中以公布的安全发酵肉制品的最大pH为5.20,说明两种LAB可以实现在肉质香肠中快速发酵产酸,抑制有害微生物的增长,保证发酵香肠的食用安全性。
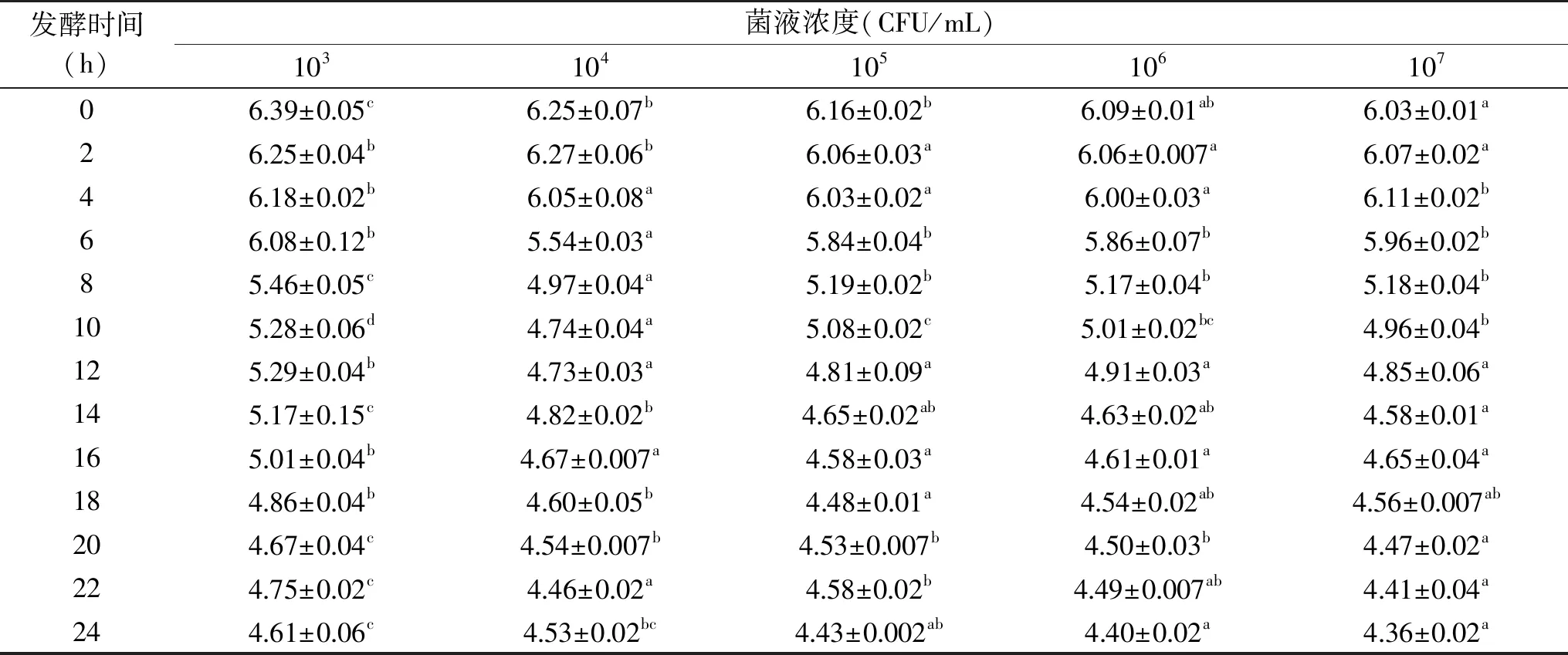
表9 不同菌液浓度的添加对pH的影响Table 9 Effects of different concentrations of the mixed LAB on pH
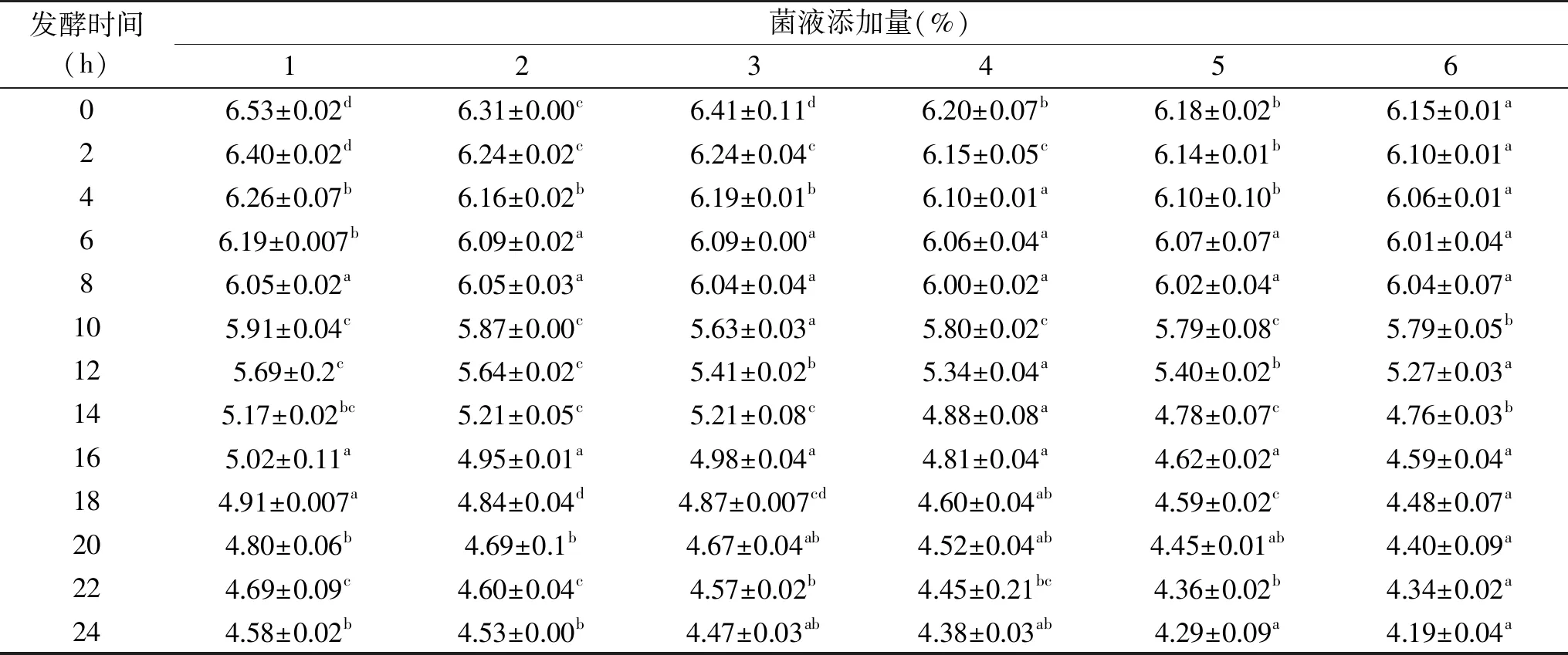
表10 混合LAB不同添加量对pH的影响Table 10 Effect of different additions of mixed LAB on pH
由图4可以看出当混合LAB的菌液浓度在104、105、106CFU/mL时,感官评分高于其他两个梯度,在单因素实验中固定接菌浓度为105CFU/mL,同时选择104、105、106CFU/mL为正交试验菌液浓度的三个水平。
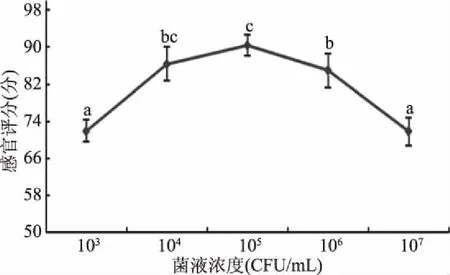
图4 不同菌液浓度添加对感官评定的影响Fig.4 Effect of different concentrations of mixed LAB on sensory evaluation
2.2.3 发酵剂添加量对发酵驴肉肠品质的影响 由表10可以看出,添加量为1%时,pH在发酵的24 h内由最初的6.53下降至4.58,而当添加量增加至6%时,不仅影响了发酵开始时肉肠的初始pH,使得初始发酵时发酵微生物处于较合适的pH区间,还加快了发酵菌株的代谢产酸,经24 h发酵使得发酵香肠的最终pH为4.19。随着混合LAB添加量的增加,pH呈现下降的趋势。
图5表示不同添加量下发酵香肠的感官评分,随着发酵最终pH的降低,感官评分呈现逐渐降低的结果。混合LAB添加量为1%时感官评分最高,2%添加量的感官评分次之,而添加量为6%时分值最低,可见当最终pH<5.20时,随着pH的降低,人们的接受度也逐渐降低。结合感官品评与最终pH,1%添加量为当前加工条件下混合LAB于发酵驴肉肠中较适宜提添加量,选取1%、2%、3%为正交实验中添加量的三个水平。
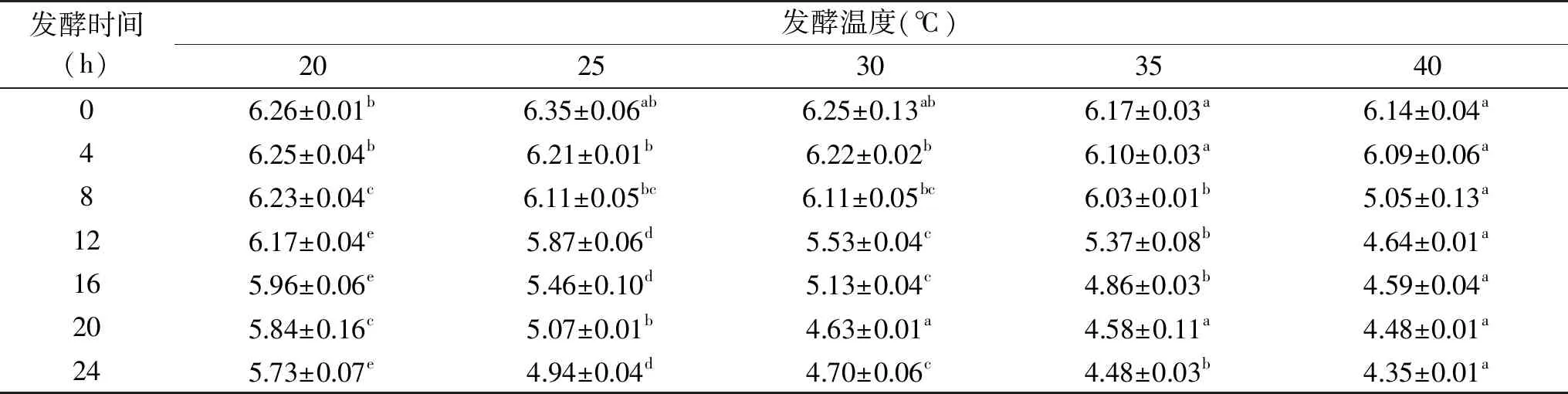
表11 不同发酵温度对pH的影响Table 11 Effect of different fermentation temperatures on pH

图5 混合LAB不同添加量对感官品评的影响Fig.5 Effect of different additions of mixed LAB on sensory evaluation
2.2.4 发酵温度对发酵驴肉肠品质的影响 由表11可知,在不同发酵温度下发酵的香肠,随着发酵时间的增加pH降低,但是不同温度之间的pH变化差异明显,在20 ℃下发酵驴肉肠的pH在24 h后降低到了5.73,而在25 ℃下发酵的香肠在24 h后降低至4.94,与20 ℃处理组的最终pH有显著性差异(P<0.05),随着发酵温度的增高,pH降低的幅度越大,显著性越强。
在不同温度下发酵,最终pH彼此之间形成显著差异,原因是在过高或过低温度下培养会影响发酵微生物的生长代谢产酸,进而影响发酵驴肉肠特殊风味的形成降低发酵过程对驴肉肠感官品质和质构的优化。

图6 发酵温度对感官品评的影响Fig.6 Effects of fermentation temperatures on the sensory score
由图6可以看出,在35 ℃条件下发酵驴肉肠的感官品评结果最优,而在40 ℃下品评分数最低。20、25、30 ℃下品评结果差异不显著。
在40 ℃下品评结果分数低可能是由于在高温下发酵,发酵菌生长活力大,代谢产酸快,导致pH的快速下降,发酵香肠中的风味物质为完全形成而酸味过重,影响发酵驴肉肠的风味和感官品质;且pH快速的下降,导致内源酶未充分将大分子蛋白分解,蛋白质由于pH快速的改变而发生变性,导致发酵驴肉肠组织结构松散肉质不细腻[29]。在20 ℃发酵条件下,温度较低,发酵微生物增长较慢,产酸率较低,pH下降过慢,不能较好地抑制发酵驴肉肠中的有害微生物的增长[30-31],导致发酵驴肉肠的食用安全性降低;由于发酵微生物生长代谢较慢导致发酵风味不明显而使发酵驴肉肠的口感、风味更接近市售加工方便香肠,没有突出发酵特色。而在35 ℃下发酵的驴肉肠,色泽红润,酸度适中,香肠细嫩紧致,符合良好发酵香肠的感官标准,风味独特,所以35 ℃为当前加工条件下较适发酵温度,而选择25、30、35 ℃为正交试验温度的三水平。
2.2.5 发酵时长对发酵驴肉肠品质的影响 由图7可知随着发酵时间的不断增加,发酵驴肉香肠的pH逐渐降低,在发酵14 h后,pH达到5.10以下,经过发酵时间的延长,pH缓慢降低,最终到达4.50左右。

图7 不同发酵时间对pH的影响Fig.7 Effect of different fermentation time on pH
由图8可知发酵时长为16 h时感官评分最高,18、20 h次之,22和24 h的感官评分显著低于16 h(P<0.05),结合图2~图8,可知在22 h后,发酵驴肉肠的pH已经低于4.50,此时感官评分较低说明发酵时间延长累积产酸增多,人们可接受度降低,故选择16、18、20 h为正交试验时长的三水平。

表12 正交试验表L9(34)Table 12 Orthogonal testTable of L9(34)

表13 正交试验方差分析Table 13 Orthogonal test analysis of variance

图8 发酵时长对感官品评的影响Fig.8 Effect of fermentation time on sensory evaluation
2.2.6 正交试验 由表12通过对pH直观分析得出RC>RD>RA>RB,本研究中混合LAB的发酵温度对发酵驴肉肠的pH的影响最大,其次是发酵时间,菌液浓度对发酵驴肉肠的pH也有影响,添加量对发酵驴肉肠pH的影响最小。通过对感官评分结果直观分析,发酵时间对感官品评的结果影响最大,其次是发酵温度和混合LAB菌液浓度,混合LAB添加量对感官评价影响最小,根据pH挑选出的较优发酵工艺组合为A3B3C3D3,由感官品评的结果较优发酵工艺为A3B1C3D3,两者关于发酵剂的添加量水平选择不一致,但是添加量相较于发酵温度和发酵时间对pH的影响较小,所以根据感官评分的结果,选择A3B1C3D3为较优发酵条件。
方差分析见表13。
A3B1C3D3不属于正交试验9组处理中的一组,所以以相同发酵处理对其与有最高感官评分的进行验证试验,得出表14。

表14 较优发酵条件验证试验结论Table 14 Better fermentation conditions test verification results
由表14可知,A3B1C3D3组合pH<5.20,感官评分比A3B1C3D2组评分高,所以选择A3B1C3D3(发酵剂的浓度为1×106CFU/mL、添加量为1%、发酵温度为35 ℃、发酵时间为20 h)为较优组合。
3 结论
本研究以驴肉为原材料,选用P.p和L.c进行菌种发酵试验并对发酵驴肉肠的发酵工艺进行研究,通过对两种发酵剂的发酵特性、菌种配比、混合LAB的添加量、培养温度、培养时间等因素的研究,以及两种发酵剂在发酵产酸过程中对发酵驴肉肠pH产生的改变,得出:P.p和L.c两种发酵菌株均适合应用于发酵驴肉制品;两种菌复配培养时有拮抗性,对产酸pH有抑制性,但还可以满足肉制品快速发酵的要求,可作为混合发酵剂,最终复配发酵剂的配比为P.p∶L.c=1∶1。
通过对混合LAB发酵剂的发酵菌种配比、菌液浓度、发酵剂添加量、发酵温度、发酵时间的单因素实验及适当因子水平的正交结果来看,选取发酵剂的浓度为1×106CFU/mL、添加量为1%、发酵温度为35 ℃、发酵时间为20 h,在此配比下发酵的驴肉肠有合格的pH,呈枣红色,外形饱满、感官评分优。

