南极磷虾酶解工艺优化及酶解产物对牡蛎肉的冷冻保护作用
,2,3,4,5,*,2,3,4,5,2,3,4,5
(1.广东海洋大学食品科技学院,广东湛江 524088;2.国家贝类加工技术研发分中心,广东湛江 524088;3.广东省水产品加工与安全重点实验室,广东湛江 524088;4.广东省海洋生物制品工程实验室,广东湛江 524088;5.水产品深加工广东普通高等学校重点实验室,广东湛江 524088)
水产品本身具有水分含量高、内源酶活力强等特点,容易发生腐败变质,在长时间储存或运输过程中通常采用冻藏来保证品质不发生劣变[1]。产品在长期冻藏过程中,低温会导致肌肉蛋白质(主要是肌原纤维蛋白)发生冷冻变性,而冷冻变性致使水产品口感风味改变及营养价值降低[2-3],在工业生产中使用抗冻剂如含磷抗冻剂及糖类抗冻剂来解决该问题。但含磷抗冻剂如多聚磷酸盐类,与体内钙质结合会造成钙磷失衡[4],传统糖类抗冻剂如蔗糖因甜度高、热量高等特点,会影响产品风味[5]。
研究表明,蛋白质水解后产生的多肽可以有效抑制水产品冷冻变性,同时具有较低的甜度[6]。目前抗冻多肽主要来源有各种鱼类蛋白如鳕鱼肉[7]、各种动物皮肤中的胶原蛋白、明胶[8]、虾的边角料[9]等,但这些原料受到来源及提取条件等因素的限制,还不能达到商业化应用的程度。南极磷虾(Antarctic krill)生物资源量巨大[10],具有抗菌、降血压、抗氧化及抗疲劳耐缺氧等生物活性[11],而其冷冻保护研究较少,马庆保等[12]研究发现,南极磷虾适应极寒环境产生的抗冻蛋白具有冰晶生长抑制特性。因此,南极磷虾蛋白是抗冻肽的一种潜在、良好的天然来源。
目前,研究抗冻多肽冷冻保护效果时,一般将其添加至鱼糜或鱼肉[13]中,而贝类冷冻保护研究较少。而牡蛎近年来产量不断增加,主要采用冷冻保鲜销往全国,是目前一种重要的食用海产品[14]。因此本研究以南极磷虾为原料进行酶解工艺优化,并将所得到的酶解产物添加至牡蛎肉中,通过测定牡蛎肉冻藏后失水率、盐溶性蛋白含量、Ca2+-ATPase酶活力及总巯基含量变化,对其冷冻保护效果进行评价,为南极磷虾高值化利用及研发新型抗冻剂提供一定理论依据。
1 材料与方法
1.1 材料与仪器
冷冻南极磷虾 山东枣庄渔源水族;新鲜牡蛎 湛江东风市场;碱性蛋白酶(2.4 AU/g) 诺维信(中国)生物技术有限公司;胰蛋白酶(酶活力4000 U/g)、中性蛋白酶(酶活力100000 U/g)、木瓜蛋白酶(酶活力100000 U/g) 南宁庞博生物工程有限公司;溶菌酶(14300 Da)、维生素B12(1355.38 Da)、马尿酰-組氨酰-亮氨酸(429.47 Da)、L-酪氨酸(181.19 Da) Sigma公司;超微量Ca2+-ATPase酶测定试剂盒 南京建成生物工程研究所;Folin-酚试剂盒、二硫-2-硝基苯甲酸(DTNB) 北京鼎国昌盛生物技术有限公司;乙二胺四乙酸二钠(EDTA) 上海沪试化工有限公司;十二烷基硫酸钠(SDS) 上海化学试剂有限公司;试剂 无特殊说明均为分析纯。
VOPADEST450全自动凯氏定氮仪 广州德资格哈特仪器有限公司;UV2550紫外分光光度计、LC20AD高效液相色谱仪 日本岛津公司;FDU-1100真空冷冻干燥机 埃朗科技国际贸易有限公司;N-1100V-WB旋转蒸发仪 上海埃朗仪器有限公司。
1.2 实验方法
1.2.1 南极磷虾的酶解方法 参照张元元等[15]方法有所改动。将购买的南极磷虾于室温解冻6 h,清洗后取一定南极磷虾按1∶5的料液比加入蒸馏水打碎后匀浆15 min,加入蛋白酶后调节pH,水浴加热至所需温度保温酶解,在此过程中保持体系pH不变。酶解结束后,在100 ℃下加热10 min灭酶,后于4 ℃、8000 r/min离心20 min。将上清液在真空度为0.1 MPa、温度为50 ℃旋转真空浓缩后进行真空冷冻干燥(-45 ℃、20 Pa),干燥完成后装入密封袋中于4 ℃保存。
1.2.2 南极磷虾酶解条件的优化
1.2.2.1 南极磷虾酶解用酶筛选 参照张元元等[15]方法有所改动。选择胰蛋白酶(37 ℃,pH8.0)、中性蛋白酶(50 ℃,pH6.0)、碱性蛋白酶(55 ℃,pH10)及木瓜蛋白酶(50 ℃,pH7.0),添加量为1.6%,酶解时间5 h,底物浓度为20%条件下进行酶解,以水解度为指标进行筛选。
1.2.2.2 单因素实验 根据蛋白酶筛选实验结果,固定条件为:酶解时间5 h、酶解温度50 ℃、pH10、加酶量1.6%及底物浓度为20%,设置各因素水平为酶解温度40、45、50、55、60 ℃;pH8、8.5、9、9.5、10;加酶量1.2%、1.6%、2%、2.4%、2.8%;酶解时间4.5、5、5.5、6、6.5 h。酶解具体方法按1.2.1进行,研究各因素对水解度的影响。
1.2.2.3 正交试验 在单因素实验的基础上,选取酶添加量、温度、pH、酶解时间四个因素,以水解度为指标,进行四因素三水平正交试验,确定最佳的酶解条件组合。

表1 碱性蛋白酶水解正交试验因素水平编码表Table 1 Factors and levels codingTable for alkaline protease hydrolysis orthogonal test
1.2.3 水解度的测定方法 水解度的计算公式为:
水解度DH(%)=酶解液中游离氨基态氮的含量(g)/原料中总氮×100
式中:原料中总氮为用凯氏定氮法测定样品中的总氮含量[16];酶解液中游离氨基酸态氮为用甲醛滴定测定的酶解液中游离氮含量[17]。
1.2.4 南极磷虾酶解产物分子量测定 参照李婉等[18]方法稍作修改,采用高效体积排阻色谱法(HPSEC)进行分子量测定。色谱条件:流动相为Tris-HCl缓冲液(pH8.3、0.05 mol/L);色谱柱:Waters Protein-pak 60A(WAT085250);洗脱速度0.7 mL/min;25 ℃柱温。样品稀释后上样,上样量20 μL,检测波长214 nm。标准品为:维生素B12(1355.38 Da)、溶菌酶(14300 Da)、马尿酰-组氨酰-亮氨酸(429.47 Da)、L-酪氨酸(181.19 Da)。以保留时间(t)为横坐标和分子量的对数lgM为纵坐标作图,得到分子量回归方程为:lgM=-0.4567t+8.9462(R2=0.9976)。
1.2.5 南极磷虾酶解产物的冷冻保护作用研究
1.2.5.1 冻藏牡蛎预处理 将新鲜牡蛎洗净去除杂质,取出牡蛎贝肉4 ℃蒸馏水清洗后切成大小均匀的块状。将得到的牡蛎肉分成三份,按照牡蛎肉重量的0.5%添加复合磷酸盐混匀为含磷抗冻剂组;按照牡蛎肉重量的5%添加南极磷虾酶解产物粉末混匀为南极磷虾酶解产物组;不经任何处理为空白对照组。将样品放进-75 ℃的冰箱速冻2 h转移至-18 ℃的冰箱中进行冷冻保藏。
1.2.5.2 解冻失水率测定 按照俞裕明等[19]的方法测定解冻失水率:将经过冻藏牡蛎肉取出在4 ℃冰箱放置12 h进行解冻,用滤纸吸干表面水分进行称重,并按照下式计算解冻失水率:

1.2.5.3 盐溶性蛋白提取及含量测定 基于万建荣[20]的方法稍作修改:准确称取3 g解冻后的牡蛎肉加入30 mL磷酸盐缓冲液(I=0.05,pH=7.5)研磨提取5 min后,于4 ℃、8000 r/min下离心15 min,除去上清液,再次加入磷酸盐缓冲液研磨提取离心,重复三次。在离心后得到的沉淀中加入30 mL的pH7、0.6 mol/L NaCl溶液,混匀后在4 ℃冰箱中提取20 h于4 ℃、8 000 r/min下离心15 min,所得上清液即为盐溶性蛋白溶液。采用Folin试剂盒对上清液进行蛋白质含量测定,所得结果即为样品中盐溶性蛋白的含量。
1.2.5.4 总巯基含量测定 参照Benjakul[21]方法,取0.5 mL盐溶性蛋白溶液加入试管中,然后加入4.5 mL 0.2 mol/L Tris-HCl缓冲液(含有8 mol/L尿素、2% SDS、10 mmol/L EDTA、pH=6.8),取4 mL混合液加入0.4 mL 0.1% DTNB溶液(溶于0.2 mol/L的Tris-HCl中,pH=8.0),混匀后40 ℃水浴加热25 min,在412 nm处测定吸光值。空白组以0.6 mol/L NaCl溶液代替样品。按下列公式计算总巯基含量(mol/L)。
式中:A-样品在412 nm处的吸光值;D-稀释倍数;ε-摩尔消光系数13600/(mol·L-1·cm)。
1.2.5.5 Ca2+-ATPase酶活力测定 采用超微量Ca2+-ATP试剂盒对牡蛎肉提取的盐溶性蛋白进行Ca2+-ATPase酶活力测定,按下列公式进行计算:

式中:其中A表示样品测定管吸光值;B表示对照管吸光值;C表示标准管吸光值;D表示空白管吸光值。
1.3 数据处理
采用SPSS 19.0软件和Excel 2010软件对数据进行分析处理,*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
2 结果与分析
2.1 南极磷虾酶解蛋白酶筛选结果
选择胰蛋白酶、中性蛋白酶、木瓜蛋白酶及碱性蛋白酶分别在其最适条件下对南极磷虾进行酶解,以水解度为评价指标,四种酶水解度如图1所示。由图1可知,在最适条件下碱性蛋白酶的水解度最高,为10.94%±0.4%,显著(P<0.05)高于木瓜蛋白酶、胰蛋白酶和中性蛋白酶,其他三种酶的水解度无显著性差异,因此选用碱性蛋白酶作为实验用酶。
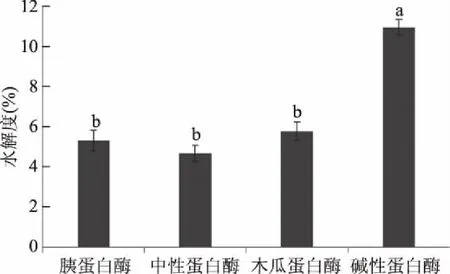
图1 各种蛋白酶水解效果比较Fig.1 Comparison of efficiency of hydrolysis of different proteases注:不同小写字母表示差异显著(P<0.05)。
2.2 单因素实验结果
2.2.1 酶解温度对南极磷虾酶解水解度的影响 酶解温度对南极磷虾酶解水解度的影响结果如图2所示。由图2可知,随着温度的升高,酶解液的水解度先增加后降低,水解度在55 ℃时最大。在温度低于55 ℃时,碱性蛋白酶的催化速率随着随温度上升而增加,因此水解度出现上升;当温度超过最适温度范围时,蛋白酶高温变性以及酶解产物的增加抑制酶解反应的进行[22],导致水解度降低,因此选择的水解温度为55 ℃。
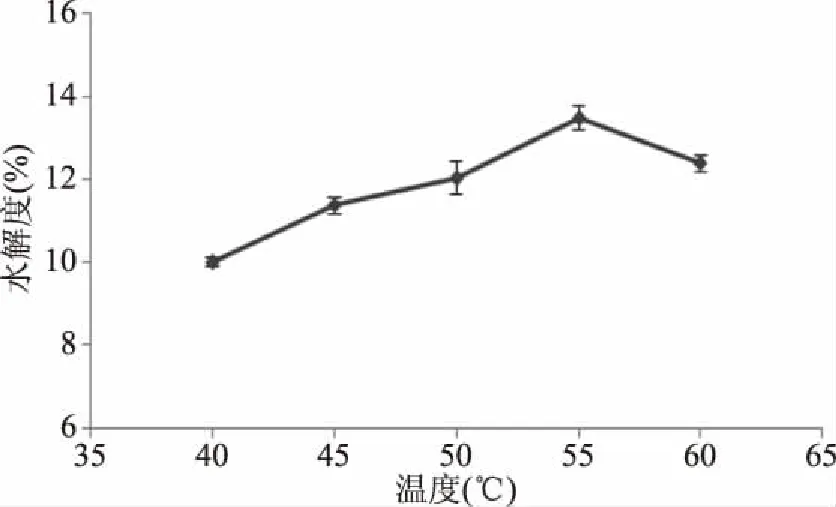
图2 酶解温度对南极磷虾酶解水解度的影响Fig.2 Influence of enzymatic temperature on hydrolysis degree of Antarctic krill

图3 pH对南极磷虾酶解水解度的影响Fig.3 Influence of pH on hydrolysis degree of Antarctic krill
2.2.2 pH对南极磷虾酶解水解度的影响 pH对南极磷虾酶解水解度的影响结果如图3所示。由图3可知,随着pH的增加,酶解液的水解度呈现先上升后下降趋势,在pH为8.5时水解度最高。这是因为酶与底物的结合和催化反应常取决于底物和酶分子的电荷分布,pH变化影响酶与底物电荷分布,从而影响酶解反应的进行,过酸或过碱均影响蛋白酶活性[23]。在pH超过8.5时,蛋白酶活性下降,从而使水解度出现下降。因此,碱性蛋白酶酶解南极磷虾最佳pH为8.5。
2.2.3 加酶量对南极磷虾酶解水解度的影响 加酶量对南极磷虾酶解水解度的影响如图4所示。由图4可知,随着加酶量的增加,南极磷虾水解度上升,在添加量为2.4%时,水解度最高,但加酶量继续增加时水解度下降。这是因为体系内酶解效率随着酶添加量的增加而提高,酶解效率逐渐升高;随着酶添加量的继续增加,反应体系出现酶过剩的现象,抑制酶解反应的进行[23],同时增加实验成本,因此最佳加酶量为2.4%。

图4 加酶量对南极磷虾水解度的影响Fig.4 Influence of enzymatic dosage on hydrolysis degree of Antarctic krill
2.2.4 酶解时间对南极磷虾酶解水解度的影响 酶解时间对南极磷虾酶解水解度的影响结果如图5所示。由图5可知,水解度随着酶解时间的增加先升高后下降,在5 h时水解度最高。这是因为,随着反应的进行,酶与底物逐渐结合,催化反应向正方向进行,水解度不断增加,但随着反应的继续进行,酶解产物浓度增加,竞争性抑制作用变强,新生成的小分子肽、氨基酸等产物使催化反应向逆反应方向进行[24],造成水解度下降。因此最佳酶解时间为5 h。

图5 酶解时间对南极磷虾酶解水解度的影响Fig.5 Influence of enzymatic hydrolysis time on hydrolysis degree of Antarctic krill
2.3 南极磷虾酶解正交试验优化结果
在单因素实验结果基础上,以水解度为指标选用四因素三水平的正交试验(见表1)对南极磷虾酶解工艺条件进一步优化,试验优化结果如表2所示。由直观分析法得出,时间、加酶量、温度及pH四个因素对水解度均有影响,根据极差R值分析显示各因素对水解度影响大小为:加酶量>pH>酶解温度>酶解时间,即加酶量对实验影响最大。正交优化得到最佳酶解工艺参数为:A2B2C3D2,即pH8.5,酶解温度为55 ℃,加酶量2.6%,酶解时间为5 h。此条件不在正交表中,进行验证实验得到在此条件下的水解度为23.85%±0.95%。
2.4 南极磷虾酶解产物相对分子质量分布
南极磷虾酶解产物相对分子质量分布结果如表3和图6所示。南极磷虾酶解产物相对分子质量主要分布在100~5500 Da,占总酶解产物的79.69%。与李晓坤、孙丽洁等[25-26]的研究结果一致。李晓坤[25]研究得到的抗冻多肽分子量分布在150~2000 Da;孙丽洁等[26]得到的抗冻多肽分子量主要分布在小于3000 Da。目前研究的结果表明抗冻多肽相对分子质量较低,具有较强的抗冻活性,这可能是因为分子质量小的多肽更容易与冰晶表面结合,阻碍冰晶生长,而小分子肽也可以与水形成氢键,增强冻结过程水的稳定性,减少大冰晶的形成[27]。因此经过工艺优化得到的南极磷虾酶解产物可能具有一定的抗冻活性。

表3 南极磷虾酶解产物相对分子质量分布表Table 3 Molecular weight distribution of the enzyme hydrolysate of Antarctic krill

图6 南极磷虾酶解产物相对分子质量分布图Fig.6 Molecular weight distribution of the enzyme hydrolysate of Antarctic krill
2.5 南极磷虾酶解产物对牡蛎肉的冷冻保护作用
2.5.1 冻藏过程中各处理组牡蛎肉解冻失水率变化 如图7所示,各样品组随着冻藏时间的增加,均出现失水现象。这是因为牡蛎肉在冻藏过程形成冰晶,导致组织结构受损,解冻后的水分不能被其组织全部吸收,从而造成部分汁液流失[28]。冻藏10 d时,各处理组的失水率之间差异不显著,随着冻藏继续进行,冻藏25 d后空白对照组的失水率为10.11%,添加量0.5%的含磷抗冻剂组和添加量为5%酶解产物均可以抑制牡蛎肉失水现象,其失水率分别为6.56%、5.00%。添加量0.5%含磷抗冻剂组及添加量5%酶解产物组失水率极显著低于空白对照度(P<0.01),而酶解产物组抑制效果明显优于含磷抗冻剂组。这是因为南极磷虾酶解产物中含有小分子肽能够与水结合,增强冻结过程中水的稳定性,有效提高牡蛎肉持水能力。

图7 不同冻藏时间下各处理组牡蛎肉解冻失水率的变化Fig.7 Changes of thawing water loss rate of oyster meat in each treatment group under different freezing time注:与空白对照组相比,*表示差异显著(P<0.05);**表示差异极显著(P<0.01);图8~图10同。
2.5.2 冻藏过程中各处理组牡蛎肉盐溶性蛋白含量变化 盐溶性蛋白是肌肉蛋白质的主要组成部分,因此盐溶性蛋白可以反映牡蛎肉蛋白质的特性,其含量越低表示蛋白质变性程度越大[29]。随着冻藏时间的延长,牡蛎肉盐溶性蛋白含量变化如图8所示,冻藏5 d时,牡蛎肉盐溶性蛋白含量下降剧烈,各处理组之间无显著性差异,继续冻藏盐溶液蛋白含量下降趋势变缓。冻藏25 d后空白对照组样品盐溶性蛋白含量为0.55 mg/mL,下降55%,添加量为0.5%含磷抗冻剂组及添加量为5%的酶解产物组盐溶性蛋白含量分别为0.51、0.77 mg/mL,分别下降58.53%、37.39%,南极磷虾酶解产物组极显著高于空白组及含磷抗冻剂组(P<0.01)。这与Yanan[30]研究结果一致,结果表明南极磷虾酶解产物具有一定的抑制牡蛎肉蛋白质冷冻变性的效果,在添加量为5%时作用效果优于添加量为0.5%的市售含磷抗冻剂。
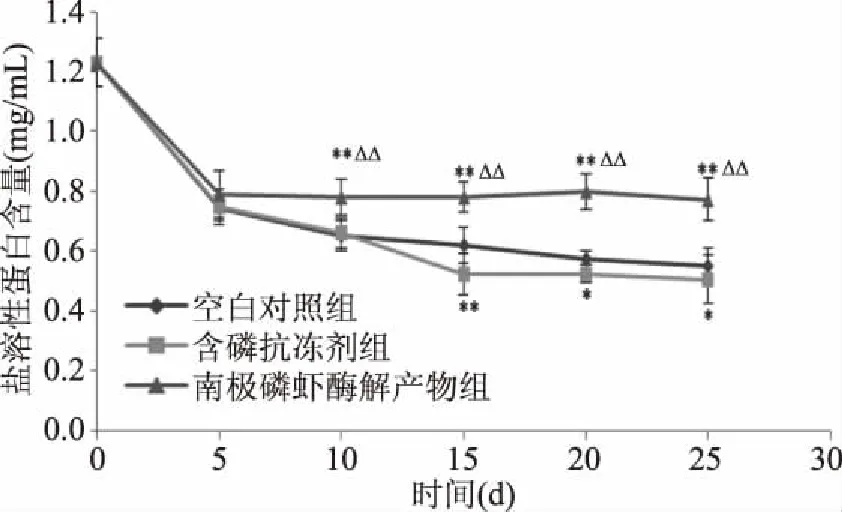
图8 不同冻藏时间下各处理组盐溶性蛋白含量变化Fig.8 Changes of salt soluble protein in each treatment group under different freezing time注:与含磷抗冻剂组相比,Δ表示差异显著(P<0.05);ΔΔ表示差异极显著(P<0.01),图9同。
2.5.3 冻藏过程中各处理组牡蛎肉中总疏基含量的变化 巯基是蛋白质中最为活跃的基团,在冻藏期间,肌球蛋白的冷冻变性导致蛋白质结构改变,从而使其活性巯基暴露被氧化成二硫键,造成总巯基含量下降[31]。各处理组牡蛎肉冻藏过程中总巯基含量变化如图9所示,随着冻藏时间的增加,牡蛎肉中总疏基含量逐渐减少,表明牡蛎肉蛋白质发生了一定程度冷冻变性。冻藏25 d后,空白对照组总巯基含量下降至0.300×10-5mol/L,下降65.51%;添加量为0.5%的含磷抗冻剂组和添加量为5%南极磷虾酶解产物组分别下降至0.312×10-5、0.434×10-5mol/L,分别下降64.13%、50.11%,空白组下降程度最大,添加南极磷虾酶解产物组总巯基含量极显著高于空白组和含磷抗冻剂组(P<0.01)。结果显示,与空白对照组及添加量为0.5%的含磷抗冻剂相比,添加量为5%的南极磷虾酶解产物总巯基含量下降率最低,抑制效果最好。因此,酶解产物能一定程度抑制牡蛎肉冻藏过程中发生蛋白冷冻变性。

图9 不同冻藏时间下各处理组总巯基含量变化Fig.9 Changes of the total sulfhydryl groups in each treatment group under different freezing time
2.5.4 冻藏过程中不同处理组牡蛎肉中Ca2+-ATPase酶活力变化 水产品冻藏过程中由于肌球蛋白头部巯基的氧化会导致Ca2+-ATPase酶活力下降,测定Ca2+-ATPase酶活力的变化可以监测水产品冻藏过程蛋白质变性情况[32]。如图10所示,牡蛎肉经过冻藏后,三个处理组样品的Ca2+- ATPasease酶活力均出现降低。冻藏25 d时,空白对照组由最开始的0.41 μmol Pi/mg prot/h下降至0.05 μmol Pi/mg prot/h,下降幅度为87.8%,添加0.5%含磷抗冻剂组和添加量为5%南极磷虾酶解产物组分别降至0.11 μmol Pi/mg prot/h,0.12 μmol Pi/mg prot/h,分别下降73.17%、70.73%,含磷抗冻剂及南极磷虾酶解产物的Ca2+-ATPasease酶活力极显著高于空白对照组(P<0.01),南极磷虾酶解产物可以保持牡蛎肉冻藏过程蛋白质分子结构的稳定,抑制Ca2+-ATPase酶活力下降,能在一定程度上抑制牡蛎在冻藏过程发生冷冻变性。

图10 不同冻藏时间下各处理组Ca2+-ATPase活性的变化Fig.10 Changes of Ca2+-ATPase activity in each treatment group under different freezing time
3 结论
以南极磷虾为研究对象,对酶解用酶进行筛选得到碱性蛋白酶酶解效果最佳。碱性蛋白酶正交优化得到最佳酶解条件为酶解温度为55 ℃,酶解pH为8.5,加酶量2.6%,酶解时间为5 h,此时水解度为23.85%。此条件下南极磷虾酶解产物分子量分布100~5500 Da,占总酶解产物的79.69%。将酶解产物按5%比例添加至牡蛎肉中,经过冻藏25 d后,添加量为5%的南极磷虾酶解产物组的牡蛎肉失水率低于空白对照组及添加量为0.5%的含磷抗冻剂组;抑制盐溶性蛋白含量及总巯基含量下降效果优于含磷抗冻剂组;Ca2+ATPase酶活力与含磷抗冻剂组相似,且高于空白对照组。因此南极磷虾碱性蛋白酶酶解产物对牡蛎肉具有较好的冷冻保护活性,具有开发成安全高效无磷抗冻剂的潜在前景。

