hairy和hedgehog在单环刺螠幼虫体节形成过程中的表达特征分析❋
李 琦, 秦贞奎, 张婷婷, 魏茂凯, 侯西坦, 张志峰
(中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003)
Hariy是Hes家族成员,其作为Notch信号通路的下游靶基因,参与神经和体节的发育以及免疫和癌症等生物学过程[1]。hairy参与体节形成已经在几种昆虫中被验证[2-6];在环节动物小头虫(Capitellateleta)中hairy/hes1定位于体节产生区域,被认为可能参与了体节形成过程[7];在有爪动物栉蚕(Euperipatoideskanangrensis)中,尽管hairy呈现条带状表达图式,但因其在胚胎末端体节发生区域不表达,因而被认为与体节形成无关[8]。
Hedgehog作为其信号通路中的配体参与众多发育过程,如细胞增殖与定向分化,组织形态发生和体节极性维持等[8]。在果蝇(Drosophilamelanogaster)中,其首先被证明作为一种体节极性基因参与副体节和体节边界的界定与维持[10],相同的功能也在螯肢动物欧洲黄色尾蝎(Euscorpiusflavicaudis)、甲壳动物卤虫(Artemiafranciscana)以及环节动物褐片阔沙蚕(Platynereisdumerilii)中被验证[11-12]。
单环刺螠(Urechisunicinctus)隶属螠虫动物门(Echiura),主要分布于远东地区,是一种海洋经济无脊椎动物。其胚胎孵化后,历经担轮幼虫、体节幼虫、蠕虫状幼虫,然后变态成为幼螠;在由晚期担轮幼虫发育至早期体节幼虫的过程中产生体节,在由体节幼虫发育至蠕虫状幼虫的过程中体节消失(见图1)。谢跃洋报道单环刺螠的幼虫体节仅是表皮分节[13],这一特点与典型体节动物(节肢动物和环节动物)终生存在的体节不同,典型体节动物除了表皮分节外,其内部主要组织器官(体腔、肌肉、循环系统、排泄系统等)均按节重复排布[14-15]。为了探讨螠虫动物幼虫体节和典型体节动物体节发生和功能维持中的基因调控以及进化关系,本研究以hairy和hedgehog为靶基因,揭示了它们在单环刺螠幼虫体节形成过程中的表达特征。旨在为探究螠虫动物幼虫体节发生的分子机制和进化等研究提供基础数据。
1 材料与方法
1.1 实验动物
单环刺螠成体来自山东省莱州湾。挑选肾管饱满的雌、雄个体(平均体重为(28.7±8.6) g),解剖并获取成熟的两性配子,以精卵比例10∶1进行体外人工授精。将受精卵置于盛有200 L过滤海水的培养箱(855 mm×650 mm×595 mm)中进行孵化(水温为17.2 ℃,pH=7.8 ± 0.06,盐度为29 ± 1)和前期培育。受精后24 h孵出担轮幼虫,投喂以小球藻(Chlorellavulgaris)和牟氏角毛藻(Cheatocerosmuelleri),每天早晚分别投饵一次,并随着幼虫发育逐渐增加投饵量;至晚期体节幼虫转入泥沙底质(厚约6 cm)中继续培养。培养期间,定期于显微镜下观察幼虫的发育,并取中期担轮幼虫(受精后10 d)、晚期担轮幼虫(受精后25 d)、早期体节幼虫(受精后30 d),体节幼虫(受精后33、37和40 d)和蠕虫状幼虫(受精后45 d)于4%多聚甲醛中固定过夜,经梯度甲醇脱水后保存于无水甲醇中(-20 ℃),用于整体原位杂交。
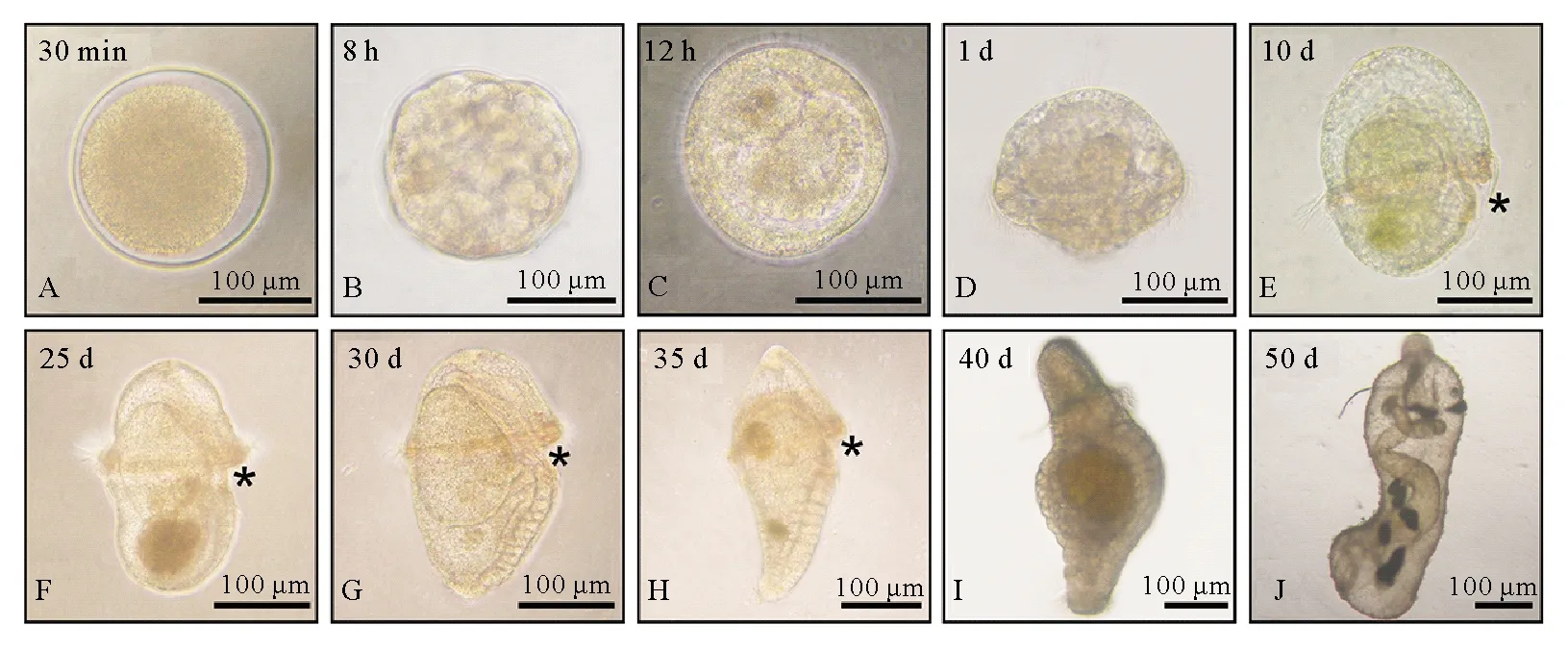
(A:受精卵;B:囊胚;C:原肠胚;D:早期担轮幼虫(消化道打通之前);E:中期担轮幼虫(消化道打通)F:晚期担轮幼虫(腹侧体壁增厚);G:早期体节幼虫(腹侧体壁分节);H~I:体节幼虫(完全分节); J:蠕虫状幼虫(分节消失)。E~H为侧视图;I和J为背视图;星号示意口;左上角数字为受精后时间。A: Fertilized egg; B: Blastula; C: Gastrula; D: Early-trochophore larva (Before the digestive gut opening); E: Mid-trochophore larva (The digestive gut opening); F: Late-trochophore larva (With the thickened ventral body wall); G: Early-segmentation larva (With the segmented ventral body wall); H~I: Segmentation larva (With the complete segments); J: Worm-shaped larva (The segments disappeared). E~H Are ventral view; I & J Are dorsal view. The asterisks point to the mouth. The top left number of each picture is the post fertilization time.)
图1 单环刺螠早期发育
Fig.1 The early development ofU.unicinctus
1.2 总RNA提取和cDNA合成
收集晚期担轮幼虫约100只,使用MicroElute®Total RNA Kit (Omega, 美国)并按照操作指南提取其总RNA;使用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(TaKaRa, 大连)并按照操作指南将总RNA反转录为cDNA,用于靶基因ORF扩增。
1.3 Uu-hairy ORF扩增及序列分析
从单环刺螠幼虫转录组中获得hairycDNA 片段序列,设计ORF扩增引物(见表1)。以上述cDNA为模板,PCR扩增获得其ORF全长序列,扩增产物经琼脂糖凝胶电泳检测、胶回收、连接pClone007载体、转化大肠杆菌DH5α后,挑取单菌落进行PCR验证,然后送往华大基因测序。使用DMAMAN软件对Hairy蛋白进行氨基酸多序列比对,通过NCBI在线BLAST程序(http://blast.ncbi.nlm.nih.gov/)进行同源性分析,使用MEGA 7.0 软件采用Neighbor Joining法构建进化树,Bootstrap设置为1 000。
1.4 目的基因定量表达分析
从单环刺螠幼虫转录组中挑出靶基因,以它们的FPKM值作为表达量,计算各发育时期幼虫(晚期担轮幼虫(L,受精后25 d),早期体节幼虫(E,受精后30 d),体节幼虫(S,受精后35 d)和蠕虫状幼虫(W,受精后42 d))中FPKM的平均值(n=3)。使用SPSS Statistic软件并采用单因素方差分析(One-Way ANOVE)和Tukey’s HSD检验法对各期幼虫靶基因的表达量进行统计分析,显著性差异水平设定为P<0.05。
1.5 整体原位杂交
根据单环刺螠hariy(GenBank序列号:MK353161)和hedgehog(GenBank序列号:KY773909)ORF序列设计探针合成引物(见表1),PCR扩增分别获得长度为436 bp (Uu-hariy)和487 bp(Uu-hedgehog)的序列。以该序列为模板,使用DIG RNA Labeling kit(Roche,瑞士)并按照操作指南合成地高辛标记的RNA 正义和反义探针。取保存于无水甲醇中的各时期幼虫,经梯度甲醇复水后于100 ng/mL蛋白酶K 37 ℃消化20 min(担轮幼虫)或者400 ng/mL蛋白酶K 37 ℃消化30 min(体节幼虫);预杂交条件为60 ℃下6 h,然后加入DIG标记的RNA探针于60 ℃杂交过夜;经过洗涤和blocking buffer封闭后,加入DIG抗体4 ℃孵育过夜;再于NBT/BCIP体系中显色;最终样本于Nikon E80i 显微镜下观察和拍照。

表1 本研究中所用引物序列
2 结果
2.1单环刺螠hairy的序列特征分析
由于周頔[16]已报道了单环刺螠hedgehog的序列特征,因此本研究仅对单环刺螠hairy的序列特征进行分析。
单环刺螠hairy开放阅读框(Open reading frame,ORF)长度为888 bp,编码295个氨基酸。多序列比对结果显示,单环刺螠预测蛋白的氨基酸序列中含有Hairy蛋白保守的HLH结构域、Hairy_Orange结构域和保守的四肽WRPW(见图2)。

(HLH结构域、Hairy_Orange结构域和保守四肽WRPW分别用方框标记。HLH motif, Hairy_Orange motif and tetrapeptide WRPW are boxed.)
同源性分析表明,Uu-Hariy蛋白与小头虫(C.teleta)和黑腹果蝇(D.melanogaster)的Hairy序列一致性分别为69%和57%;与脊椎动物人(Homosapiens)和斑马鱼(Daniorerio)的序列一致性均为54%。系统进化分析发现Uu-Hairy首先与小头虫Hairy聚为一簇,随后与其他物种Hairy聚合,最后与Hes家族聚合(见图3)。
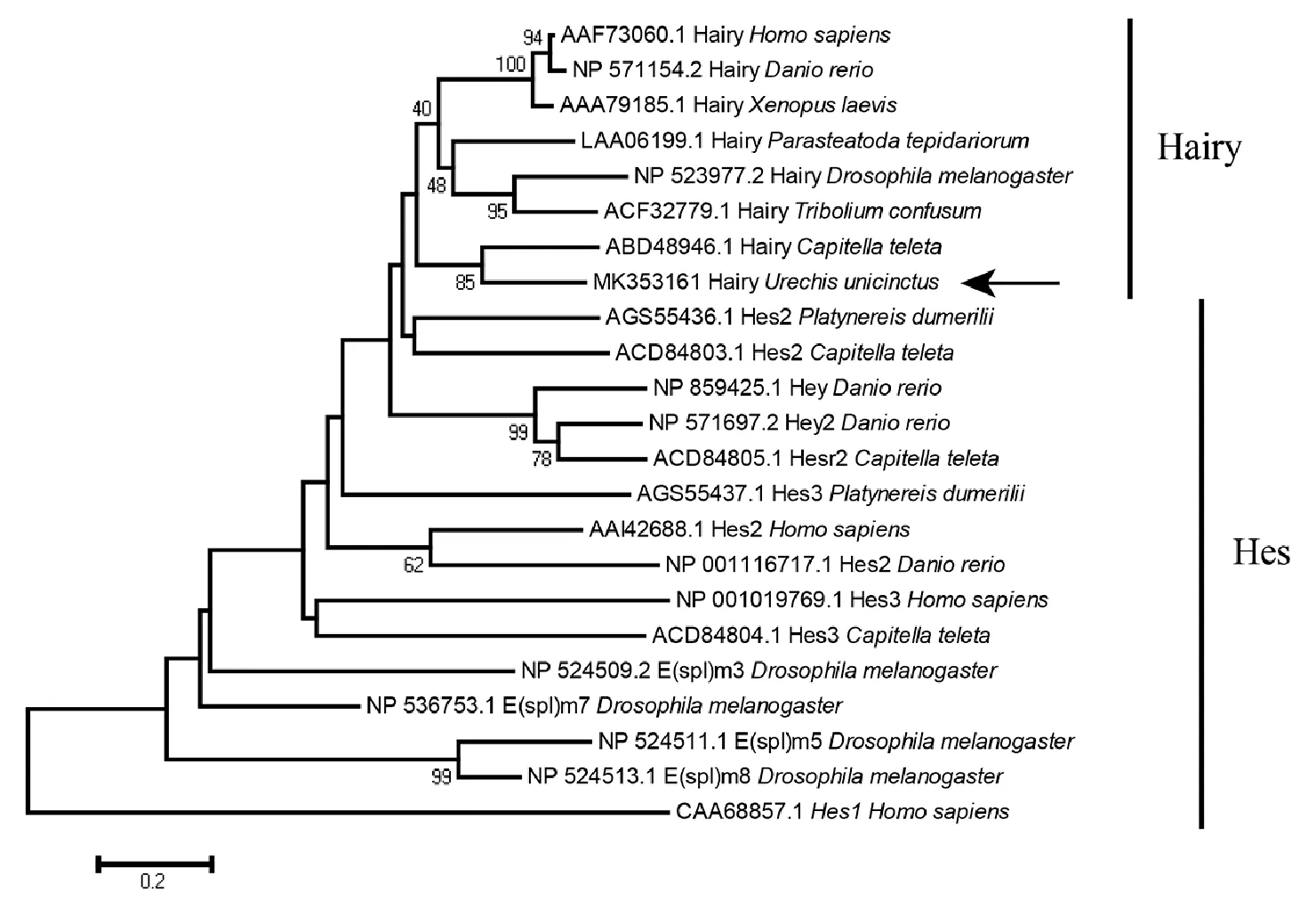
图3 不同物种Hes家族蛋白系统进化分析
2.2 hairy和hedgehog在单环刺螠幼虫中的定量表达
单环刺螠的幼虫体节是在晚期担轮幼虫向早期体节幼虫发育过程中形成的;在由早期体节幼虫发育至体节幼虫期间,幼虫体节逐渐完善;在由体节幼虫向蠕虫状幼虫的发育过程中幼虫体节消失。分析单环刺螠幼虫转录组中hairy和hedgehog的FPKM值,发现两个靶基因在四个发育时期幼虫中均表达,其表达量均随幼虫发育逐渐升高。其中hairy在早期体节幼虫中的表达量较晚期担轮幼虫显著增加,约提高1.4倍,之后的各期幼虫中未见显著差异;hedgehog在体节幼虫中的表达量较早期体节幼虫显著增加,约提高1.3倍(见图4)。
2.3 hairy和hedgehog在单环刺螠幼虫中的定位表达
整体原位杂交结果显示,单环刺螠hairy和hedgehog的mRNA均在中期担轮幼虫纤毛环和口处呈现明显的阳性信号(见图5 A1、A2);至晚期担轮幼虫,靶基因在其下半球处呈现条带状表达模式(见图5 B1、B2),这种条带状分布特点一直维持到体节幼虫,并且随着发育表达条带更加清晰(见图5 C1~F1、C2~F2);至蠕虫状幼虫,靶基因的条带状表达模式消失,转而弥散于体壁及消化道处(见图5 G1、G2)。但未见hairy的体节间隔式表达特征。
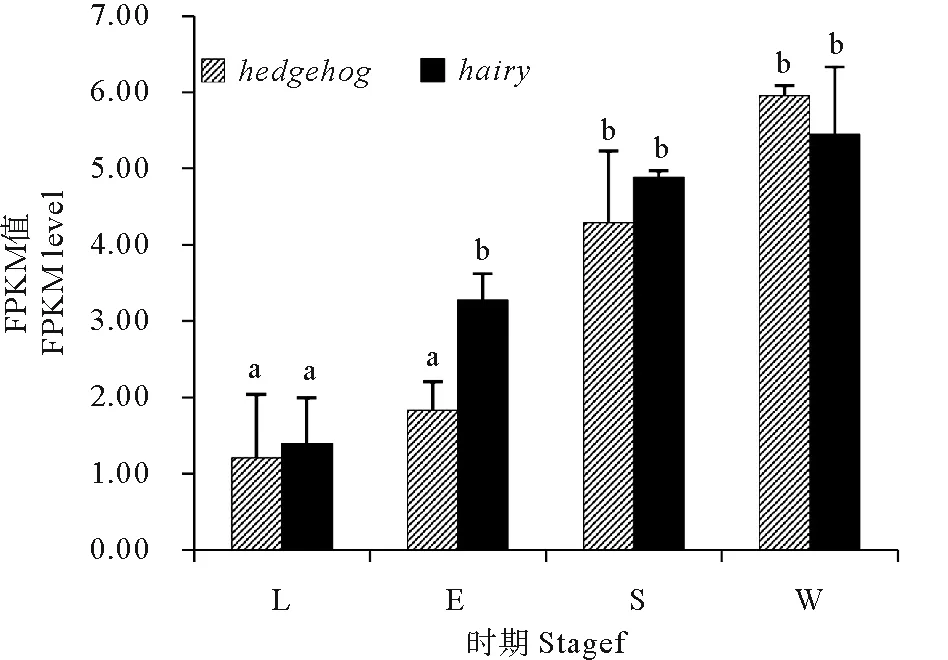
(L:晚期担轮幼虫;E:早期体节幼虫;S:体节幼虫;W:蠕虫状幼虫;所有数据均为平均值(n=3),同一基因不同字母表示不同时期幼虫中的表达量存在显著性差异(P<0.05)。L: late-trochophore larva; E early-segmentation larva; S: segmentation larva; W: worm-shaped larva; Date are indicated as the mean from three independent samples with duplicates. For each gene, different letters indicate significant differences(P<0.05)among the larvae at the different stages.)
图4 单环刺螠幼虫发育过程中hairy和hedgehog的表达量
Fig.4 Expression levels ofhairyandhedgehoginU.unicinctusduring the larval development

(A:中期担轮幼虫;B:晚期担轮幼虫;C:早期体节幼虫;D~F:体节幼虫;G:蠕虫状幼虫。A~E:腹面观,F、G:侧面观。星号指示口的位置。A: mid-trochophore larva; B: late-trochophore larva; C: early-segmentation larva; D~F: segmentation larva; G: worm-shaped larva. A~E are ventral view; F & G are lateral view. The asterisks point to the mouth.)
图5hairy和hedgehog在单环刺螠幼虫中的原位杂交检测
Fig.5 Location ofhairyandhedgehogmRNA inU.unicinctuslarvae detected by whole mountinsituhybridization
3 讨论
本研究获得的单环刺螠靶序列 ORF全长888 bp,其预测氨基酸序列中含有Hes家族蛋白保守的HLH结构域(与DNA结合后调节转录)、Hairy_Orange结构域(调节Hes蛋白异源二聚体形成)和C端保守四肽(转录抑制域);同时还具有Hairy的保守特征,即:在其HLH结构域第6位是脯氨酸,其C端四肽是WRPW[2,5,7];初步确定本研究获得的靶序列是单环刺螠hairyORF全长。比较不同物种Hariy保守结构域的氨基酸序列一致性发现,HLH结构域序列的保守性高于Hairy_Orange结构域;反映了与DNA结合并调控转录的HLH结构域在各物种间更加保守,而调节Hes蛋白二聚体形成的Hairy_Orange结构域序列则具物种间特异性。进一步分析发现,单环刺螠Hairy的HLH结构域、Hairy_Orange结构域以及整个氨基酸序列均与环节动物小头虫对应序列之间的一致性最高,分别为81.03%、57.14%和69%,提示单环刺螠可能与环节动物小头虫亲缘关系最近。
hairy调控体节发生的功能已在多种节肢动物中报道。在长胚基昆虫果蝇(D.melanogaster)中,hairy呈现体节间隔的表达模式,由此被定义为成对控制基因[2-4]。然而,在短胚基昆虫杂拟谷盗(Triboliumconfusum)和中胚基昆虫白腹皮蠹(Gryllusbimaculatus)以及多足纲球马陆(Glomerismarginata)和蛛形纲游走蛛(Cupienniussalei)中,hairy定位于每一个体节中,而非果蝇中的间隔体节表达特征[5-6, 17-19]。在环节动物沙蚕、小头虫和有爪动物栉蚕中,hariy/hes也呈现按节分布的条带状表达模式[7-8, 20],可见大部分体节物种中hairy均呈现按节分布的表达特点。本研究结果显示,单环刺螠hairy自晚期担轮幼虫开始便呈现条带状表达,至体节幼虫时定位于每一个幼虫体节的边界处。这一表达特征与中、短胚基昆虫、有爪动物和环节动物等典型体节动物中的表达模式基本一致,但不同于果蝇中的体节间隔表达模式。
Bianchi-Frias等[4]揭示,在hairy突变的果蝇中,hairy下游基因表达区域扩大并失去体节极性,导致全部体节不能发生;在杂拟谷盗中,hairy调控其头节分化与发育[5];在白腹皮蠹中,hairy则调控腹节形成[6]。在环节动物小头虫中,hairy/hes1信号定位于体节形成区域,并略早或同步于体节形成过程,因而被认为可能参与其体节形成[7];在有爪动物栉蚕中,hairy信号并不定位于胚胎末端的体节形成区域且其条带状信号出现时体节已经形成,因而被认为不参与体节形成[8]。在单环刺螠幼虫体节形成过程中,条带状hairy信号早于体节形成过程出现并主要定位于即将形成体节的幼虫下半球,这与小头虫中情况较为一致;由此,本研究者推测hairy可能参与了单环刺螠幼虫体节形成过程。然而,hairy在单环刺螠幼虫体节形成过程中所发挥的具体功能及调控区域尚不明确,仍需后续实验验证。
在节肢动物和环节动物中,hedgehog定位于副体节或体节的边界处,参与体节边界的界定和维持,由此被确定是一个保守的体节极性基因[9-12]。本研究结果显示,hedgehog在单环刺螠尚未发生形态可见的幼虫体节之前(晚期担轮幼虫)便呈条带状表达特征,当发育至体节幼虫时其定位于幼虫体节的边界。提示hedgehog在单环刺螠幼虫体节中的功能与已报道典型体节物种中的功能一致,即参与幼虫体节的边界维持[12]。
谢跃洋[13]基于组织学观察发现,单环刺螠幼虫体节形成模式类似于小头虫的侧增殖带法,据此提出单环刺螠与环节动物小头虫亲缘关系最近。本研究通过对单环刺螠hairy和hedgehog序列特征及其在幼虫体节发生过程中的表达图式分析,发现其均与环节动物小头虫的特征最接近,本研究结果也谢跃洋的观点一致。

