外泌体形成及在免疫调节中的作用研究进展
孙金生,陆美伊
(天津师范大学生命科学学院,天津 300387)
外泌体(exosomes)是动物组织细胞形成并释放到外周血液和体液中的大小为40~150 nm 的扁盘状细胞外囊泡,1983 年由 Pan 和 Johnstone 等[1-2]首次在体外培养绵羊网织红细胞的过程中发现并加以命名,同时,他们证实外泌体包裹了细胞膜转铁受体蛋白等内容物和网织红细胞成熟时丢失的一些成分[3].之后,人们发现外泌体中包裹了mRNA 和microRNA 等遗传物质,并在B 淋巴细胞的抗原呈递和刺激T 细胞增殖过程中发挥了重要作用[4-5],这也导致人们开始关注外泌体在免疫相关功能中的作用.2013 年,James Rothman、Randy Schekman 和 Thomas Südof 因发现了细胞内囊泡运输的调控机制获得了诺贝尔生理学或医学奖[6].外泌体最初只在哺乳动物细胞中被发现,后来陆续从虾蟹类、鱼类和鸟类中分离到外泌体.迄今,已经发现外泌体广泛存在于血液[7]、唾液[8]、尿液[9]、乳汁[10]、羊水[11]及腹水等体液中,并证实体内和体外培养的各种免疫细胞[12]、上皮细胞[13]、内皮细胞[14]、间充质干细胞[15]、神经细胞和肿瘤细胞[16]等都能分泌外泌体.随着研究的不断深入,外泌体强大的生物学功能正在一步步被阐释,它在免疫学以及免疫治疗等方面的优越性也使其更加受研究者们的青睐.本文综述了外泌体的形成、生物学功能以及在免疫调节中的作用和研究进展.
1 外泌体的结构与形成
外泌体是由细胞释放到细胞外环境中的膜囊泡(extracellular vesicles,EVs)的一种,在透射显微镜下,外泌体具有典型的杯状形态,如图1 所示[17].外泌体由脂质双分子层包裹,大小为40~150 nm,密度为1.10~1.21 g/mL,包含核酸(microRNA、mRNA 等)、蛋白质和脂质等生物信息[18-20].EVs 具有高度异质性[21],依据其大小和细胞内起源可分为3 类,即微泡(microvesicle)、凋亡小体(apoptotic body)和外泌体(exosome).微泡是由细胞表面的膜泡向外出芽和分裂产生的,直径为100~1 000 nm,可由多种细胞类型的质膜脱落而来[22].凋亡小体是指凋亡细胞释放的直径为1 000~5 000 nm的膜囊泡[23].而外泌体是由活细胞分泌的内吞起源的膜性小泡[18],其形成过程较复杂.Mathivanan 等[18]综合前人的研究结果勾勒了外泌体的形成过程,如图2 所示.细胞发生内吞后,内吞的细胞膜形成数个小囊泡,小囊泡相互融合形成了早期内体(early endosome),逐渐成熟的早期内体膜多处凹陷并向内出芽形成管腔状囊泡(intraluminal vesicle,ILVs)的晚期内体(late endosome).富含ILVs 的内体称为多囊体(multivesicular body,MVBs),MVBs 有 2 个去向:一部分 MVBs 与溶酶体融合,其内容物发生降解;另一部分MVBs 与细胞膜融合,释放ILVs 到细胞外环境,这些分泌的ILVs即为外泌体[24-25].
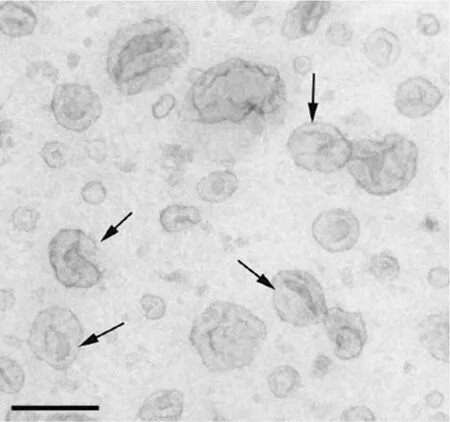
图1 从黑色素瘤细胞中分离的外泌体的超微结构[17]Fig.1 Ultrastructure of exosomes from melanoma cells[17]
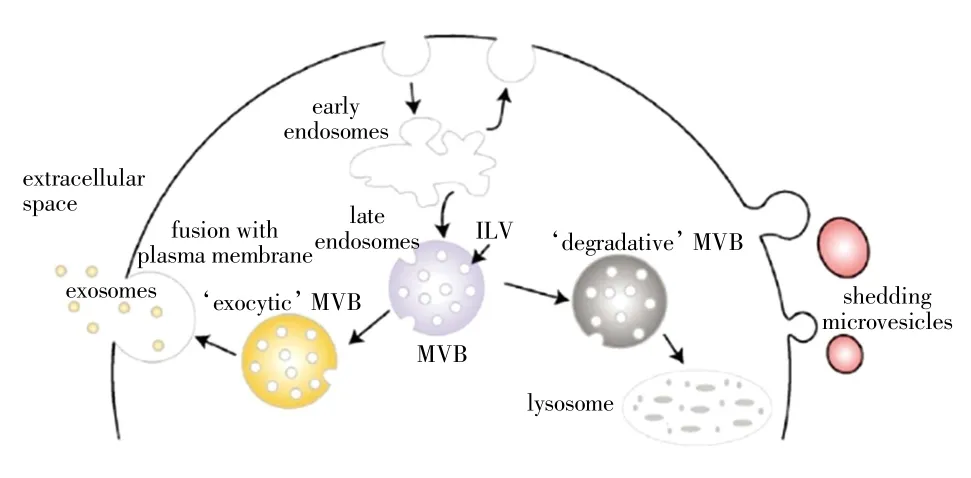
图2 外泌体和微泡的形成和释放过程[18]Fig.2 Formation and secretion process of exosomes and microvesicles[18]
迄今,人们已经发现了2 种以ILVs 为前提的外泌体形成途径[26].一种是依赖内体分选转运复合物(endosomal sorting complex required for transport,ESCRT )的形成途径,ESCRT 复合物主要参与泛素化膜蛋白的识别、分选并将其转运进内体.ESCRT 由大约20 个蛋白质组成,它们与辅助蛋白质(VPS4、VTA1、ALIX 等)结合,形成 4 种复合体(ESCRT-0、ESCRT-Ⅰ、ESCRT-Ⅱ和ESCRT-Ⅲ)[27].其中,ESCRT-0 含有肝细胞生长调节因子酪氨酸激酶底物(Hrs)和信号转导衔接分子(STAM),可以共同识别内体膜中泛素化的蛋白质,并与网格蛋白相互作用将其富集起来;ESCRT-Ⅰ和ESCRT-Ⅱ一起作用,诱导内体膜装载特异性的物质向内出芽;ESCRT -Ⅲ剪切芽颈促使囊泡分离,最后辅助蛋白质VPS4 在ESCRT 的分离和再结合循环过程中发挥作用[28].另一种是Trajkovic 等[29]发现的ESCRT非依赖的形成途径,通过神经酰胺等作用辅助生成MVB及 ILVs.中性鞘磷脂酶(neutral sphingomyelinase,nSMase)可介导鞘磷脂水解生成神经酰胺(ceramide),抑制中性鞘磷脂酶会使神经酰胺的生成减少,进而降低了MVB 膜的内向生芽作用,最终使得外泌体的释放减少,这说明神经酰胺以不依赖ESCRT 的作用形成外泌体.目前尚不清楚许多类型的外泌体内容物,如蛋白质、脂类和核酸等,是否由相同的机制释放.Kosaka等[30]通过nSMase2 的过表达和敲除实验,结合nSMase抑制剂的使用,提出miRNAs 是通过神经酰胺依赖的途径释放.
MVBs 与细胞膜融合将外泌体释放到细胞外的过程受到一些调控分子的作用.Théry 等[31]最先对树突状细胞来源的外泌体进行蛋白质组学的研究,鉴定出了该外泌体含有RAB 家族成员.RAB 家族是一种小GTP 酶蛋白,控制着细胞内囊泡的出芽、脱壳、运动和融合[32].K562 细胞中含有大量的Rab11,过表达Rab11突变体可抑制外泌体的释放,表明Rab11 可调控外泌体通路[33].Ostrowski 等[34]发现 Rab27a 和 Rab27b 参与了MVBs与质膜的对接,敲除Rab27 或其效应分子SYTL4和EXPH5 可抑制细胞分泌外泌体.另外,Yu 等[35]发现P53 调控的基因产物TSAP6 可以提高细胞外泌体的产生.
2 外泌体的生物学功能
外泌体可将参与生理或病理过程的生物分子从母体细胞转移到受体细胞,是细胞间通讯的有效方式.综合过去的研究结果,推测外泌体与受体细胞有3 种互作方式[5,18,36]:①外泌体膜蛋白与靶细胞表面的特异性受体结合,激活细胞内信号通路;②外泌体可直接与靶细胞膜融合,在受体靶细胞内释放来源于母细胞的蛋白质、mRNA、miRNA 等外泌体内容物;③受体细胞通过内吞作用等机制内化外泌体并对外泌体转移的物质作出反应,调节其基本功能和基因表达.因此,外泌体通过转运母细胞信息发挥作用,内容物含量是影响其作用的关键因素.
目前,ExoCarta 数据库收录了外泌体中发现的9 769 种蛋白质、3 408 种 mRNA、2 838 种 miRNAs和1 116 种脂质.外泌体包裹和运输的蛋白质有2 类:一类是不同类型细胞分泌的外泌体均含有的一些相似的蛋白质分子,如4 个跨膜蛋白家族(CD9、CD63、CD81 和 CD82)、热休克蛋白(Hsp70、Hsp90)、多囊体内合成蛋白TSG101 和Alix、酶类和信号转导蛋白等,这类蛋白质通过与外泌体生物发生过程中的组分相互作用被整合到外泌体中,调节融合、迁移和黏附到靶细胞[23],如Hsp90 可与细胞质膜融合促进变形,从而刺激外泌体的释放[37],这些蛋白可作为鉴定外泌体的Marker分子;另一类蛋白是外泌体包裹的母细胞来源的特异性蛋白,可使外泌体具有不同的功能,如免疫细胞分泌的外泌体包含来源于母细胞的天然免疫蛋白等.关于外泌体包裹的核酸的研究报道最多.Valadi等[5]早在2007 年就发现了人类和小鼠肥大细胞系来源的外泌体都含有RNA,且同时包含具有某些功能的mRNA 和microRNA,mRNA 在受体细胞中可被翻译成新的蛋白质,miRNA 可与mRNA 相互作用,发挥广泛的调节作用.此外,外泌体还含有DNA、长链非编码RNA(IncRNA)、环状 RNA(circRNA)、小核 RNA(snRNA)等.Jeppesen 等[38]指出,细胞外dsDNA 是通过自噬和MVE 依赖、外泌体独立的机制分泌的.与亲代细胞膜相比,外泌体的脂质成分富含胆固醇和鞘磷脂,其介导的脂质转运参与多种生理病理过程[39].
外泌体含有母体细胞来源的各种蛋白,人们通过分离、检测和表征外泌体的蛋白质来反映母体细胞的生理和病理状况,外泌体蛋白已成为许多类型疾病的非侵入性诊断和预后生物标志物.如黑色素瘤患者血浆中表达CD63 和Caveolin-1 的外泌体水平较高,可作为诊断标志[40];上皮细胞黏附分子(EpCAM)可作为生物标志物用于卵巢癌的诊断及肿瘤衍生外泌体的检测;CD24 则与卵巢癌预后不良有关[41].外泌体中miRNA的含量比母细胞高[42],是外泌体中功能最丰富的RNA[43],这使得miRNA 可作为不同疾病的生物标志物.如miR-372 被用作结直肠癌的诊断和预后生物标志物[44];miR-373、miR-200a、miR-200b 和 miR-200c 可以作为卵巢癌的诊断和预后生物标志物[45].另外,相对于脂质体等药物载体,外泌体由于在结构和组成上与细胞膜相似,具有良好的生物相容性,因此能够深入组织并逃避免疫系统,将药物运送至靶器官且具有较低的毒性,是理想的药物纳米载体[23].
3 外泌体在免疫调节中的作用
多种免疫细胞,如树突状细胞(dentritic cells,DCs)、巨噬细胞、自然杀伤(natural killer,NK)细胞及 T 淋巴细胞、B 淋巴细胞等都能分泌外泌体,通过参与抗原呈递或转运杀伤性蛋白、炎症因子等物质,在免疫细胞与免疫细胞和免疫细胞与靶蛋白之间传递重要信息,调节固有免疫和获得性免疫[46].
3.1 树突状细胞
树突状细胞是免疫系统中功能最强的专职抗原呈递细胞,在天然免疫和适应性免疫中发挥作用[47].Zitvogel 等[47]发现树突状细胞除了分泌细胞因子和其他细胞接触外,还可以利用核内体来源的分泌囊泡(外泌体)与免疫系统内的其他细胞进行交流.树突状细胞来源的外泌体(DCex)由脂质双分子层包裹的细胞质物质和插入的跨膜分子组成[48],后者表达DC质膜上的生物活性分子,如MHCⅠ、Ⅱ类分子、细胞间黏附分子(ICAM-1)及T 细胞共刺激分子CD80、CD86等[49-50].DCs 的成熟状态对DCex 的功能发挥也有着重要作用.研究显示[51],成熟的树突状细胞分泌的外泌体能够有效激活机体免疫反应,可用于肿瘤的免疫治疗;未成熟的树突状细胞分泌的外泌体在诱导免疫耐受方面发挥着重要功能,这为同种异体的器官或骨髓移植耐受以及治疗自身免疫性疾病带来了新的希望.Zitvogel 等[47]研究发现,对肿瘤抗原多肽敏感的树突状细胞分泌的外泌体对p815 小鼠乳腺细胞瘤具有抗肿瘤特性.目前,临床上也已经进行了人类树突状细胞来源的外泌体用于黑色素瘤和肺癌的治疗[52].
3.2 巨噬细胞
巨噬细胞来源的外泌体可介导炎症的免疫反应.受到脂多糖等抗原成分刺激的巨噬细胞分泌的外泌体内含有特定的细胞因子和microRNA,可以通过激活其他巨噬细胞内的核因子κB(nuclear factor κB,NF-κB)通路,提高多种细胞因子的分泌水平,增强机体的炎症反应[53-54].高血压可以导致巨噬细胞浸润血管,Os ada-Oka 等[55]研究发现,高血压条件下,巨噬细胞来源的外泌体可以增加内皮细胞内黏附分子-1(ICAM1)和纤溶酶原激活物抑制剂1(PAI-1)的蛋白水平,部分激活内皮细胞中的促炎信号通路.在上皮性卵巢癌(EOC)的低氧肿瘤微环境中,巨噬细胞产生的外泌体富含miR-223,通过PTEN/AKT 信号通路转移到EOC细胞中,同时增强了EOC 细胞的耐药性[56].肿瘤相关巨噬细胞(TAM)来源的外泌体通过靶向miR-146b-5p/TRAF6/NF-KB/MMP2 通路抑制内皮细胞的迁移,而EOC 来源的外泌体可以转移IncRNA,恢复内皮细胞的迁移功能[57].心肌损伤后,激活的巨噬细胞分泌富含miR-155 的外泌体,通过下调Sos1 蛋白的表达,抑制成纤维细胞的增殖,并促进炎症反应[58].肥胖会引起脂肪组织巨噬细胞数量增加[59-61].美国Jerrold M.Olefsky 团队[62-63]揭示,脂肪组织巨噬细胞的外泌体可播散至肝脏、脂肪、肌肉等组织,并借助其所含的miRNA,通过旁分泌或内分泌调节机制来参与调节胰岛素的敏感性,miR-155 是关键性因子.M2 巨噬细胞来源的外泌体(MED)高表达 miR-21-5p 和 miR-155-5p,通过MED转移到结直肠癌细胞中,下调BRG1 的表达,促使结直肠癌细胞发生迁移和侵袭[63].
3.3 淋巴细胞
3.3.1 T 淋巴细胞
T 淋巴细胞来源于骨髓的淋巴干细胞,在胸腺中分化、发育成熟后,通过淋巴和血液循环分布到全身的免疫器官和组织中发挥免疫功能.树突状细胞或B细胞可以通过细胞间分子将T 细胞外泌体从T 细胞转移到抗原呈递细胞(APC)中,从而引起APC 的调节和T 细胞反应的调节[64].洛桑大学Romano Regazzi 课题组[65]对非肥胖糖尿病(NOD)小鼠的研究发现,T 淋巴细胞释放含有miR-142-3p、miR-142-5p 和miR-155的外泌体,触发Ⅰ型糖尿病患者的受体胰腺β细胞中趋化因子的表达和凋亡,避免了糖尿病的发展.Francisco Sánchez-Madrid 课题组[66]证明 T 细胞可以在免疫突触形成过程中将外泌体转移到树突状细胞,外泌体中DNA 的转移引发树突状细胞中约1 600 个基因表达发生变化,这些基因中多数参与了抗病毒感染的保护.
3.3.2 B 淋巴细胞
B 淋巴细胞来源于骨髓的多功能干细胞,在抗原刺激下,B 淋巴细胞被激活和增殖,产生抗体,介导特异性体液的免疫应答.另外,活化的B 淋巴细胞具有加工和提呈抗原的作用.Wubbolts 等[67]对人体B 淋巴细胞来源的外泌体进行蛋白质组学测定,结果显示外泌体中存在大量的 MHCⅠ、MHCⅡ、Hsp70、Hsp90、细胞骨架蛋白等.Raposo 等[4]研究发现,人体B 细胞来源的外泌体可以在体外有效地将MHCⅡ类肽复合物(pMHC-Ⅱ)呈递给 CD4+T 细胞.Clayton 等[36]研究发现,B 细胞来源的外泌体在其外表面表达β1 和β2 整合素,可作为分子锚点介导与胶原蛋白、纤链蛋白等ECM 组分的黏附,在模拟炎症的条件下,还介导与活化成纤维细胞表面的结合.Wubbolts 等[67]发现,α4 整合素可将B 细胞来源的外泌体直接作用于滤泡树突状细胞.Zhang 等[68]研究发现,B 细胞衍生的CD39+CD73+Evs 可将肿瘤细胞ATP 水解成腺苷,从而抑制化疗后CD8+T 细胞反应,减少该EV 产生的增强化疗的效果.
3.3.3 NK 细胞
自然杀伤细胞(natural killer cell,NK)属于粒状淋巴细胞,是天然免疫系统的主要效应细胞,能有效介导肿瘤杀伤和免疫调节功能[69].尽管NK 细胞在特异性免疫和非特异性免疫中均发挥重要作用,但其外泌体的功能尚未得到充分的研究或认识.有研究表明[70],NK 细胞在静息和活化条件下均可释放外泌体,表达NK 细胞典型的蛋白标记物,包括杀伤蛋白,如Fas 配体(Fas ligand,FasL)和穿孔素分子等,它们在激活免疫效应细胞的同时,发挥强大的细胞毒作用,清除肿瘤细胞等,在机体免疫监测和稳态中发挥重要作用[24].Byeong-Cheol Ahn 研究组[71]发现,NK 细胞来源的外泌体对黑色素瘤细胞具有细胞毒性,但对正常细胞没有影响,并第一次证明NK 细胞外泌体含有TNF-α,可以影响黑素瘤细胞的增殖、存活和凋亡.Parolini 等[72]的研究表明,肿瘤微环境的低pH 会减少NK 细胞对穿孔蛋白/颗粒酶的释放,抑制Fas/FasL 相互作用,但酸性却有利于外泌体的释放和摄取,因此,NK 细胞外泌体的免疫治疗可能优于全NK 细胞治疗.
3.4 肥大细胞
肥大细胞(mast cells,MCs)广泛分布于骨髓、淋巴等组织,是IgE 介导的过敏反应的主要参与者,也是先天和特异性免疫反应的活跃参与者[73].研究证明[74],MCs 能够通过释放外泌体来激活B 淋巴细胞和T 淋巴细胞.2007 年,Valadi 等[5]发现来自小鼠和人类肥大细胞的外泌体含有RNA 及小RNA,包括microRNA,且肥大细胞外泌体可转移到其他小鼠和人类肥大细胞,其携带的mRNA 可以被翻译成新的蛋白质,microRNA可以调节靶细胞中mRNA 的水平.肥大细胞来源的外泌体可以诱导树突状细胞表型和功能成熟,并在体内引起特异性免疫应答.过敏性哮喘中,肥大细胞外泌体能够促进间充质干细胞向炎症部位迁移,协助间充质干细胞在过敏性哮喘中的治疗作用[75].肥大细胞来源的外泌体可显著上调内皮细胞纤溶酶原激活抑制剂1型(PAI-1)的分泌,并在PAI-1 水平的特征性升高与促凝状态之间提供反馈,表现为内皮细胞功能障碍[76].
3.5 血小板
血小板(platelet)是哺乳动物血液中最小的细胞[77].人的血小板来源的外泌体直径为50~120 nm,多由内源性多囊体(MVBs)分泌,较少来自α颗粒[78-79].先前已经发现脓毒症病人血小板来源的外泌体的NAD(P)H 氧化酶活性可促进血管细胞凋亡[80].Azevedo 等[81]的研究又发现,脓毒症病人血小板来源的外泌体可以降低离体心脏和乳头肌的心肌收缩力,且外泌体的这种作用因LPS 处理而增强.外泌体对受体细胞具有靶向特异性,血小板来源的外泌体可以识别内皮细胞和巨噬细胞,但不能识别中性粒细胞[82].
4 应用前景
外泌体作为一种新的细胞间通讯方式,近年来已被广泛研究并逐步运用到实践中.外泌体含有母细胞来源的蛋白质、核酸和脂质等,可以反映母细胞的生理及功能状态,可作为某些疾病的生物标志物和潜在的治疗工具.外泌体携带miRNA,与受体细胞作用后改变蛋白质表达并行使相应的生物学功能.外泌体中可装载物质的巨大变异性及其独特的生物学特性,使其成为强大的药物传递载体,并可进一步应用于临床.

