2018―2019年河南地区猪繁殖与呼吸综合征病毒分子流行病学调查
赵小月,张 格,汪 悦,刘红英,陈 宇,赵 军,王川庆,陈 陆,李永涛
(河南农业大学 牧医工程学院,河南 郑州 450046)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒( porcine reproductive and respiratory syndrome virus,PRRSV) 引起的一种以母猪流产、早产、产死胎和木乃伊胎等繁殖障碍及各阶段猪呼吸道症状为特征的传染病[1,2]。该病最早于1987年出现于美国,目前在全球大部分地区流行,至今仍为困扰世界养猪业的一大难题。我国于1996年首次报道分离到PRRSV[3],至今为止已历经20余年的流行及演变。2006年由PRRSV变异株引起的高致病性PRRS疫情在我国猪群大面积暴发,给我国养猪业造成了巨大的经济损失[4]。2012年本实验室首次发现并报道来源于美国的PRRSV类NADC30毒株(HENAN-HEB和HENAN-XINX)在我国猪群的流行[5]。此后,类NADC30毒株在我国北方相继出现并蔓延至全国。该类毒株之间致病性差异较大,且易与其他毒株发生重组,商品化疫苗尚不能对猪群进行有效保护,已成为威胁我国养猪业发展最主要的PRRSV类型。此外,自2010年PRRSV类QYYZ毒株在广东省出现以来,相继蔓延至我国南方各省,此后在西北、西南、华东和华中等地区均有报道。PRRSV类QYYZ毒株与其他类型毒株之间能够发生基因重组产生新的子代病毒,给养猪业疫病防控带来新的挑战。
目前,我国存在2种PRRSV类型,包括基因Ⅰ型和基因Ⅱ型。SHI等[12]根据8 624条PRRSV的ORF5序列将基因Ⅱ型PRRSV分为9个Lineage,每个谱系之间的遗传距离都大于11%,并将Lineage 1细分为9个Sublineage。ZHANG等[6]首次将Lineage 3进一步细分为5个Sublineage。我国猪群中目前流行Lineage 1,Lineage 3,Lineage 5,Lineage 8和Lineage 9等多种类型PRRSV毒株,其中 Lineage 1中的类NADC30毒株和Lineage 8中的类JXA1毒株是主要流行毒株[13]。河南地处中原、交通便利,作为我国重要的养猪大省和生猪调运大省,面临着更为严峻的动物疫病输入和传播风险。本实验室自2012年起持续监测PRRSV流行情况并追踪PRRSV流行和进化动态[14-15]。为了解2018―2019年河南地区PRRS流行现状和演化规律,本研究通过对采自河南省18个地市的414份临床样品进行PRRSV RT-PCR检测,并对阳性样品进行ORF5与NSP2基因扩增、测序和遗传进化分析,从而发现PRRSV最新的流行动态和遗传变异情况,为PRRS防控提供参考依据。
1 材料与方法
1.1 样品采集与处理2018年1月至2019年10月采自河南省18个地区94个猪场的414份猪的肺脏、脾脏和淋巴结样品,冻存于-80℃。
1.2 引物设计参照周峰等[15]根据GenBank中PRRSV CH-1a株(AF132118)、NADC30株(JN654459)和JXA1株(EF112445)设计针对ORF5和NSP2基因的2对特异性引物,并交河南尚亚生物科技公司合成。
1.3 RNA提取及反转录获取cDNA取采集病料组织样品,用PBS按照1∶5比例进行稀释后,充分研磨,将组织匀浆反复冻融3次,8 000 r/min离心8 min,取上清。参照Trizol reagent说明书提取RNA,将提取的RNA冻存于-80℃。
将提取的RNA反转录为cDNA,主要步骤为配置模板与引物预混物,70℃水浴10 min,4℃冰浴3 min 后,与反转录酶M-MLV (200 U/μL)、RNA酶抑制剂(40 U/μL)、dNTP(10 mol/mL)混合,42℃, 1 h;70℃,15 min反应后4℃冷却,得到cDNA保存于-20℃用于PCR检测。
1.4 基因序列的扩增将阳性样品的ORF5基因与NSP2基因的扩增产物通过胶回收纯化后克隆入pMD18-T载体,转化入大肠杆菌感受态细胞,扩大培养的菌液经PCR鉴定,挑选阳性克隆送河南尚亚生物科技公司测序。
1.5 PRRSV ORF5与NSP2基因的同源性分析与氨基酸比对将获得的ORF5与NSP2基因及其推导的氨基酸序列进行整理,通过DNAStar中的MegAlign与GenBank上公布的参考毒株序列进行同源性分析和氨基酸的遗传变异分析。
1.6 PRRSV的遗传进化分析将获得基因序列利用MegAlign进行序列比对,利用MEGA 6.0对获得的毒株序列与参考毒株序列进行遗传进化分析。
2 结果
2.1 河南地区PRRSV的检测结果对2018―2019年采自河南各地区的414份疑似PRRS的临床样品进行RT-PCR检测,共检测出PRRSV阳性样品106份,阳性率为25.48%。按地域划分,全省各地区猪群均存在PRRSV感染,尤其以焦作、鹤壁、安阳和新乡等豫北地区猪群阳性检出率较高,其中焦作阳性率最高(表1)。此外,根据采样时间统计发现,第四季度相对于其他季度阳性率较高,检出率为31.46%,其中2018年11月份PRRSV的检出率最高(37.04%),在季节交替的月份PRRSV阳性率也明显增高。
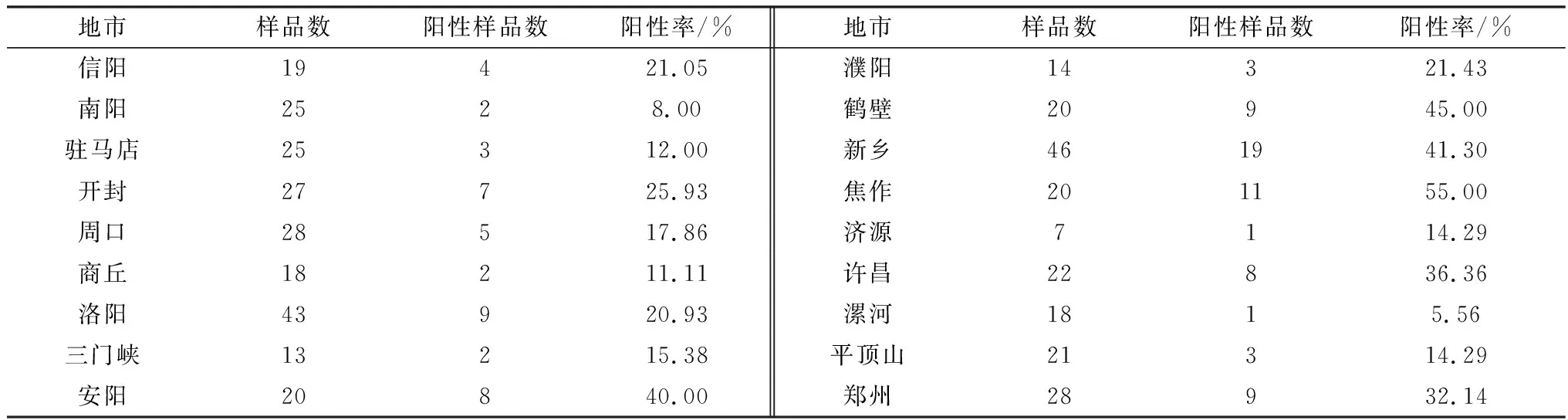
表1 河南各地市PRRSV阳性检出率
2.2 PRRSV ORF5和NSP2基因克隆、测序及遗传进化分析通过T-A克隆、筛选阳性质粒以及测序共获得83个PRRSV ORF5和31个NSP2基因序列。经遗传进化分析显示,31株PRRSV的 NSP2基因遗传进化分析分别和与之对应的ORF5基因遗传进化分析结果保持一致,均处于同一谱系(图1B,本研究毒株用红线表示)。2018―2019年在河南地区共检出4种类型,包括Lineage 1,Lineage 3,Lineage 5以及Lineage 8。其中74株PRRSV与NADC30处于同一进化分支,属于Lineage 1;6株PRRSV与QYYZ毒株处于同一进化分支,属于Lineage 3;2株PRRSV为类JXA1毒株,属于Lineage 8;仅检测到1株PRRSV 经典毒株属于Lineage 5(图1A)。
2.3 Lineage 1 的遗传进化分析本试验将已获得的74株Lineage 1 PRRSV与GenBank上69 株Lineage 1参考毒株的ORF5序列进行遗传演化分析,结果发现本研究检测到的74株PRRSV均为类NADC30毒株,且类NADC30毒株属于Sublineage 1.8(图2,Sublineage 1.8用红色表示),与上述研究结果一致。
2.4 Lineage 3的遗传进化分析本研究将检测到的6株类QYYZ毒株(用●标出)同GenBank 上34株Lineage 3 PRRSV(包含本实验室检测的河南地区5株用■标出) 的ORF5序列进行遗传进化分析(图3),发现检测到的6株类QYYZ毒株均为Sublineage 3.5,其中3株(HENAY-8、HENLY-11、HENLY-12)与河南地区流行毒株HENJY-1亲缘关系较近,而另外3株(HENXX-22、HENXX-29、HENXX-30)则与江西流行毒株JX1411的亲缘关系较近。通过遗传进化分析发现,本实验室2014-2016年检测到的5株PRRSV均为类QYYZ毒株,其中1株 HENNY-3属于Sublineage 3.2,也进一步说明河南地区早在2014之前便存在了Lineage 3的流行,且不仅是单一的Sublineage 3.5的流行。

图1 基于部分ORF5基因(A)与NSP2基因(B)构建PRRSV的遗传进化分析
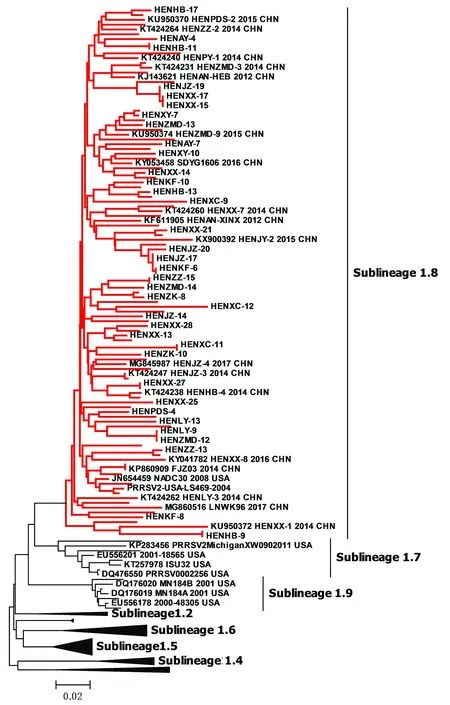
图2 74株Lineage 1 PRRSV遗传演化分析
2.5 PRRSV ORF5基因核苷酸和氨基酸序列分析ORF5基因核苷酸及推导的氨基酸序列比对发现,74株类NADC30毒株之间ORF5核苷酸序列相似性为86.1%~100.0%,氨基酸相似性为85.5%~100.0%;与美国NADC30毒株的氨基酸相似性为90.5%~96.5%,表现出较大的差异性。6株类QYYZ毒株之间核苷酸相似性为88.1%~99.5%,氨基酸相似性89.6.1%~100%,同QYYZ毒株氨基酸相似性为91.0%~94.5%。另有HENSQ-3和HENXC-13毒株序列与JXA1株的同源性较高,分别为99.2%和99.0%;1株(HENZZ-16)与经典疫苗毒株RespPRRS MLV的同源性为100.0%。

图3 Lineage 3 PRRSV遗传进化分析
83株PRSSV毒株GP5蛋白均存在氨基酸替换与突变。其中,74株类NADC30 毒株的变化较大,存在有不同程度的氨基酸的缺失与插入,4株在GP5蛋白第33位缺失1个氨基酸(以VR2332为参考),位于GP5蛋白的高变区HVR1(aa32-35),表现出相同特征性的核苷酸缺失模式;6株PRRSV在GP5蛋白上第57位插入1个赖氨酸(Lsy),该插入位点在GP5蛋白的高变区HVR2,部分代表毒株的氨基酸位点分析如图4(方框表示插入与缺失氨基酸位点);在GP5蛋白的第13位和第151位毒力相关氨基酸处,有45株类NADC30毒株与NADC30保持一致(Q13和K151),其余毒株的第13位和第151位毒力氨基酸均发生变化,其中HENXX-13与JXA1株毒力氨基酸相同(R13和R151)。

图4 10株缺失(插入)类NADC30毒株ORF5推导的氨基酸比对
2.6 PRRSV NSP2基因核苷酸及其推导的氨基酸序列分析31株PRRSV NSP2基因核苷酸序列及其推导的氨基酸序列变异分析显示,与VR2332和CH-1a株相比,出现多处氨基酸位点缺失和突变,其中29株PRRSV与NADC30毒株NSP2蛋白高度同源,与NADC30毒株存在相同缺失特征,即在322aa-432aa、483aa、504aa-522aa位缺失131个氨基酸;2株毒株(HENXX-12和HENXX-28株)在不连续的131氨基酸缺失基础上,在501aa-502aa新增加2个氨基酸缺失。此外,HENSQ-3毒株与JXA1毒株 NSP2蛋白高度同源,其在481aa位及533aa-561aa共有30个氨基酸的缺失;HENZZ-16与RespPRRSV MLV 毒株NSP2蛋白基本一致,氨基酸相似性高达99%(图5)。
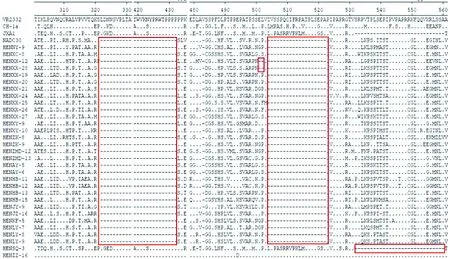
图5 31株 PRRSV NSP2推导的氨基酸比对
3 讨论
目前,PRRS依然是严重威胁我国养猪业发展的重大传染病之一,该病能引起母猪的繁殖障碍和仔猪呼吸困难,并在国内猪群广泛流行[2]。本研究对河南地区414份PRRSV 疑似样品进行RT-PCR 检测,共检出PRRSV阳性样品106份,阳性率达25.48%。与本实验室2012―2017年对河南地区PRRSV检测情况相比,整体上趋于稳定,但不同地市和不同月份阳性率差异较大。PRRSV对猪群的感染受季节变化的影响,在秋冬季节PRRSV的检出率较高,在季节交替的月份PRRSV阳性率也明显增多。
PRRSV基因变异分布于整个基因组,由于GP5为PRRSV结构蛋白,其具有病毒免疫保护相关的中和抗原表位和诱骗抗原表位[16],ORF5与NSP2是病毒基因组中变化最大的基因,因而通常将ORF5和NSP2作为病毒遗传变异与进化分析的靶基因。本研究测定的83株PRRSV的ORF5序列属于4种类型,即Sublineage 1.8(NADC30-Like),Sublineage 3.5(QYYZ-Like),Sublineage 8.7(HP-PRRSV-Like)和Sublineage 5.1(RespPRRS MLV-like)。74株PRRSV均属于NADC30-like(Sublineage 1.8),占所测毒株的89.15%,说明类NADC30毒株仍是河南地区最主要的流行毒株,但是74 株类NADC30毒株之间的核苷酸和氨基酸的同源性差异较大,提示河南地区类NADC30毒株不断进化、更加复杂。此外,6株类QYYZ(Sublineage 3.5)毒株分别与HENJY-1和JX1411的亲缘关系较近,说明河南类QYYZ毒株很有可能由外省流行毒株传入河南并在省内各地区传播,加剧了省内PRRSV流行毒株的复杂性和多样性。通过Lineage3 遗传进化分析发现,本实验室2014―2016年检测到的6株PRRSV亦属类QYYZ毒株,其中1株 HENNY-3属于Sublineage 3.2,也进一步说明河南地区早在2014之前便存在Lineage 3毒株,且不仅是单一的Sublineage 3.5的流行。
近几年Lineage 3 PRRSV在华南地区广泛流行,传播迅速,使其在PRRSV中的比例显著增加。研究表明中国流行的Sublineage 3.5 PRRSV是由中国台湾地区的Sublineage 3.2传至福建,由福建传至广东[6]。自2010年以来,中国至少有12个省份被检测到有Lineage 3的流行,亲缘关系分析显示绝大多数省份流行的Lineage 3毒株由广东传入。与类NADC30毒株相似,Lineage 3在田间与PRRSV的2个不同谱系之间存在频繁的重组。LONG等[18]报道的 PRRSV SCcd16毒株,是Lineage 3 PRRSV与Lineage 1和Lineage 8 PRRSV 同时发生的重组;此外,在福建省发现的1株PRRSV毒株(FJLIUY-2017),该毒株是在Lineage 1、Lineage 3、Lineage 5和Lineage 8之间存在的复杂的基因组重组PRRSV[19]。
NSP2蛋白是PRRSV最大的非结构蛋白,在病毒的复制过程中起着关键作用,其蛋白的高变区可耐受一定数量氨基酸的突变、插入或缺失。类NADC30毒株的NSP2蛋白的131个氨基酸不连续缺失,HP-PRRSV毒株NSP2蛋白存在30个氨基酸不连续缺失,类QYYZ毒株的NSP2区具有36个氨基酸的连续插入。本研究获得的31株PRRSV NSP2基因中,29株PRRSV与NADC30毒株存在相同缺失特征,HENXX-12和HENXX-28在不连续的131氨基酸缺失基础上,在501aa-502aa新增加了2个氨基酸缺失,将存在该种特殊缺失毒株的NSP2蛋白序列与GenBank中已收入的序列进行比对发现是一种新的缺失突变模式。此外,GP5是PRRSV变异最为明显的结构蛋白,包括N端信号肽区域、诱骗表位(Decoy)、中和表位(PNE)、2个高变区(HVRs)和3个跨膜区(zf7576)[22-23]。抗原位点位于GP5的N端,蛋白内的诱骗表位和数量不等的糖基化使重要的中和抗原位点变得不明显,从而阻碍了中和抗体的产生进而利于PRRSV的体内增殖[16]。本研究发现不同毒株GP5蛋白的氨基酸序列存在着显著差异,类NADC30毒株HENLY-8、HENLY-9、HENLY-10和HENZMD-12株第33位氨基酸的缺失发生在N端信号肽的B细胞表位(AR27-35)和邻近糖基化位点,可能对抗原表位存在空间阻位效应。此外,HENLY-11、HENLY-12、HENAY-8、HENXX-22、JENXX-29和HENXX-30毒株GP5蛋白第57位出现1个新的插入位点(Lys57),这种在GP5蛋白高变区出现的插入或缺失类型先前未有报道,该插入位点对病毒复制和致病性有何影响需进一步研究。
NADC30-like毒株传入我国时间虽然较短,但因其具有较强的基因变异和重组能力,迅速成为我国猪群中优势流行毒株。当前的商品化疫苗对类NADC30病毒的保护效果不理想,使猪场PRRS临床防控难度加大。本研究从74株NADC30-like毒株中随机选取2株进行全基因的扩增与重组分析发现,2株PRRSV毒株均为NADC30和JXA1-P100的重组毒株,说明了类NADC30毒株与HP-PRRSV 疫苗株之间重组的普遍性,那么商品化疫苗在猪场的使用可能会加剧类NADC30毒株在田间毒株类型的复杂性,值得我们警惕和监测。总而言之,类NADC30毒株已经成为河南地区最主要的流行毒株,HP-PRRSV毒株在逐渐减少,类QYYZ毒株的流行增加了PRRSV流行的复杂性。目前河南地区PRRSV遗传进化与流行都存在复杂性,主要体现在PRRSV毒株类型多样性、氨基酸变异普遍性、类NADC30毒株之间的较大差异性、类NADC30毒株重组高频性以及弱毒疫苗对强毒株的干扰性。合理使用商品化疫苗,做好毒株流通监测加大对类NADC30毒株的监测与防控尤为重要。

