Krüppel 样转录因子8 在乳腺癌中的研究进展△
翟秧秧,师鑫鹏,罗晓勇#
1郑州大学附属洛阳中心医院放疗科,河南 洛阳471009
2洛阳市肿瘤临床诊疗研究中心,河南 洛阳4710090
乳腺癌是女性最常见的恶性肿瘤之一,是中国女性主要的肿瘤死亡原因[1]。在中国,乳腺癌的年龄标化死亡率己达5.7/10 万[2]。现阶段乳腺癌的治疗方法主要是手术为主的综合治疗,包括放疗、化疗、内分泌治疗和靶向药物治疗等。研究发现,Ⅱ~Ⅲ期乳腺癌患者即使接受手术治疗或放化疗,5 年内仍有60%~70%的患者出现复发转移,而远处转移是乳腺癌患者死亡的主要原因之一[3]。目前认为乳腺癌的发生发展涉及肿瘤细胞自身生长优势,细胞间黏附能力降低,细胞骨架重构导致细胞运动、迁移,细胞凋亡、免疫杀伤和肿瘤血管、淋巴管形成等多种因素,加重了其治疗难度[4]。因此,乳腺癌的发生发展机制成为近年来研究的热点,Krüpple 样转录因子8(Krüppel like factor 8,KLF8)作为具有双重调节作用的转录因子越来越得到人们的重视。本文就KLF8 的生物学功能及其在乳腺癌中的研究进展做一综述。
1 KLF8 的生物学功能
Krüppel 样转录因子(Krüppel like factor,KLF)是一类具有锌指结构(即DNA 结合结构域)的基本转录因子,主要参与识别并结合DNA 序列中的CACCC 元件,它能够结合DNA 中的CC 盒或相关的CACCC 元件,进而调控富含CC 启动子的基因表达[5-6]。KLF8 与KLF 家族的其他成员结构相似,在羧基端含有3 个保守的C2H2 锌指结构,在氨基端含有可变的转录调节结构域。此外,KLF8 还通过蛋白相互作用发挥转录调节功能。
1.1 KLF8 对细胞周期的调节作用
黏着斑激酶(focal adhesion kinase,FAK)是一种细胞质蛋白酪氨酸激酶,在整合素介导的信号转导中具有重要作用[7]。Zhao 等[8]研究分析了FAK信号转导对细胞周期进程和细胞存活的影响,结果发现,FAK 可通过调节细胞周期调控相关基因的表达,进而影响细胞周期进程,而KLF8 基因是FAK 的特异性靶标,其表达受FAK 信号通路的正调控。该研究采用免疫印迹法检测蛋白表达,结果发现,KLF8 表达增加可导致细胞周期蛋白D1(cyclin D1)表达水平升高,从而促进细胞从G1期进入S 期,而KLF8-siRNA 可减缓细胞周期进程。该研究还发现,KLF8 可通过直接结合cyclin D1 启动子区域的GT 盒激活其表达。Wei 等[9]研究发现,KLF8 可以直接结合cyclin D1 启动子的GT 盒,从而激活其表达,KLF8 的泛素化降低了其介导的G1期细胞周期进程。Yi 等[10]研究发现,KLF8 在胰腺癌细胞系和组织中呈高表达,敲除KLF8 可导致胰腺癌细胞G2/M 期阻滞,周期蛋白依赖性激酶1(cyclin-dependent kinase 1,CDK1)/细胞分裂周期蛋白2(cell division cycle 2,CDC2)、细胞周期蛋白B1(cyclin B1)和cyclin D1 表达下调,而p21 和p27 表达上调。
1.2 KLF8 在血管生成中的作用
研究发现,在高表达KLF8 的SMMC7721 肝癌细胞中,血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、血管生成素2(angiopoietin 2,Ang2)、低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)、基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)的mRNA 表达水平增加,而VEGF、Ang2、HIF-1α和MMP2 在肿瘤的血管生成中具有至关重要的作用[11-13]。HIF-1α通过结合VEGF 启动子区域的低氧反应元件(hypoxic response element,HRE),在乏氧肿瘤细胞中上调VEGF 的表达[14]。基质金属蛋白酶(matrix metalloproteinase,MMP)可通过促进肿瘤细胞生长、侵袭、转移及血管生成而促进肿瘤进展。研究发现,MMP2 和MMP9 可诱导卵巢癌细胞中VEGF 的释放[15]。李旭等[11]将KLF8 基因转染至人肝癌SMMC7721 细胞中,通过定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)检测细胞中HIF-1α、VEGF、血管生成素1(angiopoietin 1,Ang1)、Ang2、血管生成素受体Tie2 及MMP2 的表达,结果发现,在肝癌细胞中,KLF8 可能通过调控VEGF、Ang2、HIF-1α、MMP2 的表达来调控血管生成。Cheng 等[16]研究发现,在肝癌细胞中KLF8 可通过结合血管内皮细胞生长因子A(vascular endothelial growth factor,VEGFA)启动子的CACCC 区域,上调VEGFA mRNA 的表达,此外,KLF8 还可以调控HIF-1α的表达。进一步研究发现,KLF8 在肝细胞癌中可通过调控磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)信号通路诱导VEGFA 的表达,进而调控肿瘤血管新生。
1.3 KLF8 在上皮间充质转化中的作用
上皮间充质转化(epithelial-mesenchymal transition,EMT)是肿瘤细胞从无创状态发展为侵入状态的决定性步骤,其主要特征包括细胞黏附分子(如E-钙黏素)表达减少、细胞角蛋白为主的细胞骨架转化为波形蛋白(vimentin)为主的细胞骨架及形态上具有间充质细胞的特征等。为研究KLF8 与肿瘤EMT 的关系,Wang 等[17]在几乎无内源性KLF8 表达的MDCK 犬肾上皮细胞和MCF-10A 人乳腺上皮细胞中通过逆转录病毒转染KLF8,免疫印迹检测结果显示,上皮标志蛋白E-钙黏素表达降低,间质标志蛋白N-钙黏素、波形蛋白表达升高,提示KLF8 在MDCK 和MCF-10A 上皮细胞中均可诱导EMT。该研究进一步进行启动子荧光素酶报告基因检测,结果发现,KLF8 通过直接与E-钙黏素基因启动子中的GT 盒结合来抑制其表达。
1.4 KLF8 在脂肪细胞分化中的作用
KLF 家族作为含锌指蛋白的转录因子,在细胞分化和增殖中发挥了重要作用。Lee 等[18]研究发现,敲除KLF8 基因后可显著减弱脂肪细胞分化。此外,过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)和CCAAT/增强子结合蛋白α(CCAAT/enhancer binding protein α,C/EBPα)作为多效性转录激活因子,可协同诱导脂肪细胞特异性基因的表达,从而形成成熟的脂肪细胞。荧光素酶检测结果显示,KLF8 过表达诱导了PPARγ和C/EBPα的转录活性,说明KLF8是PPARγ和C/EBPα的上游调控因子,提示KLF8 在脂肪细胞早期分化中具有重要作用。KLF 家族的其他成员也被证实在脂肪分化中具有重要作用,如KLF5、KLF6 和KLF15 均被证明能够促进脂肪形成[19-21],KLF15 还能够上调葡萄糖转运蛋白4(glucose transporter 4,GLUT4)的表达[21]。KLF3、KLF4 在脂肪形成中的作用也已经被证实,其中KLF3 通过招募C-末端结合蛋白(C-terminal binding protein,CTBP)辅助抑制因子抑制脂肪细胞分化[22],KLF4 基因敲除后阻止了脂肪的分化,但KLF4 并非脂肪分化的必要条件[23]。KLF 家族对脂肪分化的调节使其在肥胖控制中的作用逐渐引起人们的注意。
2 KLF8 在乳腺癌中的作用
KLF8 在乳腺癌发生发展中的作用见图1。
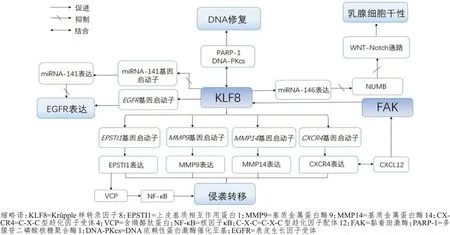
图1 KLF8在乳腺癌发生发展中的作用
2.1 KLF8 与乳腺癌侵袭和转移的关系
KLF8 是EMT 和肿瘤侵袭的重要诱导因子,除了通过抑制E-钙黏素转录来诱导EMT,KLF8 对细胞外基质的调节在肿瘤细胞的转移过程中也发挥着巨大的作用。MMP9、MMP14 均是MMP 成员,肿瘤细胞利用MMP 的蛋白酶降解细胞外基质,从而使肿瘤细胞以循环肿瘤细胞(circulating tumor cell,CTC)的形式存活下来,并在远处定植。研究发现,KLF8 可直接结合并激活人MMP9、MMP14基因启动子促进其表达,从而促进乳腺癌的侵袭和转移[24-25]。
上皮基质相互作用蛋白1(epithelial stromal interaction 1,EPSTI1)在侵袭性乳腺癌中高表达。裸鼠实验表明,EPSTI1 异位表达可使MCF-7 细胞具有乳腺浸润性生长和肺转移的能力,EPSTI1 是KLF8 转录激活的新靶点,通过激活含缬酪肽蛋白(valosin-containing protein,VCP)依赖性核因子κB(nuclear factor-κB,NF-κB)而在乳腺癌的侵袭性生长和转移中发挥关键作用[26]。C-X-C 型趋化因子受体4(C-X-C motif chemokine receptor 4,CXCR4)是C-X-C 型趋化因子配体12(C-X-C motif chemokine ligand 12,CXCL12)的受体,CXCR4 过表达与乳腺癌的生长和转移有关[27-29]。研究发现,在浸润性乳腺癌中,KLF8 通过直接结合CXCR4 基因启动子促进其表达,CXCL12 与CXCR4 的结合可导致FAK 激活,而FAK 作为KLF8 的上游诱导因子进一步促进KLF8 的表达,从而形成了正反馈循环[30]。这些研究结果表明,由KLF8、CXCR4 和FAK 组成的正反馈循环对促进乳腺癌转移具有关键作用。在乳腺癌中,KLF8 除了通过抑制E-钙黏素的表达促进EMT,还通过直接结合MMP9、MMP14、EPSTI1、CXCR4 基因启动子并促进其表达,进而促进乳腺癌的侵袭和转移。
2.2 KLF8 与乳腺癌细胞干性的关系
肿瘤干细胞(cancer stem cell,CSC)是一种具有自我更新、分化能力的肿瘤细胞亚群,被认为是肿瘤发生、发展、侵袭、转移、复发和对各种治疗方法产生抵抗的重要原因[31]。Wang 等[32]研究将乳腺细胞干性与肿瘤转化联系起来,使用四环素诱导KLF8 表达的MCF-10A 细胞系,验证其EMT 特性后,采用流式细胞仪检测人乳腺干细胞表面标志物CD44 高表达/CD24 低表达情况,结果发现,当诱导KLF8 的表达时,超过90%的细胞获得CD44 高表达/CD24 低表达模式,而未诱导KLF8 表达的细胞中只有33%的细胞获得此模式,提示KLF8 可通过EMT 诱导乳腺细胞干性。此外,因微小RNA(microRNA,miRNA)参与了乳腺细胞干性的调节[33],Wang 等[32]还通过检测过表达KLF8 的细胞中miRNA 的表达谱,发现miRNA-146a 在浸润性乳腺癌细胞(MDA-MB-231、Hs578T 和BT-549)中的表达显著上调,而在非浸润性乳腺癌细胞(MCF-7 和T47-D)中的表达未上调。进一步研究发现,miRNA-146a 可能通过抑制Notch 信号抑制物NUMB蛋白的表达,在诱导EMT 和维持乳腺癌细胞干性中发挥重要作用。
2.3 KLF8 与乳腺癌化疗耐药的关系
在正常细胞分裂的过程中有多种DNA 修复机制来保持基因组的完整性。DNA 损伤对肿瘤细胞的细胞毒性作用使得DNA 损伤剂成为肿瘤治疗的主力军。细胞毒性药物如多柔比星、环磷酰胺和柔红霉素可导致细胞产生DNA 单链断裂(single strand break,SSB),未能修复SSB 将导致DNA 双链断裂(double strand break,DSB)。SSB 和DSB 主要由多腺苷二磷酸核糖聚合酶1[poly(ADP-ribose)polymerase-1,PARP-1]和乳腺癌易感基因(breast cancer susceptibility gene,BRCA)或DNA 依赖性蛋白激酶(DNA dependent protein kinase,DNA-PK)修复,细胞中异常高水平的DNA 修复功能不仅可增加对细胞毒性药物的耐药性,而且由于DNA 修复不当导致的基因组和染色体不稳定性也可能增加细胞的恶性程度。研究发现,在多柔比星处理的乳腺癌细胞中,KLF8 与PARP-1 和DNA 依赖性蛋白激酶催化亚基(DNA-dependent protein kinase catalytic subunit,DNA-PKcs)相互作用并受其调控,提示KLF8 可能参与SSB 和DSB 修复过程,该研究明确地将KLF8 促进DNA 修复与细胞对多柔比星耐药联系起来[34]。
2.4 KLF8 与乳腺癌表皮生长因子受体信号通路的关系
表皮生长因子受体(epidermal growth factor receptor,EGFR)常常在侵袭性乳腺癌(如三阴性乳腺癌)中过表达,并与不良预后相关。Li 等[35]研究发现,在非肿瘤性乳腺上皮细胞系MCF-10A 中,KLF8 的过表达可诱导EGFR 表达,而在侵袭性乳腺癌细胞系MDA-MB-231 中,敲除KLF8 基因可降低EGFR 的表达。启动子激活和结合实验发现,KLF8 可以通过直接结合并激活EGFR 启动子促进EGFR 的表达,同时KLF8 还可以通过抑制miRNA-141 启动子,从而抑制其表达;而miRNA-141 可靶向EGFR 的3'非翻译区,从而抑制EGFR 的翻译,即KLF8通过抑制miRNA-141的表达间接促进了EGFR的表达。以上结果提示KLF8-miRNA-141/EGFR信号通路在乳腺癌的恶性进展中具有重要作用。
3 小结与展望
综上所述,KLF8 作为具有双重调节作用的转录因子,不仅能够调节细胞周期、血管生成、EMT及脂肪细胞分化,还能够通过促进乳腺癌侵袭和转移、维持乳腺癌细胞干性、促进化疗耐药及EGFR 表达,进而促进乳腺癌的发生发展。关于KLF8在乳腺癌中的作用机制还有待进一步研究,且目前尚未有研究针对KLF8 表达与乳腺癌患者临床特征及预后的关系进行分析,这为下一步的研究提供了思路。

