高糖条件下高表达ARNO对人肾小球内皮细胞通透性的影响及其作用机制
王小龙,胡成芳,唐璐瑶,李艺,官涛,黄云剑
陆军军医大学附属新桥医院肾内科,重庆 400037
研究表明,内皮细胞高通透性是糖尿病肾病、糖尿病视网膜疾病和糖尿病血管病变的重要始动因素之一,但是其确切的发生机制目前仍不清楚[1]。致使肾小球血管通透性增加的原因很多,如高糖、晚期糖基化终末产物形成、血管内皮生长因子(vascular endothelial growth factor,VEGF)增多、内源性一氧化氮(NO)减少、炎症及氧化应激等[2],但尚不清楚这些因素最终是否通过影响内皮细胞膜屏障功能而导致内皮细胞通透性增加。因此,有必要深入研究高糖对内皮细胞通透性的作用机制。
Arf6是小分子GTP酶,主要位于质膜及内含体膜上,参与调节细胞质膜运输及胞内肌动蛋白装配,从而涉及细胞通透性等多种生理功能的调节[3]。本课题前期研究已证实,高糖能通过上调Arf6活性而促进内皮细胞通透性增加,从而抑制其活性以保护高糖条件下人肾小球内皮细胞的通透性[4]。Arf6受GTP酶激活蛋白(GAPs)和鸟苷交换因子(GEFs)的共同调节[5-7]。ARNO(ARF nucleotidebinding-site opener)是目前报道最多的催化Arf6的GEFs[7]。多项研究表明,高表达ARNO能增加Arf6的活性,促进细胞膜表面血管内皮钙黏蛋白(vascular endothelial cadherin,VE-Cadherin)等连接蛋白内移,进而增加内皮细胞的通透性[8-9]。但ARNO对高糖环境下内皮细胞通透性的影响及相关机制尚不明确。因此,本研究通过观察高糖对内皮细胞ARNO表达的影响,探讨高糖环境下内皮细胞通透性与ARNO/Arf6的关系,旨在揭示高糖介导ARNO增加内皮细胞通透性的新机制。
1 材料与方法
1.1 细胞来源及主要试剂 人肾小球内皮细胞(HRGEC)由美国ATCC公司提供,保存于中南大学细胞库。RPMI 1640培养基、胎牛血清、青链霉素(美国Hyclone公司),胰蛋白酶(美国Gibco公司),异硫氰酸荧光素-右旋糖苷(西安瑞禧公司),Transwell小室(美国Corning公司),含绿色荧光的ARNO siRNA慢病毒、Arf6 siRNA慢病毒、阴性对照病毒及对应引物(上海吉凯公司),RNAiso Plus、RNA反转录试剂盒、cDNA扩增试剂盒(日本TaKaRa公司),兔抗ARNO抗体、Arf6活性检测试剂盒(英国Abcam公司),鼠抗GAPDH抗体(武汉三鹰公司),辣根过氧化物酶标记的鼠抗IgG、兔抗IgG(北京中杉金桥公司),聚偏氟乙烯膜(PVDF膜,重庆鼎今公司),5×蛋白上样缓冲液、Western blotting及IP细胞裂解液、BCA蛋白检测试剂盒(上海碧云天公司),D-甘露醇、D-葡萄糖(美国Solarbio公司)。
1.2 实验方法
1.2.1 体外培养HRGEC 将HRGEC培养于T25培养瓶中,在RPMI 1640培养基中加入10%胎牛血清和1%青链霉素,置于37 ℃、5%CO2细胞敷育箱中培养。细胞铺满培养瓶约80%时,PBS清洗细胞,0.25%胰蛋白酶37 ℃消化2 min,适量培养基终止胰酶消化并离心,重悬后以5×105个细胞/孔接种于6孔板(进行Arf6活性检测实验时,以5×106个细胞/瓶接种于T75培养瓶中),8 h贴壁后以1%血清培养基饥饿培养24 h。
1.2.2 高糖时间/浓度梯度依赖实验 高糖时间依赖实验:将细胞随机分为高糖对照组(30 mmol/L,0 min)、高糖(30 mmol/L)15 min组、高糖(30 mmol/L)30 min组、高糖(30 mmol/L)45 min组、高糖(30 mmol/L)60 min组、甘露醇组(40 mmol/L,30 min),进行相应刺激后,Western blotting检测ARNO表达,FITC-Dextran检测HRGEC细胞通透性。高糖浓度依赖实验:将细胞随机分为正常糖组(5 mmol/L)、高糖10 mmol/L组、高糖20 mmol/L组、高糖30 mmol/L组、高糖40 mmol/L组、甘露醇组,刺激30 min后Western blotting检测ARNO表达,FITC-Dextran检测HRGEC细胞通透性。
1.2.3 Western blotting检测ARNO、Arf6蛋白的表达 各组HRGEC每孔中加入200 μl含蛋白酶抑制剂的细胞裂解液,冰上裂解30 min,离心取上清,测定蛋白浓度,配平后加入5×蛋白上样缓冲液并煮沸。取各蛋白样品10 μl于12% SDS-PAGE凝胶中恒压电泳(110 V,90 min),恒流电转移至PVDF膜(200 mA,90 min),5%脱脂奶粉室温封闭1 h,以1:2000稀释ARNO抗体、1:350稀释Arf6抗体、1:5000稀释GAPDH抗体4 ℃孵育过夜,TBST漂洗,分别以辣根过氧化物酶标记的兔抗IgG和鼠抗IgG二抗室温孵育1 h,TBST再次漂洗并显影。
1.2.4 FITC标记葡聚糖(FITC-Dextran)检测HRGEC细胞通透性 以2×105/ml密度将各组HRGRC接种于Transwell小室(200 μl/孔),待细胞融合为单层后,加以相应条件的高糖刺激,经过相应时间后,PBS清洗上下室,上室加入200 μl FITC-Dextran,下室加入1200 μl PBS,孵箱孵育3 h后,吸取下室液体100 μl,用酶标仪在492 nm波长下检测吸光度(A)值。每组设3个复孔。单层内皮细胞对FITC-Dextran的通透性用通透系数Pa表示,计算方法如下:Pa=[A]/t×(1/A)×(V/[L]),其中[A]为顶室FITCDextran浓度(以荧光强度表示),t为时间(s),A为滤膜面积(cm2),V为底室液体量(ml),[L]为底室FITC-Dextran浓度(以荧光强度表示)。各处理组的通透性结果以Pa变化百分率(Pa%)表示,公式为:Pa%=实验组Pa/正常糖对照组Pa×100%。
1.2.5 慢病毒转染沉默ARNO、Arf6 将细胞分为正常糖未转染组、正常糖空载体组、正常糖ARNO siRNA组、正常糖Arf6 siRNA组。以1×105/ml的密度将HRGRC接种于24孔板中(500 μl/孔),贴壁后加入稀释病毒液(病毒总数/细胞总数=10),12 h后换液,待细胞长至80%融合后,加入嘌呤霉素(puromycin,PM,终浓度为2 μg/ml)进行筛选。转染后72 h于荧光显微镜下观察。待进行转录、表达验证后,得到沉默ARNO、Arf6的HRGEC。
1.2.6 Real-time PCR检测慢病毒转染HRGEC后ARNO、Arf6基因的转录 以RNAiso Plus法提取RNA,测定浓度并配平后,以反转录试剂盒将RNA反转录为cDNA,再用扩增试剂盒将cDNA扩增,以检测正常糖未转染组、正常糖空载体组、正常糖ARNO siRNA组(测ARNO转录时)、正常糖Arf6 siRNA组(测Arf6转录时)HRGEC的ARNO、Arf6基因转录水平,以GAPDH为内参。每个样本设3个复孔。引物序列见表1。
1.2.7 Western blotting测定Arf6活性 取未转染及转染空载体、ARNO siRNA的细胞,经高糖刺激后得到高糖未转染组、高糖空载体组及高糖ARNO siRNA组的HRGEC。在各组培养瓶中加入1 ml含蛋白酶抑制剂的测试缓冲液,冰上裂解15 min,离心,取240 μl上清作为input样本,加入60 μl 5×蛋白上样缓冲液并煮沸;取660 μl上清作为pulldown样本,补足1 ml后加40 μl GGA3 PBD琼脂珠,4 ℃摇晃孵育1 h,测试缓冲液清洗3次并吸尽上清后,加入40 μl 2×蛋白上样缓冲液并煮沸,然后将得到的蛋白样本按1.2.3方法进行定量分析。

表1 Real-time PCR中各引物的序列Tab.1 Sequence of primers in Real-time PCR
1.2.8 CCK-8法检测慢病毒对HRGEC细胞存活的影响 将细胞分为正常糖未转染组、正常糖空载体组、正常糖ARNO siRNA组、正常糖Arf6 siRNA组,以2×104/ml密度接种于96孔板(200 μl/孔),每组设3个复孔。48 h后加入CCK-8溶液10 μl,再次孵育1 h后,用酶标仪在450 nm波长下检测A值。
1.3 统计学处理 采用SPSS 22.0软件进行统计学分析,GraphPad Prism 7.0软件进行图表绘制。计量资料以表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 时间依赖实验中高糖对HRGEC ARNO表达及通透性的影响 Western blotting检测结果显示,与高糖对照组相比,高糖15、30、45、60 min组HRGEC ARNO表达明显升高;与高糖15 min组相比,高糖30 min组ARNO表达升高;与高糖30 min组相比,高糖45 min组ARNO表达回落;与高糖45 min组相比,高糖60 min组ARNO表达降低,差异均有统计学意义(P<0.05)。FITC-Dextran检测结果显示,与高糖对照组相比,高糖15、30、45、60 min组内皮细胞通透性明显增加;与高糖15 min组相比,高糖30 min组通透性增加;与高糖30 min组相比,高糖45 min组通透性下降;与高糖45 min组相比,高糖60 min组通透性下降,差异均有统计学意义(P<0.05)。甘露醇组与高糖对照组的HRGEC ARNO表达及内皮细胞通透性差异均无统计学意义(P>0.05,图1、表2)。

图1 时间依赖实验中高糖对HRGEC ARNO表达的影响Fig.1 Effects of high glucose on HRGEC ARNO expression in time-dependent experiments
表2 时间依赖实验中高糖对HRGEC ARNO表达及通透性的影响(±s,n=3)Tab.2 Effects of high glucose on ARNO expression and permeability of HRGECs in time-dependent experiments (±s,n=3)

表2 时间依赖实验中高糖对HRGEC ARNO表达及通透性的影响(±s,n=3)Tab.2 Effects of high glucose on ARNO expression and permeability of HRGECs in time-dependent experiments (±s,n=3)
与高糖对照组比较,(1)P<0.05;与高糖15 min组比较,(2)P<0.05;与高糖30 min组比较,(3)P<0.05;与高糖45 min组比较,(4)P<0.05。
组别 ARNO蛋白 Pa%高糖对照组 0.242±0.029 1.000高糖15 min组 0.670±0.051(1) 1.196±0.004(1)高糖30 min组 0.960±0.106(1)(2) 1.399±0.012(1)(2)高糖45 min组 0.716±0.026(1)(3) 1.301±0.052(1)(3)高糖60 min组 0.531±0.030(1)(4) 1.184±0.030(1)(4)甘露醇组 0.227±0.041 1.014±0.005 F 61.750 76.070 P<0.001 <0.001
2.2 浓度依赖实验中高糖对HRGEC ARNO表达及通透性的影响 Western blotting检测结果显示,与正常糖组相比,高糖20、30、40 mmol/L组HRGEC ARNO表达明显升高;随高糖浓度增加,ARNO表达呈递增趋势,差异均有统计学意义(P<0.05)。FITC-Dextran检测结果显示,与正常糖组相比,高糖10、20、30、40 mmol/L组内皮细胞通透性明显增加;随高糖浓度增加,内皮细胞通透性也呈递增趋势,差异均有统计学意义(P<0.05)。甘露醇组与正常糖组的HRGEC ARNO表达及内皮细胞通透性差异无统计学意义(P>0.05,图2、表3)。根据以上时间和浓度依赖实验结果,本研究选择30 mmol/L高糖刺激30 min作为后续的高糖刺激条件。

图2 浓度依赖实验中高糖对HRGEC ARNO表达的影响Fig.2 Effects of high glucose on HRGEC ARNO expression in concentration-dependent experiments
表3 浓度依赖实验中高糖对HRGEC ARNO表达及通透性的影响(±s,n=3)Tab.3 Effects of high glucose on ARNO expression and permeability of HRGECs in concentration-dependent experiments (±s, n=3)

表3 浓度依赖实验中高糖对HRGEC ARNO表达及通透性的影响(±s,n=3)Tab.3 Effects of high glucose on ARNO expression and permeability of HRGECs in concentration-dependent experiments (±s, n=3)
与正常糖组比较,(1)P<0.05;与高糖10 mmol/L组比较,(2)P<0.05;与高糖20 mmol/L组比较,(3)P<0.05;与高糖30 mmol/L组比较,(4)P<0.05。
组别 ARNO蛋白 Pa%正常糖组 0.169±0.033 1.000高糖10 mmol/L组 0.220±0.030 1.147±0.015(1)高糖20 mmol/L组 0.632±0.031(1)(2) 1.237±0.023(1)(2)高糖30 mmol/L组 0.927±0.041(1)(3) 1.351±0.015(1)(3)高糖40 mmol/L组 1.183±0.098(1)(4) 1.444±0.019(1)(4)甘露醇组 0.269±0.041 0.991±0.033 F 132.400 166.700 P<0.001 <0.001
2.3 慢病毒对H R G E C的转染及转染后各组ARNO、Arf6基因转录、表达水平的影响 转染慢病毒72 h后,荧光倒置显微镜下可见正常糖空载体组、正常糖ARNO siRNA组、正常糖Arf6 siRNA组的HRGEC均为绿色荧光,转染效率均达80%(图3)。CCK-8法检测结果显示,正常糖未转染组、正常糖空载体组、正常糖ARNO siRNA组、正常糖Arf6 siRNA组的吸光度分别为1.262±0.036、1.330±0.097、1.312±0.189、1.355±0.067,差异无统计学意义(F=0.244,P=0.864),即各组的细胞存活率无明显差异。Real-time PCR及Western blotting检测结果显示,转染ARNO siRNA、Arf6 siRNA后,正常糖ARNO siRNA组、正常糖Arf6 siRNA组HRGEC内ARNO、Arf6基因转录及表达水平均低于正常糖未转染组,差异有统计学意义(P<0.05),正常糖空载体组与正常糖未转染组的ARNO、Arf6转录及表达水平差异均无统计学意义(图4、表4、图5、表5)。

图3 转染后各组HRGEC在荧光倒置显微镜下的图像(×100)Fig.3 Images of HRGECs in each group after transfection with lentivirus under fluorescence inversion microscope (×100)

图4 转染ARNO siRNA慢病毒后HRGEC中ARNO蛋白的表达Fig.4 Expression of ARNO protein in HRGECs after infection with ARNO siRNA recombinant lentivirus vectors
表4 转染ARNO siRNA慢病毒后HRGEC中ARNO mRNA转录及蛋白的表达(±s,n=3)Tab.4 Transcription of ARNO mRNA and expression of ARNO protein in HRGECs after infection with ARNO siRNA recombinant lentivirus vectors (±s, n=3)
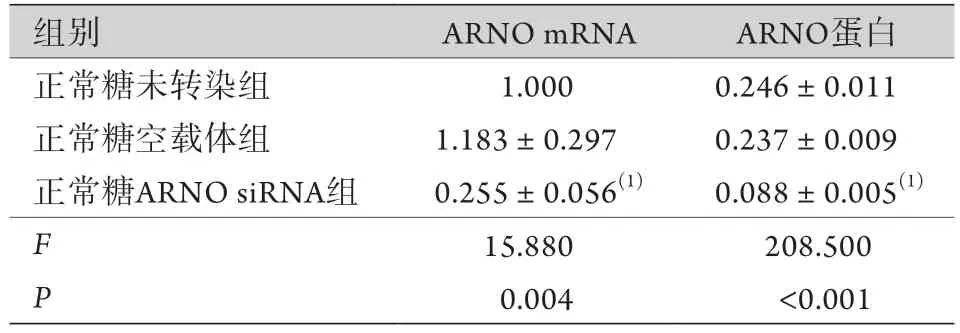
表4 转染ARNO siRNA慢病毒后HRGEC中ARNO mRNA转录及蛋白的表达(±s,n=3)Tab.4 Transcription of ARNO mRNA and expression of ARNO protein in HRGECs after infection with ARNO siRNA recombinant lentivirus vectors (±s, n=3)
与正常糖未转染组比较,(1)P<0.05。
组别 ARNO mRNA ARNO蛋白正常糖未转染组 1.000 0.246±0.011正常糖空载体组 1.183±0.297 0.237±0.009正常糖ARNO siRNA组 0.255±0.056(1) 0.088±0.005(1)F 15.880 208.500 P 0.004 <0.001

图5 转染Arf6 siRNA慢病毒后HRGEC中Arf6蛋白的表达Fig.5 Expression of Arf6 protein in HRGECs after infection with Arf6 siRNA recombinant lentivirus vectors
表5 转染Arf6 siRNA慢病毒后HRGEC中Arf6 mRNA转录及蛋白的表达(±s,n=3)Tab.5 Transcription of Arf6 mRNA and expression of Arf6 protein in HRGECs after infection with Arf6 siRNA recombinant lentivirus vectors (±s, n=3)

表5 转染Arf6 siRNA慢病毒后HRGEC中Arf6 mRNA转录及蛋白的表达(±s,n=3)Tab.5 Transcription of Arf6 mRNA and expression of Arf6 protein in HRGECs after infection with Arf6 siRNA recombinant lentivirus vectors (±s, n=3)
与正常糖未转染组比较,(1)P<0.05。
组别 Arf6 mRNA Arf6蛋白正常糖未转染组 1.000 0.917±0.009正常糖空载体组 1.140±0.236 0.919±0.009正常糖Arf6 siRNA组 0.314±0.090(1) 0.690±0.012(1)F 18.400 328.800 P 0.003 <0.001
2.4 沉默ARNO对高糖刺激诱导HRGEC的Arf6活性及通透性的影响 Western blotting及FITC-Dextran检测结果显示,沉默ARNO后,与高糖未转染组及高糖空载体组相比,高糖ARNO siRNA组的ARNO蛋白、Arf6-GTP(即Arf6活性)及细胞通透性均明显降低,差异有统计学意义(P<0.05,图6、表6)。

图6 沉默ARNO后高糖刺激诱导HRGEC的ARNO表达及Arf6活性Fig.6 ARNO expression and Arf6 activity of HRGECs induced by high glucose stimulation after ARNO silencing
表6 沉默ARNO后高糖刺激诱导HRGEC的ARNO蛋白表达、Arf6活性及通透性(±s,n=3)Tab.6 ARNO expression, Arf6 activity and permeability of HRGECs induced by high glucose stimulation after ARNO silencing (±s, n=3)

表6 沉默ARNO后高糖刺激诱导HRGEC的ARNO蛋白表达、Arf6活性及通透性(±s,n=3)Tab.6 ARNO expression, Arf6 activity and permeability of HRGECs induced by high glucose stimulation after ARNO silencing (±s, n=3)
与高糖未转染组及高糖空载体组比较,(1)P<0.05。
组别 ARNO蛋白 Arf6活性 Pa%高糖未转染组 0.915±0.005 0.484±0.014 1.000高糖空载体组 0.916±0.012 0.490±0.008 0.978±0.040高糖ARNO siRNA组0.572±0.021(1)0.263±0.007(1)0.718±0.017(1)F 386.700 341.700 78.690 P<0.001 <0.001 <0.001
2.5 沉默Arf6对高糖刺激诱导HRGEC的Arf6表达及通透性的影响 Western blotting及FITC-Dextran检测结果显示,沉默Arf6后,与高糖未转染组及高糖空载体组相比,高糖Arf6 siRNA组的Arf6蛋白表达及内皮细胞通透性均明显降低,差异有统计学意义(P<0.05,图7、表7)。

图7 沉默Arf6后高糖刺激诱导HRGEC的Arf6表达Fig.7 Arf6 expression of HRGECs induced by high glucose stimulation after Arf6 silencing
表7 沉默Arf6后高糖刺激诱导HRGEC的Arf6表达及通透性(±s,n=3)Tab.7 Arf6 expression and permeability of HRGECs induced by high glucose stimulation after Arf6 silencing (±s, n=3)

表7 沉默Arf6后高糖刺激诱导HRGEC的Arf6表达及通透性(±s,n=3)Tab.7 Arf6 expression and permeability of HRGECs induced by high glucose stimulation after Arf6 silencing (±s, n=3)
与高糖未转染组及高糖空载体组比较,(1)P<0.05。
组别 Arf6蛋白 Pa%高糖未转染组 0.932±0.020 1.000高糖空载体组 0.899±0.022 0.978±0.040高糖Arf6 siRNA组 0.673±0.015(1) 0.768±0.050(1)F 109.200 24.020 P<0.001 0.001
3 讨 论
小分子GTP酶Arf6可调节膜内外物质的转运及包膜的重塑,血管内皮的屏障功能受Arf6活性调控[10]。许多炎性因子如肿瘤坏死因子及内毒素脂多糖诱导的内皮高通透性是通过Arf6实现的,而Robo4能抑制Arf6的活性,增加细胞膜钙依赖性黏附素的表达,进而稳定内皮的屏障功能[11-13]。白细胞介素-1(IL-1)刺激内皮细胞高通透性也与ARNOArf6通路活化有关[8]。VEGF165及纤黏蛋白诱导的内皮细胞迁移及渗漏也与Arf6活性增加有关,应用SecinH3(ARNO抑制剂)可抑制其作用[13]。内皮素-1(ET-1)刺激内皮细胞的迁移及成管能力也与Arf6活性有关[14]。在高糖条件下,内皮细胞周围存在高浓度的血管活性因子如IL-1、肿瘤坏死因子、VEGF、ET-1等,但它们是否通过ARNO活化Arf6启动内皮高通透性目前尚不清楚,因此有必要研究高糖条件下ARNO的表达及其对Arf6活性的影响。
细胞膜的许多生理活动主要靠小G蛋白GTPGDP的精确转换来调控,以达到细胞生理的精确要求,避免反应过度或不足。小G蛋白Arf6的活化受到GAPs和GEFs的共同调节,GAPs是负调节因子,可催化与Arf6结合的GTP水解成GDP而抑制其活性,而GEFs是正调节因子,能促进Arf6-GDP向Arf6-GTP的转换从而激活Arf6。ARNO是目前报道最多的催化Arf6的GEFs。本研究发现,高糖是肾小球内皮细胞ARNO表达的正诱导剂,与正常糖组相比,高糖可刺激内皮细胞ARNO表达升高,该作用呈浓度依赖性(20~40 mmol/L)及时间依赖性(15~30 min)。细胞通透性检测发现内皮细胞通透性改变与ARNO表达趋势一致,提示内皮细胞通透性可能与ARNO表达有关。另外,在时间依赖实验中发现,30 mmol/L高糖处理肾小球上皮细胞45 min后ARNO表达和通透性有所回落,说明高糖体外刺激对肾小球内皮细胞通透性的作用45 min后会衰减,该现象同样被Swärd等[15]证实,提示内皮细胞可能通过某种机制下调ARNO,启动应急的负调控机制平衡或恢复内皮的屏障功能。Xie等[16]发现,这种负调控机制于1周后减弱,内皮细胞高通透性又会呈现出来,因此认为这与Robo4表达下调有关。综上,本研究推测,短期(60 min内)高糖诱导的细胞通透性调控可能与ARNO/Arf6活化有关,长期高糖诱导的通透性调控可能与Robo4表达不足导致Arf6活化有关,而高糖长期作用已经在本课题组前期实验(48 h以上)[4]及Xie等[16]的实验(5 d以上)中证实。
为了证实ARNO/Arf6信号通路参与高糖诱导的内皮高通透性改变,笔者进一步构建了ARNO siRNA和Arf6 siRNA重组慢病毒载体感染HRGEC,获得沉默ARNO和Arf6的HRGEC细胞株,分别了解ARNO和Arf6基因沉默对内皮细胞通透性的影响。结果发现,沉默ARNO后高糖刺激诱导的高活性Arf6明显降低,内皮细胞通透性也同时降低。重要的是,沉默Arf6后高糖诱导的内皮细胞通透性改变被逆转,说明高糖诱导的内皮高通透性是通过ARNO/Arf6信号通路实现的。许多实验发现,阻断ARNO/Arf6信号活化能稳定炎性条件下的内皮屏障功能。其中,Mannell等[17]发现,VEGF诱导的血管内皮新生及高通透性是通过ARNO实现的,基因沉默ARNO可减弱VEGF对内皮的作用;Zhu等[18]进一步发现,糖尿病视网膜病变的ARNO/Arf6信号与VEGF/VEGFR-2信号有关,VEGF诱导的内皮VEGFR-2内化须通过ARNO/Arf6信号活化才能完成,小分子Arf6抑制剂NAV-2729可明显抑制VEGF诱导的体外培养内皮细胞的高通透性及糖尿病小鼠视网膜血管的高通透性;Davis等[19]也发现,阻断Arf6活性可阻断脂多糖诱发的内皮渗漏并提高内毒素小鼠的成活率;Zhu等[8]发现,SecinH3可抑制胶原诱导的关节炎模型的血管炎性渗出,其机制也与Arf6的失活有关。
综上所述,ARNO/Arf6活化参与了高糖诱导的肾小球内皮高通透性,抑制ARNO/Arf6信号可能是今后糖尿病内皮细胞高通透性治疗的新靶点。

