云芝浸膏对小鼠CCl4肝损伤保护作用机制研究
冯耀培,宋娟,郑斯文,曲正义,姚丽娜,王英平
(中国农业科学院特产研究所,吉林 长春 130112)
病毒性肝炎发病率在当今社会日趋增加,逐渐成为影响人们生活的元凶。CCl4肝损伤模型作为经典模型,研究较为广泛。CCl4进入机体后,在肝细胞色素P450 影响下,被代谢产生氯仿自由基(CCl3·),引起肝组织细胞脂质过氧化,并对细胞膜和细胞器造成损伤[1],其损伤特点与人类病毒性肝炎类似[2-3]。因此,建立CCl4肝损伤模型,开展对CCl4肝损伤保护作用研究具有重要意义。
云芝,多孔菌科真菌彩绒革盖菌〔Coriolus versicolor(L.ex Fr.)Quel〕的干燥子实体,是一种常用中药,收录于《中国药典》一部2015年版[4],具有明显的消炎保肝、抗氧化等生物活性[5-7],因此,云芝成为当下研究的热点。已有研究人员开展云芝多糖对免疫性、酒精性和乙酰氨基酚导致的肝损伤的保护作用研究[8-10],取得较好疗效。本实验室前期开展云芝提取物对酒精肝损伤保护作用研究,初步得出CVE能缓解酒精造成的小鼠肝脏损伤,具有较好治疗效果。因此,基于CVE对酒精肝损伤具有良好保护作用,分别从肝脏病理、肝脏功能以及脂质过氧化等方面进行试验,开展CVE对小鼠 CCl4肝损伤的保护作用研究,并探讨其作用机制,为临床应用提供试验依据。
1 材料与试剂
1.1 实验动物
ICR 小鼠,雄性,18.0~22.0 g,6 月龄。购于长春亿斯实验动物技术有限公司,许可证号:SCXK(吉)-2015-0001。
1.2 材料
云芝材料采自吉林省延边州汪清县林区,经吉林农业大学宋慧教授鉴定为多孔菌科彩绒革盖菌(C.versicolor Quel)的干燥子实体。
云芝浸膏(Coriolus versicolor extract,CVE)由本实验室提取完成,提取过程为将700.0 g 云芝清洗干净,加入12 倍量的蒸馏水,蒸煮3.0 h;第2 次再加入10 倍量蒸馏水,继续蒸煮3.0 h。所得浸膏即为试验所需药物,试验时,用生理盐水将其稀释为所需浓度。
1.3 试剂
谷丙转氨酶(ALT)试剂盒(批号:20180622)、谷草转氨酶(AST)试剂盒(批号:20180622)、总胆红素(TBIL)试剂盒(批号:20180622)、甘油三酯(TG)试剂盒(批号:20180622)、总胆固醇(TC)试剂盒(批号:20180622)、低密度脂蛋白(LDL-C)试剂盒(批号:20180622)、高密度脂蛋白(HDL-C)试剂盒(批号:20180622)、小鼠血清肿瘤坏死因子-酶联免疫(TNF-)试剂盒(批号:S20180819CW)、小鼠血清白介素-6酶联免疫(IL-6)试剂盒(批号:S20180819CW)、小鼠血清白介素-1 酶联免疫(IL-1 )试剂盒(批号:S20180819CW)、丙二醛(MDA)试剂盒(批号:20180622)、超氧化物歧化酶(SOD)试剂盒(批号:20180622)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(批号:20180622)、过氧化氢酶(CAT)试剂盒(批号:20180622),以上试剂均购于南京建成生物工程研究所;H & E 染色试剂盒(批号:20170612,上海碧云天生物技术有限公司);生理盐水(辽宁民康制药有限公司);水飞蓟素(陕西森弗天然制品有限公司);鲁花花生油(山东鲁花集团公司);无水乙醇、甲醛、二甲苯、四氯化碳等均为国产分析纯。
1.4 仪器与设备
TGL-16 K 型离心机(湖南湘仪离心机厂);HH-4型恒温水浴锅(常州澳华仪器公司);FA 1004 B 型电子天平、YP 5002 型电子天平(上海越平科学仪器有限公司);BioTek-Epoch 型酶标仪(美国BioTek 公司);SK 5200 H型超声波清洗器(上海科导超声仪器有限公司);LEICA EG 1150 H 型包埋机、LEICA RM 2255 型切片机(德国徕卡公司);KD-T 型摊片机(浙江省科迪仪器设备有限公司);Coyote-Bio G 200 型组织匀浆破碎仪(卡尤迪生物科技);OLYMPUS BX 53 型光学显微镜〔奥林巴斯(中国)有限公司〕。
2 方法
2.1 分组
将试验小鼠适应性饲养5d,随机分6组,每组10只。分别为阴性对照组、模型组、水飞蓟素组(50.0mg/kg)及CVE 低(50.0 mg/kg)、中(100.0 mg/kg)、高(300.0 mg/kg)剂量组。
2.2 试验设计
保持动物饲养室温度为25±2 ℃,自由饮食。隔日称重,根据体重调整给药量,剂量为10 mL/(kg·d),周期30 d,末次给药后,禁食不禁水16 h。阴性对照组灌胃花生油,其余各组均灌胃1% CCl4花生油溶液建立肝损伤模型,剂量为5 mL/kg[11],2 h 后解剖。摘眼球取血待测血清相关指标;脱颈处死,取肝左叶,固定,待做病理学研究,取肝右叶置于液氮内,待测肝组织相关指标。
2.3 指标测定
2.3.1 血清指标检测 摘眼球取血,4 ℃冰箱内静置2 h,后于冷冻离心机内,4 ℃,3 500 r/min 离心 10 min。取上清,以相同条件再次离心,分装,置于 80 ℃冰箱内待测血清 ALT、AST、TBIL、TC、TG、LDL-C、HDLC、TNF-、IL-6 和IL-1等生理生化指标。具体操作步骤按照试剂盒说明书进行。
2.3.2 肝组织病理切片检查 取固定后的肝组织,切成规则方形小块(0.75 1.00 0.75 cm),置于包埋盒内。流水冲洗、脱水、浸蜡和包埋等步骤。切3m 厚度切片,摊片、烤片、H & E 染色,置于光学显微镜下观察各组小鼠肝组织病理变化,并拍照。
2.3.3 肝组织匀浆指标检测 取保存于液氮内的肝组织样本,用生理盐水制作10%浓度匀浆,4℃,2500r/min离心10 min,取上清用于检测蛋白质含量、MDA、SOD、CAT 和GSH-Px 等相关指标。具体操作步骤按照试剂盒说明书进行。
2.4 数据分析
3 结果
3.1 小鼠肝组织病理变化

图1 小鼠肝脏病理形态Fig.1 Liver pathomorphology in mice
由图1 H & E 染色结果显示,阴性对照组肝细胞,圆润饱满、清晰可见,且细胞核呈规则圆形、胞质丰富,胞浆未见细胞破碎、坏死及炎性浸润等现象(图1A)。模型组小鼠肝组织细胞损伤严重,中央静脉周围可见大量细胞碎片状坏死及脂肪变性(图1B),表明CCl4肝损伤模型造模成功。阳性对照组小鼠肝组织细胞出现碎片状坏死及脂肪变性,但损伤程度得到明显的改善(图1C),显著低于模型组。CVE 各给药组小鼠肝组织细胞均出现碎片状坏死及脂肪变性现象(图1D、E、F),但损伤程度均低于模型组。结果表明,CVE 可以改善CCl4造成的肝脏脂肪变性及细胞碎片状坏死,且高剂量组效果最佳。
3.2 小鼠血清转氨酶相关指标
由表1 可得,与阴性对照组相比,模型组小鼠血清转氨酶ALT、AST活力均显著性升高(P<0.05);相较于模型组,CVE 各给药组均显著降低ALT、AST 活力(P<0.05),且呈现剂量依赖性,同时高剂量组效果强于阳性对照组。
表1 小鼠血清AST、ALT 活力Table 1 Serum AST and ALT activities in mice (±s,n=10)

表1 小鼠血清AST、ALT 活力Table 1 Serum AST and ALT activities in mice (±s,n=10)
注:与阴性对照组比:#P < 0.05,##P < 0.01;与模型组对比:*P < 0.05,**P < 0.01。下表同。Note:Compared with the normal group: #P < 0.05,##P < 0.01;Compared with the model group: *P < 0.05,**P < 0.01.The follwing table is the same.
组别 Groups剂量〔mg/(kg·d)〕 Dosage ALT 活力(U/L) levels of ALTAST 活力(U/L) levels of AST阴性对照组 Negative control group 50.11±29.59 47.44±13.99模型组 Model group 290.53±1.02## 215.25±22.00##阳性对照组 Positive control group 50 284.21±4.83** 194.14±15.43*CVE 低剂量组 CVE low-dose group 50 283.70±4.85** 181.74±14.09**CVE 中剂量组 CVE middle-dose group 100 279.12±2.00** 166.25±24.4**CVE 高剂量组 CVE high-dose group 300 277.60±7.14** 180.45±15.62**
3.3 小鼠血清脂肪相关指标
由表2 可得,与阴性对照组相比,模型组小鼠血清TBIL、TG、TC、LDL-C 含量显著升高,且HDL-C 含量显著降低(P <0.05)。阳性对照组TBIL、TG、TC、LDL-C 含量均低于模型组,且TBIL、TC 的含量显著降低(P < 0.05),HDL-C 含量显著升高(P < 0.05)。CVE各浓度组TBIL、TG、TC、LDL-C含量与模型组相比,显著降低(P < 0.05);HDL-C 含量升高,但仅有高剂量组HDL-C 含量的显著增高(P <0.05)。总体而言,小鼠血清各项指标CVE 高剂量组效果最佳。
表2 小鼠血清 TBIL、TG、TC、LDL-C、HDL-C 含量Table 2 Serum TBIL,TG,TC,LDL-C and HDL-C content in mice (±s,n=10)

表2 小鼠血清 TBIL、TG、TC、LDL-C、HDL-C 含量Table 2 Serum TBIL,TG,TC,LDL-C and HDL-C content in mice (±s,n=10)
组别Groups剂量〔mg/(kg·d)〕Dosage TBIL( mol/L)TG(mmol/L)TC(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)阴性对照组 Negative control group 1.11±0.68 2.44±0.46 4.60±0.44 0.45±0.11 2.44±1.07模型组 Model group 10.50±2.59## 3.05±0.72# 7.15±0.68## 0.80±0.14## 1.48±0.54#阳性对照组 Positive control group 50 5.64±1.57** 2.56±0.30 4.17±0.96** 0.65±0.17 1.94±0.24*CVE 低剂量组 CVE low-dose group 50 6.49±2.17** 1.83±0.39** 3.78±0.57** 0.38±0.05** 1.67±0.61 CVE 中剂量组 CVE middle-dose group 100 7.34±1.71* 1.51±0.34** 3.44±0.96** 0.36±0.13** 1.88±0.53 CVE 高剂量组 CVE high-dose group 300 4.96±2.18** 1.29±0.30** 2.85±0.78** 0.33±0.11** 2.05±0.25*
3.4 小鼠血清炎性因子相关指标
表3 小鼠血清 TNF- 、IL-6、IL-1 含量Table 3 Serum TNF- ,IL-6 and IL-1 content in mice (±s,n=10)
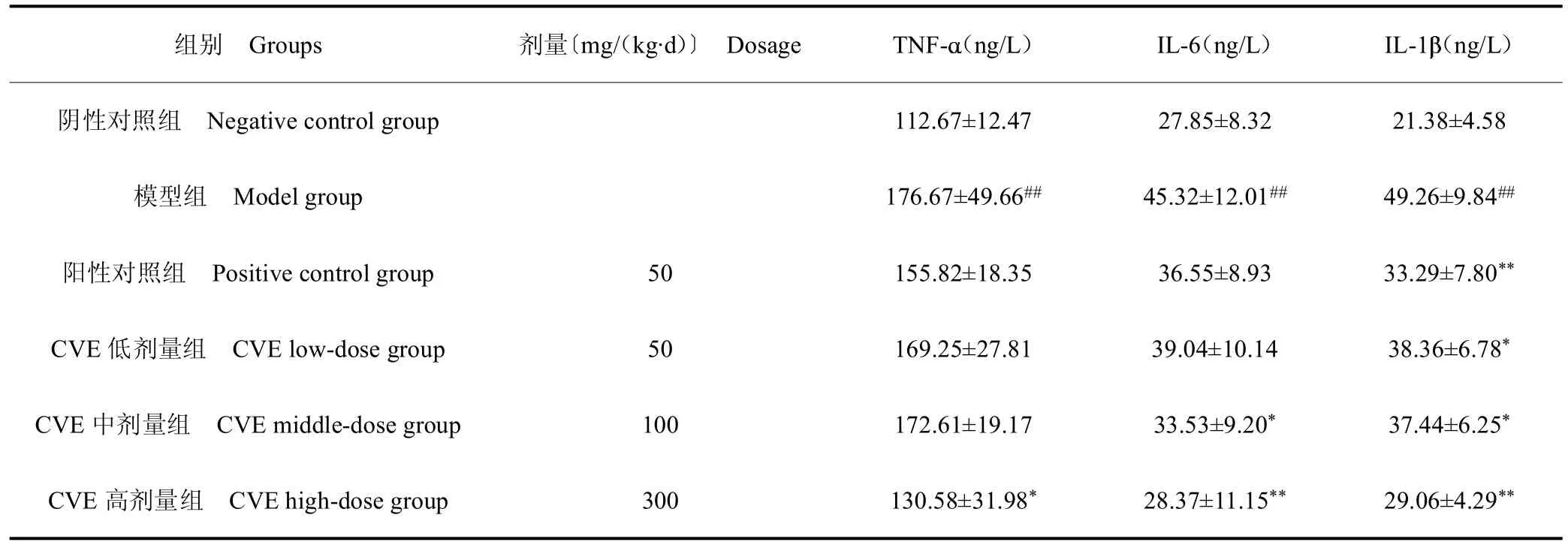
表3 小鼠血清 TNF- 、IL-6、IL-1 含量Table 3 Serum TNF- ,IL-6 and IL-1 content in mice (±s,n=10)
组别 Groups剂量〔mg/(kg·d)〕 DosageTNF-(ng/L)IL-6(ng/L)IL-1(ng/L)阴性对照组 Negative control group 112.67±12.47 27.85±8.32 21.38±4.58模型组 Model group176.67±49.66## 45.32±12.01## 49.26±9.84##阳性对照组 Positive control group 50 155.82±18.35 36.55±8.93 33.29±7.80**CVE 低剂量组 CVE low-dose group 50 169.25±27.81 39.04±10.14 38.36±6.78*CVE 中剂量组 CVE middle-dose group 100 172.61±19.17 33.53±9.20* 37.44±6.25*CVE 高剂量组 CVE high-dose group 300 130.58±31.98* 28.37±11.15** 29.06±4.29**
3.5 小鼠肝组织氧化还原相关指标
由表4 可得,与阴性对照组相比,模型组小鼠肝组织 SOD、CAT 及 GSH-Px 活力降低,除 GSH-Px 活力外其余差异均显著(P<0.05);MDA含量显著升高(P<0.01)。阳性对照组SOD、GSH-Px 及CAT 活力均高于模型组,除GSH-Px 活力外其余差异均显著(P <0.05);MDA 含量低于模型组。CVE 各组 SOD、CAT及 GSH-Px 活力均高于模型组(P < 0.01);MDA 含量均低于模型组,且高剂量组各项指标均差异显著(P<0.05)。试验结果表明,小鼠肝组织匀浆各项指标CVE高剂量组效果最佳。
表4 小鼠肝组织SOD、GSH-Px、CAT 活力及MDA 含量Table 4 The levels of SOD,CAT,GSH-Px activities and MDA content in liver tissues in mice (±s,n=10)
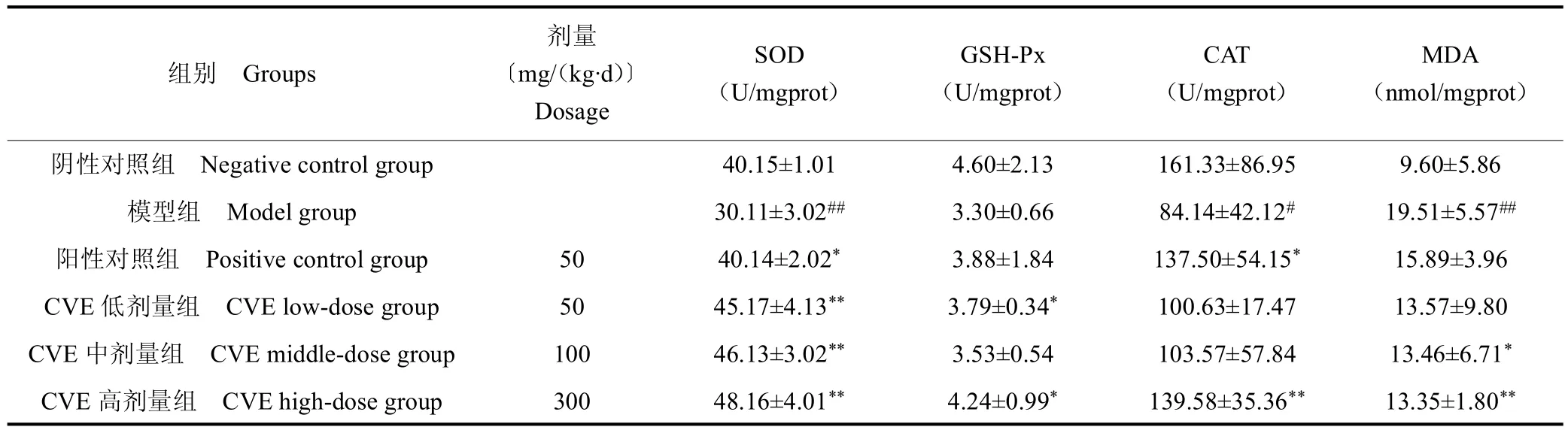
表4 小鼠肝组织SOD、GSH-Px、CAT 活力及MDA 含量Table 4 The levels of SOD,CAT,GSH-Px activities and MDA content in liver tissues in mice (±s,n=10)
组别 Groups剂量〔mg/(kg·d)〕Dosage SOD(U/mgprot)GSH-Px(U/mgprot)CAT(U/mgprot)MDA(nmol/mgprot)阴性对照组 Negative control group 40.15±1.01 4.60±2.13 161.33±86.95 9.60±5.86模型组 Model group 30.11±3.02## 3.30±0.66 84.14±42.12# 19.51±5.57##阳性对照组 Positive control group 50 40.14±2.02* 3.88±1.84 137.50±54.15* 15.89±3.96 CVE 低剂量组 CVE low-dose group 50 45.17±4.13** 3.79±0.34* 100.63±17.47 13.57±9.80 CVE 中剂量组 CVE middle-dose group 100 46.13±3.02** 3.53±0.54 103.57±57.84 13.46±6.71*CVE 高剂量组 CVE high-dose group 300 48.16±4.01** 4.24±0.99* 139.58±35.36** 13.35±1.80**
4 讨论与结论
通过观察肝组织病理切片可得模型组肝细胞出现大量溶解、脱落现象,而研究结果表明,CVE 能改善CCl4造成的肝细胞脱落、溶解,以及脂肪变性,这与孙卉等[12]开展的云芝多糖保肝效果所得结论一致。在前期开展云芝提取物对小鼠酒精肝损伤的保护作用研究中发现CVE能明显改善肝功能及病理病变,这与本研究结果一致。
血清ALT和AST活性是评估肝损伤最常用指标。在体内,肝细胞内的ALT 和AST 活力远远大于血液。在正常状态下,肝细胞内的转氨酶会通过较高的浓度差进入到血液中去[13]。而当肝细胞出现轻微的损伤时,细胞出现裂解,大量的ALT 和AST 等转氨酶就会游离出来,导致肝脏细胞外及血清中转氨酶活力急剧增大,血清转氨酶活力升高程度可反映出肝细胞的受损程度[14-16]。本研究发现CVE 对小鼠血清转氨酶ALT 和AST 活力升高具有良好的抑制作用。这与沈钦海等[17]开展的云芝保肝作用研究结论一致。且高剂量组效果最佳,强于水飞蓟素。
机体肝脏受损时,体内会产生较多自由基,当自由基含量超过人体承受范围时,就会引起“氧中毒”,TBIL、TG、TC和LDL-C等含量会发生过度积累,进而导致血脂代谢发生紊乱。研究发现,当机体内TG 含量升高时,常常伴随着HDL-C 的降低,从而降低运输胆固醇到肝脏中的能力,导致肝脏损伤[18]。TG 在肝细胞内大量积累,进而造成脂肪病变,迫使肝脏转变为储脂器官,最终导致脂肪肝形成[19-20]。本研究测得CVE 可显著降低小鼠血清内积累的TBIL、TG、TC 和LDL-C 含量,并可使HDL-C 含量升高,且高剂量组效果最佳。
已有研究证明,肝病患者具有较高的促炎细胞因子[21]。TNF-、IL-1和IL-6 等诱导枯否氏细胞分泌和外周血单核细胞分泌,是重要的炎症因子指标[22]。在本研究中,CCl4肝损伤小鼠血清中TNF-、IL-1和IL-6 水平明显增加,这表明CCl4引发促炎细胞因子释放,而预给药CVE 可以有效降低肝炎症因子浓度。这与刘颖[23]开展蒸制桔梗对酒精肝损伤的保护作用结果一致。
机体存在SOD、CAT、GSH-Px 等组成的酶反应体系,可有效清除机体产生的自由基。当自由基的产生超过自身防御系统的清除能力时,就会发生氧化损伤,最直接伤害部位为肝脏[24]。当机体发生脂质过氧化时,会产生MDA。MDA 不仅能够反应肝细胞脂质过氧化的强弱,还可间接反应自由基对肝细胞的损伤程度[25]。本研究中发现CVE 能明显升高SOD、CAT 和GSH-Px 等抗氧化酶活力,并且降低肝组织中MDA 含量,从而达到对肝脏的保护作用。这与孙设宗、Ravan等[26-28]研究结果一致。试验结果显示,高剂量组效果最佳。
综上所述,CVE 高剂量组保肝效果最佳,且强于水飞蓟素。其保肝机制可能与抑制氧化应激、改善相关酶类及细胞因子有关,这对云芝的临床应用提供了试验依据。

