AM真菌对石漠化地区桑树的促生及养分调控作用
王岩 邢丹 宋拉拉 韩世玉 陈廷速


摘 要:為确定丛枝菌根(arbuscular mycorrhizal,AM)真菌对石漠化地区植物及土壤养分化学计量特征的影响,本研究以石漠化地区经济树种桑树为研究对象,通过模拟石漠化地区季节性干旱,研究水分供应发生变化时,AM真菌对桑树幼苗和土壤中养分调控作用。为模拟石漠化地区季节性干旱,试验设置正常供水和自然干旱2个时期,每个时期均设未接种对照(-M)、接种摩西斗管囊霉(Fm)和接种根内根孢囊霉(Ri)3个处理。桑树收获后,测定植物、土壤中的C、N、P、K含量。结果表明:在正常供水、自然干旱2个时期,接菌处理对桑树幼苗的促生效果显著,干旱胁迫发生之后,Ri菌种与桑树的亲和性、促生效果均强于Fm菌种。接菌处理对桑树幼苗N、P营养改善作用尤为明显,无论水分供应条件如何,接菌处理都显著增加桑苗各部分N、P含量。对比土壤养分含量发现,接菌处理增加了土壤有效P含量,降低了土壤中C含量,正常供水条件下,接种Fm、Ri分别使得土壤C含量下降了7.00%和8.55%。对比土壤养分计量比发现,正常供水条件下,接菌处理显著提高了土壤中的碳磷比(C/P)和氮磷比(N/P);干旱胁迫条件下,接菌处理显著增加氮磷比(N/P)。综上所述,石漠地区发生季节性干旱时,AM真菌可以影响桑树对C、N、P养分吸收和分配,依据水分供应的变化和对养分资源需求的不同,调控土壤、植物体中C、N、P配比。
关键词:丛枝菌根真菌;石漠化;干旱胁迫;化学计量比中图分类号:S154.3 文献标识码:A
Effects of Arbuscular Mycorrhizal Fungi on Nutrient Exchange in Mulberry Plant in Rocky Desertification Areas
WANG Yan1, XING Dan1*, SONG Lala1, HAN Shiyu1, CHEN Tingsu2
1. Sericulture Institute, Guizhou Academy of Agricultural Sciences, Guiyang, Guizhou 550006, China; 2. Institute of Microbiology, Guangxi Academy of Agricultural Sciences, Nanning, Guangxi 530007, China
Abstract: To determine the effect of arbuscular mycorrhizal fungi (AMF) on the nutrient exchange in the plant soil system in rocky desertification areas, the effects of inoculation of arbuscular mycorrhizal fungi on the nutrient content, stoichiometry of plant and soil were studied by simulating seasonal drought in rocky desertification areas. Two periods of normal water supply and natural drought were set up for Fm and Ri treatment. Mulberry was harvested after growth for 90 d, and the content of C, N, P and K in the plant and soil was measured. AMF could effectively enhance the growth of mulberry seedlings in the two periods. After the occurrence of drought stress, the growth promoting effect of Ri and its adaptability to mulberry was better than that of Fm. Drought stress reduced the content of C, N, P and K in mulberry seedlings. The mineral nutrition in the seedling was improved by AMF, especially for N and P. The C content in the root and stem of the seedling was significantly reduced. Under normal water supply conditions, the soil C content after Fm and Ri application decreased by 7.00% and 8.55% respectively. Under drought stress, the content of available N, P and K in the soil significantly increased after Fm and Ri application, but under normal water supply, the content of available N, P and K in soil decreased. AMF also inreased C/P and N/P ratio under drought stress. In summary, AMF could affect the absorption and distribution of C, N and P nutrient of mulberry tree and the coordination of plant soil system in C, N and P according to the changes of water supply and demand of nutrient resources.
Keywords: arbuscular mycorrhizal fungi; rocky desertification; drought stress; stoichiometric number
DOI: 10.3969/j.issn.1000-2561.2020.01.002
中国石漠化面积约344万km2,主要分布在西南地区[1]。该地区分布着最为典型的碳酸岩发育的喀斯特地貌。石漠化已成为制约中国西南喀斯特地区可持续发展的重大生态环境问题,亟待解决。干旱是影响石漠化地区植物生境定植和改造成功与否的重要障碍因子[2]。同时C、N、P、K作为植物必需的基本化学元素,在植物生长和各种生理代谢中发挥重要作用[3],对石漠化地区生态系统的稳定起着决定作用。因此,增强石漠化地区植物吸收水分、养分能力,已成为石漠化生境生态修复的关键。
丛枝菌根(arbuscular mycorrhizal,AM)真菌是一种能与世界上80%以上的植物形成互利共生关系的微生物[4]。在形成丛枝菌根的植物体中,AM真菌可为植物提供高达100%的P[5],AM真菌分泌的有机酸也可降低土壤pH,提高土壤P有效性[6]。AM真菌能够直接吸收土壤中的NH4+[7]和NO3?[8]以及小分子有机氮,并迅速傳递给植物。此外,植物根系与AM真菌在土壤中形成菌根共生体后,在调控植物个体间营养平衡[9-10]、改善土壤质量[11]和提高植物抗性[12-13]等方面均具有重要的生态功能。同时,AM真菌作为养分交换的通道,能够促进生态系统地上和地下部分进行养分交流,因而在生态系统养分循环中起重要的调节作用[14-15]。
生态化学计量学主要用于探索生态过程中元素平衡及其相互关系,是当今生态学研究的热点问题[16-17]。C/N和C/P反映植物生长速度[18],并分别反映土壤有机质分解速度和磷有效性高低[19],N/P可表征养分对生产力的限制性作用[20]。因此,了解土壤和植物组织的化学计量比,对把握土壤养分供应、植物营养状况和养分限制状况等具有重要指示作用。综上,本试验模拟石漠化地区季节性干旱,研究AM真菌对桑树幼苗营养生长,土壤、植物养分含量和化学计量变化的影响,进而探索AM真菌对石漠化地区植物-土壤系统的养分调控作用,以期为石漠化地区的生态修复与可持续发展提供理论依据。
1 材料与方法
1.1材料
1.1.1 供试菌剂 选用摩西斗管囊霉(Funnelifor mismosseae,Fm)和根内根孢囊霉(Rhizophagus intraradices,Ri)2种菌种,由广西农科院微生物研究所提供。以河沙为基质,三叶草(Trifoliu mrepensL.)和玉米(Zea maysL.)为宿主进行扩繁,供试菌剂包含孢子(Fm和Ri孢子密度分别为112个/10 g和137个/10 g)、菌丝、侵染根段及河沙。
1.1.2 供试植物 桑树(Morus albaL.)品种为‘桑特优2号,种子用0.5% H2O2表面消毒20 min,无菌水冲洗若干次后播种于灭菌河沙培养,期间喷洒无菌水保持河沙湿润,待幼苗生长至4片真叶时移栽接菌。桑树无菌苗培育过程在广西农业科学院微生物研究所温室进行。
1.1.3 供试土壤 试验土壤采自广西省农科院桑园土。土壤风干后,利用高温高压法(121 ℃,0.1 MPa)灭菌120 min。土壤背景值为:pH 6.70、有机质43.63 g/kg、全氮3.69 g/kg、全磷0.33 g/kg、有效磷10.21 mg/kg、全钾3.76 g/kg、速效钾0.16 g/kg。
1.2方法
1.2.1 试验设计 将灭菌土壤装至灭菌塑料桶中(上下底直径分别为22、18 cm,高为16 cm),每桶装入灭菌土3 kg,共施加菌剂30 g,对照加等量的灭菌菌剂。具体接种操作过程为:先将灭菌土壤装至塑料桶高度的2/3处,随后选取2株长势一致的桑苗将其根系均匀蘸满拟接种的菌剂,并将此桑苗和剩余菌剂移入已灭菌塑料桶中,将桑苗固定后加入剩余的灭菌土。正常供水阶段为2017年11月25日—2018年2月11日,定期定量地为桑树种植土壤供水(200 mL/桶灭菌水);自然干旱指2018年2月11日之后停止给土壤供水,使其处于缺水状态,并保持20 d(图1)。试验分2次收获,正常供水时期收获一半植株;另一半植株自然干旱20 d后收获。每个时期设未接种-M、接种Fm和接种Ri共3个处理,每个处理4个重复,共计18桶36株桑树幼苗,每个
塑料桶完全随机摆放。桑苗培养期间,每天补充光照,控制光照时间(14 h/d),控制温度(25~ 28 ℃)。
1.2.2 测定方法与数据处理 桑树幼苗收获后,根系用去离子水洗净,剪成1 cm左右的根段,混匀后随机取约1 g测定AM真菌侵染率,AM真菌侵染率按照方格交叉法测定[21-22]。植株和土壤中元素的测定参照《土壤农业化学分析方法》[23]。运用SPSS 18.0软件对试验数据进行统计分析,运用Excel 2010软件制作图表。
2 结果与分析
2.1不同处理条件下桑树幼苗生长情况及侵染率
由表1可知,接種丛枝菌根真菌对桑树幼苗的形体指标、干重和根系侵染率都有一定程度的影响。干旱条件胁迫下,接菌显著提高桑树幼苗的各项形态指标,且接种Ri真菌促生效果优于Fm真菌。正常供水条件,接菌苗期桑树根、茎、叶干重明显高于不接菌处理,且两者的差异性达到显著水平。干旱胁迫条件下,Ri菌种对桑树的侵染率高达68.27%,显著高于Fm的64.02%,且Ri的促生效果强于Fm。由此可见,干旱胁迫条件下,Ri真菌与桑树之间的选择适应性更好,两者更容易形成互惠共生关系,进而更好地发挥共生体的优势作用。
2.2不同处理条件对桑树幼苗各组分养分含量的影响
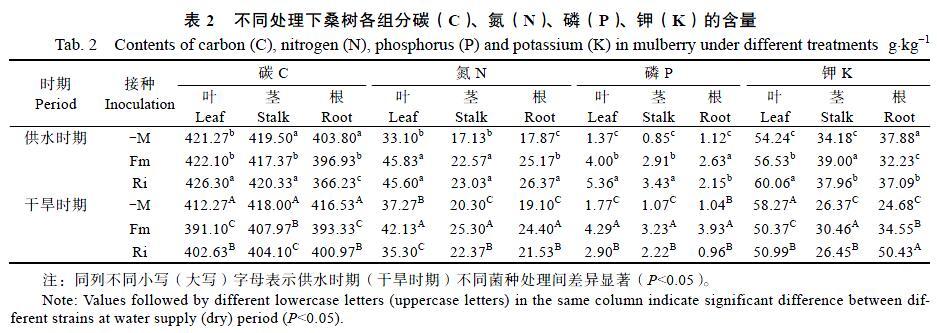
接菌处理对桑树幼苗矿质营养具有改善作用,其中对桑树N、P营养改善作用尤为明显,无论供水情况如何,接菌均能显著增加桑树各部分N、P含量(表2)。干旱条件下,Fm菌种对桑树幼苗的N、P营养改善作用强于Ri菌种,且差异显著。干旱胁迫条件下,接菌使得叶中K含量显著降低,而根、茎K含量显著升高,说明干旱胁迫条件下接菌可能会促进植物体内K元素的运输和分配。值得注意的是,接菌处理显著降低桑树幼苗C含量,在水分正常供应条件下,接种使得桑树幼苗根、茎中C含量显著降低;干旱胁迫条件下,接种Fm使得根、茎中C含量分别降低了2.63%和5.52%,且差异显著,接种Ri有同样的变化趋势。
注:同列不同小写(大写)字母表示供水时期(干旱时期)不同菌种处理间差异显著(P<0.05)。
Note: Values followed by different lowercase letters (uppercase letters) in the same column indicate significant difference between different strains at water supply (dry) period (P<0.05).
2.3不同处理条件下桑树幼苗养分化学计量比的变化
对不同处理条件下桑树C、N、P、K化学计量比进行分析发现,与未接菌处理相比,接菌使得桑树幼苗各个部分碳氮比(C/N)显著降低(图2)。干旱胁迫条件下,不同部位的C/N变化规律相同,表现为不同接菌处理间差异显著:-M>Ri>Fm。对比碳磷比(C/P)发现,干旱胁迫条件下,接种Ri导致桑树各个部位的C/P显著增加,而接种Fm则会使其比值显著降低,但无论水分供应情况如何,相对于未接菌处理,接菌使桑树各个部位的C/P显著降低。对比碳钾比(C/K)发现,干旱胁迫条件下接菌使桑树叶中的C/K显著升高,根茎中的C/K却呈现相反的变化趋势,即接菌使其显著降低。水分正常供应条件下,接菌处理使桑树幼苗的各个部分氮磷比(N/P)显著降低;干旱胁迫条件下,叶、茎中变化规律相同,值得注意的是,与未接菌相比,接种Ri使得根中N/P显著提高。
注:同列不同小写(大写)字母表示供水时期(干旱时期)不同菌种处理间差异显著(P<0.05)。
Note: Values followed by different lowercase letters (uppercase letters) in the same column indicate significant difference between different strains at water supply (dry) period (P<0.05).
2.4不同处理条件对土壤养分含量的影响
接菌对土壤总碳(C)、总氮(N)、总磷(P)含量均有显著影响。正常供水条件下,接菌显著降低土壤C含量,接种Fm、Ri分别使得土壤C含量下降了7.00%和8.55%。干旱胁迫条件下,接种Fm、Ri使得土壤中总N含量上升了14.28%和28.57%,差异显著。2种水分供应条件下,接菌均使得土壤总P含量显著降低。对于土壤有效N、P、K含量,干旱胁迫条件下,与未接菌对照相比,接菌Fm使得土壤有效N、P、K分别增加了11.57%、100.01%、13.44%;接种Ri使得土壤有效N、P、K分别增加了20.25%、83.01%、24.96%。正常供水条件下,土壤有效N、P、K含量呈相反的变化趋势,即接菌处理显著降低其含量。
注:同列不同小写(大写)字母表示供水时期(干旱时期)不同菌种处理间差异显著(P<0.05)。
Note: Values followed by different lowercase letters (uppercase letters) in the same column indicate significant difference between different strains at water supply (dry) period (P<0.05).
2.5不同处理条件下土壤养分化学计量比的变化
由图3可知,正常供水条件下,接菌处理显著提高了土壤中的C/P、N/P值,接种Fm、Ri土壤中C/P分别提高了29.08%和96.81%,N/P分别提高了45.85%和113.39%。干旱胁迫条件下,接菌处理对C/P变化影响不显著。无论土壤水分状况如何,接菌均显著降低土壤中的C/N。对于土壤中的C/K,在正常水分供应条件下,接菌处理显著提高其比值,而干旱胁迫条件下,接菌处理则显著降低其比值。
不同小写字母表示不同菌种处理间差异显著(P<0.05)。
Columns followed by different lowercase letters indicate significant difference between different strains (P<0.05).
3 讨论
3.1AM真菌对桑苗的促生效应
在本试验条件下,接菌对桑树幼苗促生效果显著,AM真菌促进桑苗营养生长已得到了广泛认可[24-25],然而几乎没有试验研究AM真菌与桑树在不同水分供应条件下亲和性的差异。本试验模拟石漠化地区季节性干旱条件,结果表明:土壤发生干旱时,Ri菌种对桑苗的侵染率高达68.27%,显著高于Fm的64.02%,且Ri的促生效果强于Fm(表1)。由此可见,干旱胁迫条件下,Ri真菌与桑树之间的选择适应性更好,可以更好地发挥共生体的优势作用。此外,AM真菌对桑树的高侵染率和良好的促生抗旱功能,揭示了AM真菌在石漠化地区的生态修复与可持续发展中的重要潜力。
3.2不同水分供应条件下,AM真菌对桑苗、土壤养分含量的影响
植物体内的N、P、K含量变化与当地的环境因素(如温度、土壤水分、微生物作用、土壤肥力)密切相关[26]。本研究表明,在干旱胁迫条件下,接种AM真菌对桑苗P营养改善作用尤为显著,接菌增加了桑树各部分P含量。这可能是因为桑苗与AM真菌共生后通过菌丝通道扩大了P的吸收范围[27];同时,AM真菌的侵染还可引起一系列土壤理化性质的改变,这些变化可促进有机P的矿化和难溶态P的解离进而提高土壤P的有效性[6]。本研究也发现,接种Fm、Ri菌种分别使得土壤有效P含量提高了147.30%和83.01%。干旱脅迫条件下,接菌也能显著增加桑苗、土壤中N量,这可能是因为AM真菌通过调节土壤团聚体,促进土壤聚合[28-29],调节土壤的通气状况,进而影响硝化和反硝化作用之间的平衡。值得注意的是,正常供水条件下,接菌处理反而导致土壤有效N量下降,推测AM真菌对N的调控可能还与丛枝菌根对植物水分状态的调节有关[30]。接菌处理还显著提高了根、茎K含量,这是因为菌丝增加了土壤K的直接吸收和向植物根系的运输[31]。水分供应条件下,接菌处理更显著地增加了植物各组织中养分含量,这说明外界环境条件(水分)是影响菌根生态效应的重要因素[6]。正常供水条件下,接菌显著降低了土壤C含量,接种Fm、Ri分别使得土壤C含量下降了7.00%和8.55%;干旱条件下,接菌处理也会降低土壤中C含量,但差异不显著。无论供水条件如何,接菌均会减低桑苗根中C含量。有研究者发现由于菌根促进表层土新鲜凋落物和土壤有机质的降解,可能影响到土壤碳库的储量[32],这同本研究的结果一致。但有研究者指出,短期内AM真菌的存在会引起土壤C库的暂时性减少,但从长期来看,多种因素的综合作用反而可能增加土壤C的储存[33]。
3.3不同水分供应条件下,AM真菌对桑苗、土壤养分计量比的影响
植物N、P含量及其化学计量比特征反映了植物对水分胁迫等不利环境的防御和适应策略[34],当环境条件发生变化时,尤其是在遭遇到逆境胁迫时,植物会通过一定机制调整,以使自身的化学计量比维持在一个相对稳定的范围内[35]。植物的氮磷比(N/P)值可以作为判断限制植物生长的营养元素指标[36],N/P小于14的植物生长主要受到N元素的限制,N/P大于16的植物生长主要受P元素的限制。本研究发现,未接菌条件下,桑树幼苗各个部分N/P均大于16,这说明喀斯特石漠化地区植物生长受到P限制。接菌处理显著降低了桑树幼苗各个部位的N/P。AM真菌降低了P对桑树生长的限制作用,使P不再是植物生长的主要限制因子,该发现对低P地区植物的生长具有重要意义。接菌处理也能显著降低桑树幼苗的碳氮比(C/N)和碳磷比(C/P),这说明AM真菌可以在很大程度上影响桑树在养分上的吸收和分配,依据其对养分资源需求的不同进行调节[37]。
[12] Fellbaum C R, Mensah J A, Cloos A J,et al. Fungal nutrient allocation in common mycorrhizal networks is regulated by the carbon source strength of individual host plants[J]. New Phytologist, 2014, 203(2): 646-656.
[13] Rillig M C, Mummey D L. Mycorrhizas and soil structure[J]. New Phytologist, 2006, 171(1): 41-53.
[14] Bi Y L, Wu F Y. Effects of mycorhiza on ecological restoration of solid wastes from coal mine and their nutritional dynamics[J]. Transactions of the Chinese Society of Agricultural Engineering, 2006, 22(5): 147-152.
[15] Augé R M. Water relations, drought and vesicular-arbuscular mycohrrizal simbiosis[J]. Mycorrhiza, 2001, 11(1): 3-42.
[16] Bissett A, Brown M V, Siciliano S D,et al. Microbial community responses to anthropogenically induced environmental change: Towards a systems approach[J]. Ecology Letters, 2013, 16(S1): 128-139.
[17] Johnson N C, Angelard C, Sanders I R,et al. Predicting community and ecosystem outcomes of mycorrhizal responses to global change[J]. Ecology Letters, 2013, 16(S1): 140-153.
[18] Tian H, Chen G, Zhang C,et al.Pattern and variation of C:N:P ratios in Chinas soils: a synthesis of observational data[J]. Biogeochemistry, 2010, 98(1-3): 139-151.
[19] Watt M S, Palmer D J. Use of regression kriging to develop a carbon: nitrogen ratio surface for New Zealand[J]. Geoderma, 2012, 183: 49-57.
[20] Elser J J, Acharya K, Kyle M,et al. Growth rate-stoichiometry couplings in diverse biota[J]. Ecology Letters, 2003, 6(10): 936-943.
[21] Phillips J M, Hayman D S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscula rmycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society, 1970, 55: 158-163.
[22] Giovannetti M, Mosse B. An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots[J]. New Phytologist, 1980, 84(3): 489-500.
[23] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中國农业科技出版社, 2000: 312-314.
[24] Shi S M, Chen K, Gao Y,et al. Arbuscular mycorrhizal fungus species dependency governs better plant physiological characteristics and leaf quality of mulberry (Morus albaL.) seedlings[J]. Frontiers in Microbiology, 2016, 7: 1030.
[25] 唐 许, 刘代军, 涂 波, 等. 菌根桑的促生效应及耐旱生理生化机制分析[J]. 西南大学学报(自然科学版), 2013, 35(8): 19-26.
[26] Bradshaw C, Kautsky U, Kumblad L. Ecological stoichiometry and multi-element transfer in a coastal ecosystem[J]. Ecosystems, 2012, 15(4): 591-603.
[27] Camenzind T, Rillig M C. Extraradical arbuscular mycorrhizal fungal hyphae in an organic tropical montane forest soil[J]. Soil Biology and Biochemistry, 2013, 64(9): 96-102.
[28] Smith S E, Read D J. Mycorrhizal symbiosis[J]. Quarterly Review of Biology, 2008, 3(3): 273-281.
[29] 钟思远, 张 静, 褚国伟, 等. 沿海侵蚀台地不同恢复阶段土壤团聚体组成及其与丛枝菌根真菌的关系[J]. 生态环境学报, 2017, 26(2): 219-226.
[30] Nuccio E E, Hodge A, Pett-Ridge J,et al. An arbuscular mycorrhizal fungus significantly modifies the soil bacterial community and nitrogen cycling during litter decomposition[J]. Environmental Microbiology, 2013, 15(6): 1870-1881.
[31] 李晓林, 冯 固. 丛枝菌根生态生理[M]. 北京: 华文出版社, 2001.
[32] Camenzind T, Rillig M C. Extraradical arbuscular mycorrhizal fungal hyphae in an organic tropical montane forest soil[J]. Soil Biology and Biochemistry, 2013, 64: 96-102.
[33] Verbruggen E, Veresoglou S D, Anderson I C,et al.Arbuscular mycorrhizal fungi-short-term liability but long-term benefits for soil carbon storage[J]. New Phytologist, 2013, 197(2): 366-368.
[34] 戚德辉, 温仲明, 王红霞, 等. 黄土丘陵区不同功能群植物碳氮磷生态化学计量特征及其对微地形的响应[J]. 生态学报, 2016, 36(20): 6420-6430.
[35] 赵维奇, 廉宁霞, 张 弛, 等. 丛枝菌根真菌(AMF)处理后红花土壤深度生态化学计量的时空变化[J]. 江苏农业科学, 2015, 43(11): 468-471.
[36] Tessier J T, Raynal D J. Use of nitrogen to phosphorus ratios in plant tissue as an indicator of nutrient limitation and nitrogen saturation[J]. Journal of Applied Ecology, 2003, 40(3): 523-534.
[37] Merrild M P, Ambus P, Rosendahl S,et al. Common arbuscular mycorrhizal networks amplify competition for phosphorus between seedlings and established plants[J]. New Phytologist, 2013, 200(1): 229-240.
[38] 張秋芳, 陈奶寿, 陈 坦, 等. 不同恢复年限侵蚀红壤生态化学计量特征[J]. 中国水土保持科学, 2016, 14(2): 59-66.
[39] Smith F A, Smith S E. What is the significance of the arbuscular mycorrhizal colonisation of many economically important crop plants[J]. Plant and Soil, 2011, 348(1-2): 63-79.
[40] Camenzind T, Rillig M C. Extraradical arbuscular mycorrhizal fungal hyphae in an organic tropical montane forest soil[J]. Soil Biology and Biochemistry, 2013, 64: 96-102.

