山银花、金银花微毒测试Microtox与安全性研究
华桦 鄢良春 吴诗惠 刘俐 罗茜 曾安琪 陈雏 赵军宁


摘要 目的:运用小鼠急性毒性试验和基于Microtox(微毒)技术的生物综合毒性评价技术对比研究金银花醇提物和山银花醇提物的毒性大小,探索Microtox技术应用于中药毒性快速评价的可行性。方法:小鼠一次性灌胃给予不同浓度的金银花醇提物、山银花醇提物,观察并记录小鼠的毒性反应及死亡情况,计算小鼠的半数致死量(LD50);利用Microtox技术测定金银花醇提物、山银花醇提物对发光菌发光强度抑制率,计算发光细菌半数抑制浓度(IC50),将2种毒性评价方法的结果进行比较。结果:小鼠灌胃金银花醇提物和山银花醇提物的半数致死量(LD50)值分别为81.29 g生药/kg、91.0 g生药/kg。采用生物综合毒性评价技术测得对发光细菌的半数抑制率分别为0.001 3 g生药/mL、0.002 2 g生药/mL。结论:应用小鼠急性毒性试验及基于Microtox技术的生物综合毒性评价测试金银花提取物和山银花提取物,2种评价结果具有一定的一致性,将Microtox技术用于金银花提取物和山银花提取物毒性的快速评价具有一定的可行性,但2种毒性评价方法的相关程度还有待扩大样本量进一步研究。
关键词 金银花;山银花;Microtox技术;急性毒性;综合毒性;安全性;发光细菌;生物评价
Abstract Objective:By using the acute toxicity test of mice and the comprehensive toxicity evaluation technology based on Microtox technology, to compare the toxicity of ethanol extracts from Honeysuckle and Lonicera Japonica, and to explore the feasibility of Microtox technology in rapid toxicity evaluation of traditional Chinese medicine. Methods:Mice were given ethanol extracts from Honeysuckle and Lonicera Japonica at different concentrations in a single gavage, and the toxicity reaction and death of the mice were observed and recorded, then calculated the median lethal dose(LD50)of the mice. The inhibition rate of ethanol extracts from Honeysuckle and Lonicera Japonica to the luminescence intensity of the luminescent bacteria was measured by Microtox technology, and calculated the half inhibitory concentration(IC50)of the luminescent bacteria. The results of the two toxicity evaluation methods were compared. Results:The median lethal dose(LD50)values of the ethanol extract from Honeysuckle and Lonicera Japonica were respectively crude drug 81.29 g/kg and crude drug 91.00 g/kg. The half-inhibition rate of luminescent bacteria measured by the bio-complex toxicity evaluation technique was crude drug 0.0013 g/mL and crude drug 0.0022 g/mL, respectively. Conclusion:The acute toxicity test in mice and the comprehensive toxicity test based on Microtox technology were used to test the extracts of Honeysuckle and Lonicera Japonica. The two kinds of evaluation results have a certain consistency. It is feasible to use Microtox technology to evaluate the toxicity of extracts from Honeysuckle and Lonicera Japonica, but the correlation between the two methods needs to be further studied with a larger sample size.
Keywords Honeysuckle; Lonicera Japonica; Microtox technology; Acute toxicity; Comprehensive toxicity; Security; Luminescent bacteria; Biological assay
中圖分类号:R282.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.02.017
金银花为忍冬科植物忍冬Lonicera japonica Thunb.的干燥花蕾或带初开的花。山银花为忍冬科植物灰毡毛忍冬Lonicera macranthoides Hand.-Mazz.、红腺忍冬Lonicera hypoglauca Miq.、华南忍冬Lonicera confusa DC.或黄褐毛忍冬Lonicera fulvoto-mentosa Hsu et S.C.Cheng的干燥花蕾或带初开的花。2015版《中华人民共和国药典》中对金银花和山银花的表述可归纳为,性味甘、寒,归肺、心、胃经;具清热解毒,疏散风热之功;用于痈肿疔疮,喉痹,丹毒,热毒血痢,风热感冒,温病发热[1]。大量研究表明,金银花和山银花的主要成分大致相同,包括以绿原酸为代表的有机酸,以木犀草苷为代表的黄酮类、三萜皂苷、环烯醚萜、挥发油等物质[3-4]。中药毒性具有现代生物技术难以检测的微小毒性、综合毒性等特点,是中药安全性评价的关键问题之一。如何准确、快速、高效地评价中药的微小毒性,是中药毒性研究的重要方向[5]。本研究将微毒测试(Microtox)这一能够检测综合毒性,且方法客观,操作简单方便,结果易于重复,对毒物反应快速、灵敏的发光细菌检测法应用于金银花、山银花的毒性评价,通过与传统中药毒性评价方法(小鼠急性毒性试验)形成对比研究,进一步探索Microtox技术应用于中药毒性快速检测的可行性,以期为其在中药毒性快速检测领域的推广应用奠定基础[6-11]。
1 材料与方法
1.1 材料
1.1.1 动物与菌种 SPF级KM种小鼠,6~8周龄,体质量18~22 g,雌雄各半,由四川省中医药科学院实验动物中心提供,合格证号:SCXK(川)2018-19。实验动物环境符合国家大鼠、小鼠、豚鼠、兔屏障系统使用设施标准,四川省实验动物管理委员会,许可证SYXK(川)2008-100。动物饲养于标准环境:温度(20±1)℃,相对湿度(60±5)%,明暗周期12 h,标准颗粒饲料喂养。费氏弧菌干粉(北京滨松光子技术股份有限公司,菌种代号:CS234),-20 ℃避光冻存。
1.1.2 药物 金银花醇提物,棕褐色浓浸膏,2.86 g生药/g浸膏,批号:20171208;山银花醇提物,棕褐色浓浸膏,2.59 g生药/g浸膏,批号:20171208。以上样品由成都普斯生物科技股份有限公司按照山东省中药材标准制备方法提取,金银花提取得率为35.0%,山银花提取得率为38.5%。金银花药材为忍冬科忍冬属植物忍冬Lonicera japonica Thunb.的干燥花蕾,产地为山东临沂;山银花药材为忍冬科忍冬属植物灰毡毛忍冬Lonicera macranthoides Hand.-Mazz.的干燥花蕾,产地为重庆秀山,由四川省中医药科学院中药资源与种植研究所鉴定。
1.1.3 试剂与仪器 1)试剂:氯化钠(分析纯,成都市科龙化工试剂厂,批号:2016031501),胰蛋白胨(生物试剂,北京奥博星生物科技有限责任公司,批号:20160103),MgSO4·7H2O(批号:2015110601)、NaH2PO4·H2O(批号:20120313)、K2HPO4·3H2O(批号:2015090101)、(NH4)2HPO4(批号:2016053101)、ZnSO4·7H2O(批号:2015110601)、甘油、琼脂粉(批号:2015051201)、酵母浸出粉(批号:201604180)以上均为成都科龙试剂有限公司提供;复苏稀释液(批号:20151020)、渗透压调节液(批号:20151020),购于北京滨松光子技术股份有限公司;绿原酸对照品(中国食品药品检定研究院,纯度≧99.3%,批号:110753-201716)。木犀草苷对照品(中国食品药品检定研究院,纯度≧94.9%批号:111720-201609)。灰毡毛忍冬皂苷乙对照品(中国食品药品检定研究院,纯度≧98.0%,批号:111889-201603);川续断皂苷乙对照品(中国食品药品鉴定研究院,纯度≧92.2%,批号:111813-201403);黄芩苷对照品(上海同田生物技术股份有限公司,纯度≧98.0%,批号:16122621)。2)仪器:生物毒性测试仪(LUMIStox300型)、预温槽和测试管(LUMIS-therm型),购于Dr.Bruno Lange GmbH公司;电子天平(上海精天电子仪器有限公司,型号:JA100SA);摇床培养箱(上海智城分析仪器制造有限公司,型号:ZWYR-2102)。Waters Acquity UPLC色谱系统(Waters,型号:2695),Agilent 1260 HPLC色谱系统(Agilent,型号:1260)。
1.2 方法
1.2.1 金银花药材质量控制
1.2.1.1 绿原酸含量测定 取本品粉末(过60目筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇50 mL,称定,超声处理30 min放冷,称重,用50%甲醇补足减失,摇匀,过滤,取续滤液2 mL于10 mL棕色瓶中,加入50%甲醇至刻度,即得。取绿原酸对照品适量;用50%甲醇溶解,即得。于4 ℃冰箱保存。绿原酸对照品浓度为56.07 μg/mL。色谱柱为ACQUITY柱(1.7 μm,2.1 mm×50 mm);流动相为乙腈-0.4%磷酸;柱溫为35 ℃;检测波长为327 nm,上机检测[1]。
1.2.1.2 木犀草苷含量测定 取本品粉末(过60目筛)约2 g,精密称定,置具塞锥形瓶中,精密加入70%乙醇50 mL,称定,超声处理60 min,放冷,称重,补足减失,摇匀,过滤,取续滤液即得。于4 ℃冰箱保存。取木犀草苷对照品适量,用70%乙醇溶解,即得(浓度为21.2 μg/mL)。色谱柱为ACQUITY柱(1.7 μm,2.1 mm×50 mm);流动相为乙腈-0.4%磷酸;柱温为35 ℃;检测波长为350 nm,上机检测[1]。
1.2.2 山银花药材质量控制
1.2.2.1 绿原酸含量测定 取本品粉末(过60目筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇50 mL,称定,超声处理30 min放冷,称重,用50%甲醇补足减失,摇匀,过滤,取续滤液2 mL于10 mL棕色瓶中,加入50%甲醇至刻度,即得。取绿原酸对照品适量;用50%甲醇溶解,即得。于4 ℃冰箱保存。绿原酸对照品浓度为56.07 μg/mL。色谱柱为ACQUITY柱(1.7 μm,2.1 mm×50 mm);流动相为乙腈-0.4%磷酸;柱温为35 ℃;检测波长为327 nm,上机检测[1]。
1.2.2.2 灰毡毛忍冬皂苷乙、川续断皂苷乙含量测定 取灰毡毛忍冬皂苷乙、川续断皂苷乙适量,用50%甲醇溶液至10 mL,即得。灰毡毛忍冬皂苷乙浓度为0.61 mg/mL,川续断皂苷乙浓度为0.24 mg/mL。色谱柱为Dikma柱(5 μm,150 mm×4.6 mm);流动相为乙腈-0.4%磷酸柱温为30 ℃;检测器为ELSD,上机检测[1]。
1.2.3 小鼠急性毒性试验 采用小鼠急性毒性试验方法[12]。根据预实验灌胃测出LD100和LD0,确定给药组的组间计量比为1∶0.8,即金银花醇提物的剂量为158.0、126.4、101.1、80.9、64.7、51.8 g(原生药)/kg,山银花醇提物的剂量为144.0、115.2、92.2、73.7、59.0、47.2 g原生药/kg。KM种小鼠130只,雌雄各半,體质量18~22 g,按体质量、性别随机分为13个组(金银花醇提物6个剂量组,山银花醇提物6个剂量组,空白对照组),每组10只,实验前禁食不禁水14 h,给药组以0.4 mL/10 g给药,灌胃后即可进食。给药后密切观察小鼠的皮肤、异常肌肉运动、自发活动、运动功能、对外界反应、瞳孔、分泌物、大便、眼等毒性反应及死亡情况;若有小鼠死亡立即解剖肉眼观察小鼠的心、肝、脾、肺、肾、脑小肠等脏器的改变。给药后第2天起,按上述毒性反应观察指标每天观察1次,称取小鼠体质量,连续14 d,观察期结束后处死解剖,按照上述方法肉眼观察小鼠的脏器是否发生病理变化。
1.2.4 Microtox技术的毒性评价 根据预实验得到金银花醇提物和山银花醇提物抑制率在1%~100%的浓度,配制成6.25%、12.5%、25%、40%、50%、60%、75%、85%、100%共9个浓度(即金银花0.000 617 2、0.001 234、0.002 469、0.003 95、0.004 938、0.005 925、0.007 406、0.008 394、0.009 875 g原生药/mL;山银花0.001 012 5、0.002 025、0.004 05、0.006 48、0.008 1、0.009 72、0.012 15、0.013 77、0.016 2 g原生药/mL)进行检测,测出pH值,使药液pH值在5~9的范围内,若不在此范围内用NaOH溶液或HCl溶液调节pH值,以加入的HCl溶液或NaOH溶液在样品中的体积不超过总体积的5%为标准,再将各浓度样品与渗透压调节液以17∶3的比例混合,配制成待测样品溶液,放置在15 ℃,75%的湿度恒温恒湿箱1 h后待测。
将细菌从-20 ℃冰箱中取出,室温融化,吸取100 μL菌液于装有约10 mL培养液的50 mL离心管中,放置在23.5 ℃的恒温培养振荡器中培养16 h左右,直至在黑暗中肉眼可观察到蓝绿色荧光,吸取1 000 μL的菌液于1.5 mL离心管中,低速离心弃去上清液,加入适量复苏稀释液重悬,于恒温恒湿箱中平衡15 min,取出放于15 ℃预温槽10 min,得到测试用发光强度菌液,初始值在2 000~4 000范围内,即可用于测试。
以复苏稀释液为空白对照,空白对照和每个样品浓度均设置3个平行管,每批次样品重复测定3次。取测试用菌100 μL于测试管中用生物毒性测定仪测定其发光强度后立即加入1 000 μL复苏稀释液或者待测样品于测试管中,反应10 min后测定其发光强度,计算各个浓度的抑制率,并绘制相应的剂量-效应动力曲线。
根据发光细菌发光强度检测值,计算抑制率:
抑制率(%)=空白组发光菌的平均发光强度值-样品组发光菌的平均发光强度值空白组发光菌的平均发光强度值×100%
1.2.5 2种毒性评价结果相关性分析 计算金银花提取物和山银花提取物基于发光细菌检测法相应的IC50值及基于小鼠急性毒性试验的LD50值,2种毒性评价结果的相关程度以相关系数r进行描述。一般地,|r|>0.95显著相关;|r|≥0.8高度相关;0.5≤|r|<0.8中度相关;0.3≤|r|<0.5低度相关;|r|<0.3关系极弱,认为不相关。
1.3 统计学方法 采用SPSS 20.0统计软件对数据进行统计和分析,计算出小鼠急性毒性实验的LD50值,计算各个浓度的抑制率并绘制相应的剂量—效应动力曲线,求出IC50值。
2 结果
2.1 金银花药材质量控制 实验结果显示,金银花中绿原酸含量为28.01 mg/g,木犀草苷含量为0.87 mg/g,符合药典要求。具体结果如下。见图1~3,表1。
2.2 山银花药材质量控制 实验结果显示,山银花样品中绿原酸含量为54.23 mg/g,灰毡毛忍冬皂苷乙含量为75.57 mg/g,川续断皂苷乙5.33 mg/g,符合药典标准。见图4~6,表2。
2.3 小鼠急性毒性试验 金银花醇提物和山银花醇提物各剂量组的毒性反应较为相似,给药后毒性症状主要表现为静止俯卧、呼吸抑制、竖毛、稀便、眼睑下垂或闭目等。随剂量的降低,动物出现上述反应的频次逐渐减少且程度减轻。对死亡动物立即解剖,可见小鼠胃肠均有大量尚未吸收的药液,肉眼观察各脏器未见明显异常。存活动物给药后第2天基本恢复正常。见表3~4。
采用SPSS 20.0统计软件进行半数致死量数据分析统计,计算LD50(Bliss法),得出相应的LD5、LD50、LD95及其可信区间。由表5可见,金银花醇提物LD50为81.29 g/kg,95%可信区间为72.96~90.21 g/kg;山銀花醇提物LD50为91.00 g/kg,95%可信区间为64.79~151.5 g/kg。
2.4 微毒测试(Microtox)根据金银花醇提物和山银花醇提物的各浓度对费氏弧菌发光强度的影响,求出相应的发光抑制率(%)。见表6。并绘制相应的毒性剂量—效应动力曲线。见图7,8。
金银花醇提物和山银花醇提物基于抑制发光细菌的发光强度所测得的IC50值分别为生药0.001 3 g/mL,0.002 2 g/mL。见表7。
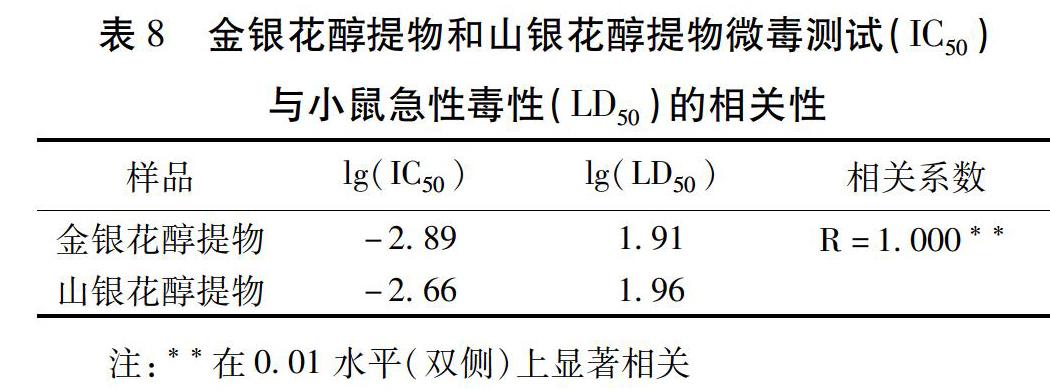
2.5 毒性评价结果相关性分析 将微毒测试法所求得的IC50值进行对数转换,与lg(LD50)进行相关性分析。结果表明,微毒测试法与小鼠急性毒性试验评价结果呈正相关,相关系数r=1.000,在0.01水平(双侧)上显著相关,2种毒性评价方法结果一致。见表8。
3 讨论
现代药理研究表明金银花和山银花提物都具有抗病毒、抗菌、抗炎的作用,金银花和山银花药材外观的相似度极高、化学成分也有很大的相似度,但金银花和山银花在同一中药材市场上的价格金银花比山银花的价格高很多,有许多学者做了关于金银花和山银花药理方面的研究,观察山银花是否能替代金银花,但对于金银花和山银花毒性研究方面的报道较少。有文献报道,山东、河北、河南的金银花和湖北、重庆、广西的山银花比较,山银花毒性高于金银花[13-14];但也有文献报道灰毡毛忍冬(山银花)的毒性比密银花和济银花的毒性低[15]。本试验条件下,应用2种毒性测试方法结果提示,在本试验条件下,金银花醇提物毒性大于山银花醇提物毒性;后续将扩大样品量进一步开展研究。
目前,发光细菌检测法已在水质毒性、食品安全性等领域得到广泛应用;本实验室在国内率先将发光细菌检测技术应用于中药毒性评价领域[16-21]。发光细菌检测技术具有快速、简单、灵敏度高、模拟性强、重现性好等优点。基于发光细菌检测进行中药综合毒性评价可为更加科学、合理、全面的中药安全性评价提供参考。
参考文献
[1]国家药典委员会编.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:31,221.
[2]薛红卫,周超凡.金银花和山银花的合理利用[J].中国新药杂志,2011,20(22):2211.
[3]王立川.金银花的化学成分及功效研究进展[J].安徽农业科学,2009,37(5):2036-2037.
[4]温建辉,倪付勇,赵祎武,等.山银花化学成分研究[J].中草药,2015,46(13):1883-1886.
[5]鄢良春,华桦,罗茜,赵军宁.基于微小毒性检测的中药注射剂质量波动及安全风险预警研究进展[J/OL].药学学报,1-11.[2019-12-31].http://kns.cnki.net/kcms/detail/11.2163.R.20191114.1050.003.html.
[6]赵军宁,鄢良春.基于Microtox技术(微毒测试)的中药综合毒性快速评价[J].世界中医药,2014,9(2):137-140,144.
[7]郑晓秋,鄢良春,赵军宁,等.应用Microtox技术检测鱼腥草注射液综合毒性的研究[J].中药药理与临床,2013,29(6):92-95.
[8]李欢,鄢良春,李浩然,等.基于Microtox技术的银杏内酯注射液质量控制初步研究[J].中药药理与临床,2017,33(4):45-49.
[9]赵炳祥,罗荔敏,鄢良春,等.Microtox技术应用于参麦注射液综合毒性检测[J].世界科学技术-中医药现代化,2016,18(11):1942-1947.
[10]李孝容,华桦,鄢良春,等.苍耳子微毒测试(Microtox)与小鼠急性毒性的相关性研究[J].中药药理与临床,2016,32(2):134-138.
[11]夏见英,华桦,鄢良春,等.基于Microtox技术快速检测苍耳子药材及其饮片、成方制剂毒性变化规律[J].中药药理与临床,2016,32(2):151-154.
[12]石钺,石任兵,陆蕴如.我国药用金银花资源、化学成分及药理研究进展[J].中国药学杂志,1999,34(11):6-9.
[13]刘婧慧.金银花与山银花质量评价及安全性对比研究[D].北京:北京中医药大学,2014.
[14]张晓钿,田树红,杨照新.金银花与山银花质量评价及安全性对比研究[J].生物技术世界,2015,9(10):149.
[15]雷志钧,周日宝,童巧珍,等.灰毡毛忍冬与正品金银花安全性比较[J].中成药,2006,28(5):759-761.
[16]赵军宁,鄢良春,郑晓秋,等.一种快速检测鱼腥草注射液综合毒性的生物测试方法[P].中国:ZL201310369652.8,2016-02-17.
[17]赵军宁,鄢良春,朱雅宁,等.一种快速检测红花注射液综合毒性的生物测试方法[P].中国:ZL201410113782.X,2016-08-17.
[18]赵军宁,鄢良春,郑晓秋.一种快速检测中药注射剂综合毒性的生物测试方法[P].中国:ZL201310210195.8,2016-12-28.
[19]赵军宁,鄢良春.一种快速检测中药综合毒性的生物测试方法[P].中国:ZL201410115374.8,2017-04-12.
[20]赵军宁,熊静悦,鄢良春,等.一种药物微毒测试体系(Micrtox assay)的质量控制方法[P].中国:201610271016.5,2016-04-27.
[21]赵军宁,鄢良春,孙毅.一种银杏内酯注射液质量控制方法[P].中国:201810415895.3,2017-05-05.
(2020-01-09收稿 责任编辑:王明)

