顶空-固相微萃取法与水蒸气蒸馏法提取山银花挥发性组分的比较
张鹏云,管 维,李 蓉,*,龙春霞,卢俊文,林淑绵,张 峰
(1.中山海关技术中心,广东 中山 528400;2.洛阳市疾病预防控制中心,河南 洛阳 471000;3.广东药科大学公共卫生学院,广东 中山 528458;4.中国检验检疫科学研究院食品安全研究所,北京 100176)
山银花(Flos Lonicerae)为忍冬科植物灰毡毛忍冬、红腺忍冬、华南忍冬或黄揭毛忍冬的干燥花蕾或带初开的花[1],主要分布我国的华南地区,如四川、广东、湖南、贵州、浙江等[2]。2014年国家卫生健康委员会将山银花列入药食同源产品目录中[3]。山银花含有黄酮类、有机酸类、皂苷类和挥发油等多种功效成分[4],在抗炎退热、抗肿瘤、抗过敏与抗动脉粥样硬化等方面有很强的生理活性[5]。其挥发油中的柠檬烯具有抑菌、抗肿瘤、抗氧化、抗炎、祛痰平喘、利胆溶石等作用[6];α-姜黄烯有助于内分泌调节,且具有抗病毒、抗肿瘤、抑癌、抑菌等生理活性[7];α-松油醇对多种常见病原菌有较强的抑制作用,还具有抗痉挛、抗炎等生理活性[8];芳樟醇具有镇痛、抗焦虑、抗炎、抗肿瘤、抗菌、抗氧化等药理活性,在临床中应用广泛[9]。因此,研究山银花挥发油成分,对其开发利用、质量控制具有重要作用。
目前,对山银花挥发油的提取多采用水蒸气蒸馏(steam distillation,SD)法和超临界CO2流体萃取等方法[10-12],而顶空-固相微萃取(head space-solid phase microextraction,HS-SPME)技术是近些年发展起来的前处理方法,它集采样、萃取、浓缩、进样于一体,提取温度低、样品用量少、易实现自动化、操作简便[13-14],还未发现其用在山银花挥发油的提取中。另外,天然植物挥发油的化学成分存在许多同系物或同分异构体,仅凭谱库检索容易出现定性错误[15],保留指数作为色谱的定性参数,能够反映组分与色谱柱固定相间的相互作用,具有标准统一、准确度高和重复性好的优点,可用于鉴定复杂样品的组分[16-17]。
本研究以山银花为研究对象,通过正交试验优化HS-SPME法提取山银花挥发性成分的条件,并比较HSSPME法和SD法提取物的组成,以期得出两种手段的共同点和差异性,为山银花的鉴别与品质评价提供技术保障,为山银花的进一步研究开发提供数据支持。
1 材料与方法
1.1 材料与试剂
山银花干花(产地:湖南;批号:160501;水分质量分数9.7%) 湖南省南国药都中药饮片有限公司;氯化钠、无水硫酸钠、正己烷(均为分析纯) 广州化学试剂厂;正构烷烃混合标准品(C7~C40) 美国o2si公司。
1.2 仪器与设备
TSQ 8000气相色谱-三重四极杆串联质谱仪(配电子电离源及Xcalibur数据处理系统、SPME自动进样手柄) 美国Thermo Fisher公司;7890B-7200气相色谱-四极杆-飞行时间质谱(gas chromatography-quadrupole timeof-flight mass spectrometry,GC-QTOF MS)仪(配有电子电离源、MassHunter B.07 SP2工作站) 美国安捷伦公司;50/30 μm DVB/CAR/PDMS SPME萃取头 美国Supelco公司。
1.3 样品前处理方法
1.3.1 HS-SPME法
准确称取1.0 g山银花置于20 mL顶空瓶中,自动进样器将顶空瓶放在60 ℃的孵化炉中平衡25 min后,将老化过的50/30 μm DVB/CAR/PDMS SPME萃取头插入样品瓶顶空部分进行60 min热吸附,然后将吸附后的萃取头插入气相色谱进样口,在250 ℃解吸5 min,最后进入气相色谱-串联质谱(gas chromatography-mass spectrometry,GC-MS)系统进行分离检测。
1.3.2 SD法
将山银花剪成约1 cm的小段,准确称取120.0 g放入2 000 mL的圆底烧瓶中,加入1 200 mL饱和氯化钠溶液,浸泡过夜,参照挥发油测定法甲法提取6 h,静置30 min,加入2 mL正己烷萃取[1],在萃取液中添加适量无水硫酸钠除水干燥,最后经0.45 µm有机滤膜过滤后作为供试样品进入GC-QTOF MS系统检测。
1.3.3 仪器条件
1.3.3.1 GC-MS分析条件
色谱条件:TR-PESTICIDE弹性石英毛细柱(30 mh0.25 mm,0.25 μm);升温程序:初始温度40 ℃,保持2 min,然后以5 ℃/min的速率升温至200 ℃,保持2 min,再以10 ℃/min的速率升温至250 ℃并保持2 min;分流比10∶1,色谱柱流速1.2 mL/min;进样口温度为250 ℃;载气:99.999%高纯度氦气。
质谱条件:电子电离源;离子源温度280 ℃;传输线温度280 ℃;电子轰击能量70 eV;扫描方式全扫描;质量扫描范围m/z 40~450 。
1.3.3.2 GC-QTOF MS分析条件
色谱条件:色谱柱为HP-5SILMS毛细管柱(30 mh 0.25 mm,0.25 μm);载气为高纯氦气,流速为1.2 mL/min(恒流模式),分流比为10∶1;进样口温度为250 ℃;程序升温条件:初始温度40 ℃,保持2 min,然后以5 ℃/min的速率升温至250 ℃并保持5 min;进样量1 µL。
质谱条件:电子电离源;离子源温度230 ℃;电子能量70 eV;四极杆温度150 ℃;全扫描范围m/z 35~450;溶剂延迟4.0 min。
1.3.4 保留指数的计算
C7~C40正构烷烃混标在与山银花样品相同的气相条件下得到总离子流图后,工作站根据保留指数计算公式自动得出各挥发性组分的保留指数。
1.3.5 定性分析
对1.3.3.1节方法得到的总离子流图通过自动质谱退卷积定性系统(automated mass spectral deconvolut ion and identification system,AMDIS)进行处理,所分辨的质谱在NIST 2.2标准谱库中检索,根据匹配度和保留指数进行核对,只记录正匹配和反匹配均大于800的化合物,并用峰面积归一化法计算山银花各挥发性物质的相对含量。
对1.3.3.2节方法得到的总离子流图根据谱库检索结果,结合准确质量测定和保留指数对色谱峰进行定性分析,并运用峰面积归一化法计算山银花挥发油各组分的相对含量。
2 结果与分析
2.1 HS-SPME条件的选择
HS-SPME法的萃取效果受萃取时间、萃取温度、平衡时间、解吸时间等因素的影响[18],因此本研究用峰面积代表萃取物质的量,出峰数代表萃取物质的种类,选择总峰面积和总峰数两个指标考察各因素的萃取效果,确定HS-SPME山银花挥发性成分的较优条件。
2.1.1 单因素试验结果
2.1.1.1 萃取温度的选择
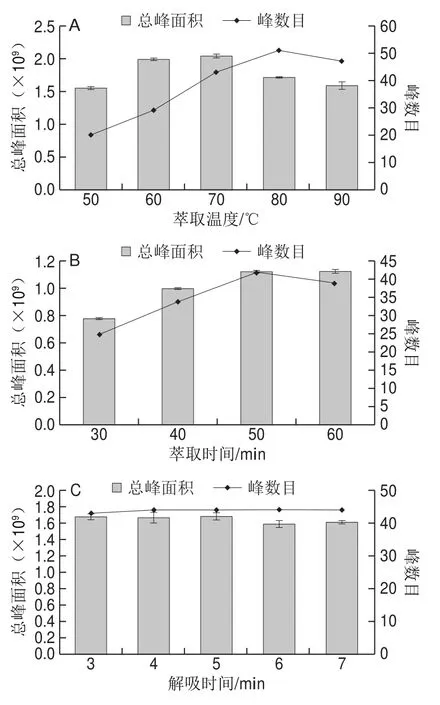

图1 不同因素对山银花挥发性成分萃取效果的影响Fig. 1 Effect of various factors on the extraction of volatile compounds from Flos Lonicerae
称取山银花样品1.0 g,在萃取时间30 min、平衡时间10 min、解吸时间3 min的条件下,研究不同萃取温度(50、60、70、80、90 ℃)的萃取效果,每个水平重复3 次,结果如图1A所示。随着萃取温度的升高,山银花挥发性成分的总峰面积先增大后减小,在70 ℃时达到最大值,而峰数目也呈先增加后减小的趋势,在80 ℃时达到最大。进一步分析时发现当萃取温度超过70 ℃时,先出峰的一些组分响应变低,峰面积减小,而这些组分是山银花挥发性物质的主要成分。这可能是因为温度升高后加快了分子运动速率,使目标物更易被富集吸附,才出现峰数目和峰面积都增大的现象[19],但温度过高时,低沸点组分在竞争吸附中处于劣势地位,造成部分流失[20-21]。为了能更真实地反映山银花的香气组成,本研究选择70 ℃为较优萃取温度。
2.1.1.2 萃取时间的选择
在2.1.1.1节结果的基础上,研究萃取时间(30、40、50、60 min)对山银花挥发性成分的影响,每个水平重复3 次,结果如图1B所示。随着萃取时间的延长,挥发性成分的总峰面积不断增大,当萃取时间超过50 min时变化不明显;而峰数目随着萃取时间的延长呈先上升后降低趋势,并在50 min时达到最大值。这是因为萃取时间可以影响顶空和萃取头纤维涂层之间分析物的平衡[22]。当萃取时间不足时,目标物被吸附不充分;萃取时间过长时,已经被吸附的组分可能出现脱附现象,造成峰数减少[23-24]。综合考虑,本研究将萃取时间设为50 min。
2.1.1.3 解吸时间的选择
在2.1.1.1节和2.1.1.2节结果的基础上,研究不同解吸时间(3、4、5、6、7 min)的萃取效果,每个水平重复3 次,结果如图1C所示。当解吸时间延长时,挥发性物质的峰数目基本不变,而总峰面积在3~5 min时变化不明显,超过5 min时略有减小,说明5 min时已解吸完全。若解吸时间不足,不但影响检测结果,还会污染后续样品,但解吸时间过长会缩短萃取头的使用寿命[25-26]。因此,本研究选择5 min为较佳的解吸时间。
2.1.1.4 平衡时间的选择
在以上结果的基础上,研究不同平衡时间(10、15、20、25、30 min)的萃取效果,每个水平重复3 次,结果如图1D所示。随着平衡时间的延长,挥发性成分的总峰面积和峰数目均呈上升趋势,当平衡时间超过25 min时,变化平缓。这说明25 min时挥发性物质在气相中已达到平衡状态,因此本研究选择平衡时间为25 min。
2.1.2 正交试验结果
在单因素试验基础上,选择萃取温度、萃取时间和平衡时间作为3 个影响因素,采用L9(33)正交表进行3因素3水平正交试验,优化试验参数,试验设计及结果如表1所示。
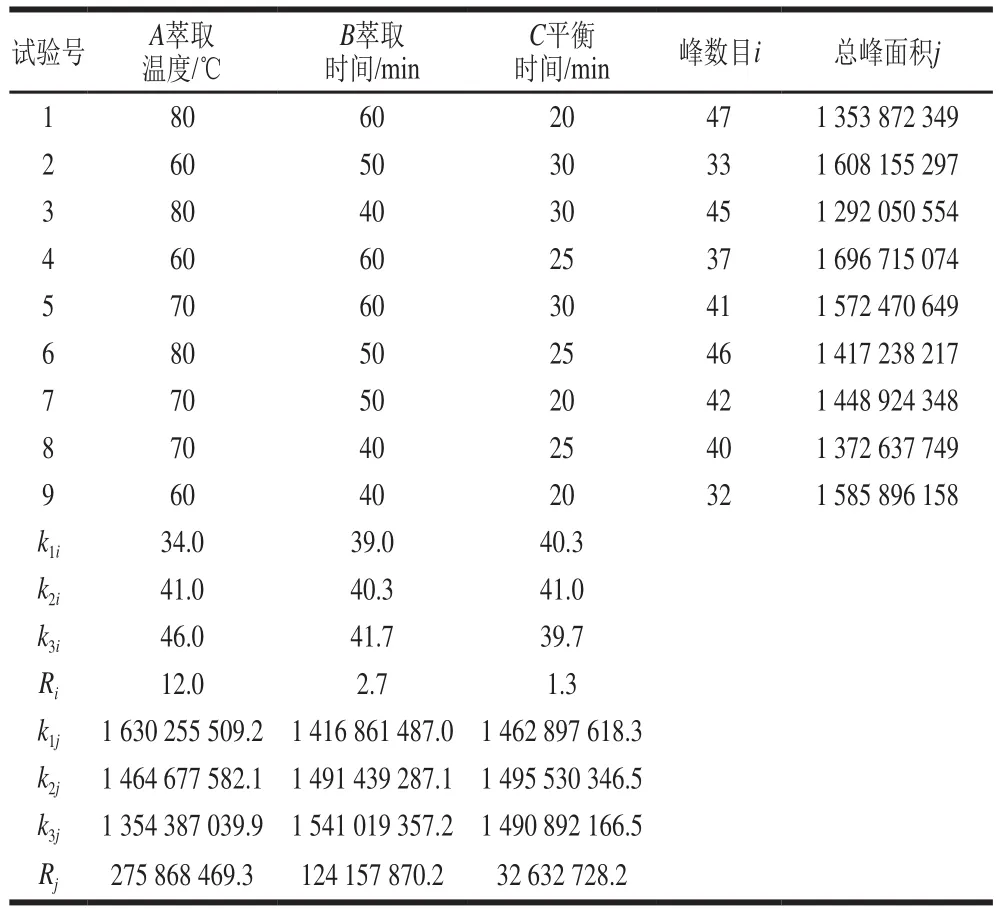
表1 正交试验设计及结果Table 1 Results and analysis of orthogonal array experiments
由表1可知,当以峰数目为萃取效果考察指标时,较优组合为A3B3C2,从极差可知,3 个因素对萃取效果的影响程度为A>B>C,即萃取温度影响最大,萃取时间和平衡时间次之;当以总峰面积为考察指标时,较优组合为A1B3C2,从极差可知,3 个因素对萃取效果的影响大小同样为A>B>C。由此可以看出,萃取温度对峰数目和峰面积影响均较大,但是2 个考察指标得到的萃取温度不一致,这可能是因为温度较高时,高沸点化合物析出被萃取,峰数目增多,但是竞争吸附使低沸点组分被吸附量减少,响应降低,总峰面积减小。而从离子流图中看出,山银花挥发性成分主要是低沸点化合物,综合考虑最终确定HS-SPME法萃取山银花挥发性成分的较优组合为A1B3C2,即:萃取温度60 ℃、萃取时间60 min、平衡时间25 min。
2.2 HS-SPME-GC-MS法的结果与分析
按照2.1节得到的HS-SPME条件对山银花挥发性成分进行萃取并通过GC-MS进行检测,得到山银花挥发性物质的总离子流图(图2),再利用AMDIS和保留指数进行定性分析。结果显示,共检测到73 个峰,鉴定出59 种组分(表2),占挥发性物质总量的97.17%,分别为17 种萜烯类化合物(61.63%)、13 种醇类化合物(12.98%)、9 种醛类化合物(8.23%)、5 种酮类化合物(2.65%)、7 种酯类化合物(2.60%)和8 种其他种类化合物(9.08%)。其中,柠檬烯的含量最高,占挥发性物质总量的51.52%,其次为4-异丙基甲苯(7.46%)、正己醛(4.52%)、β-蒎烯(3.80%)、正辛醇(2.96%)、正己醇(2.37%)、苯乙醇(1.69%)、壬醛(1.67%)、樟脑(1.25%)、β-月桂烯(1.24%)等。
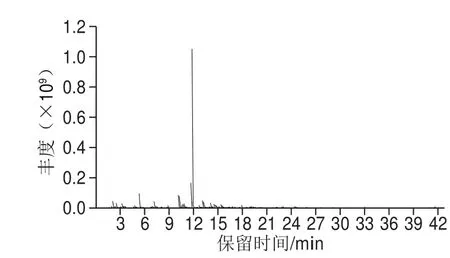
图2 HS-SPME提取物的总离子流图Fig. 2 Total ion current chromatogram of HS-SPME extract
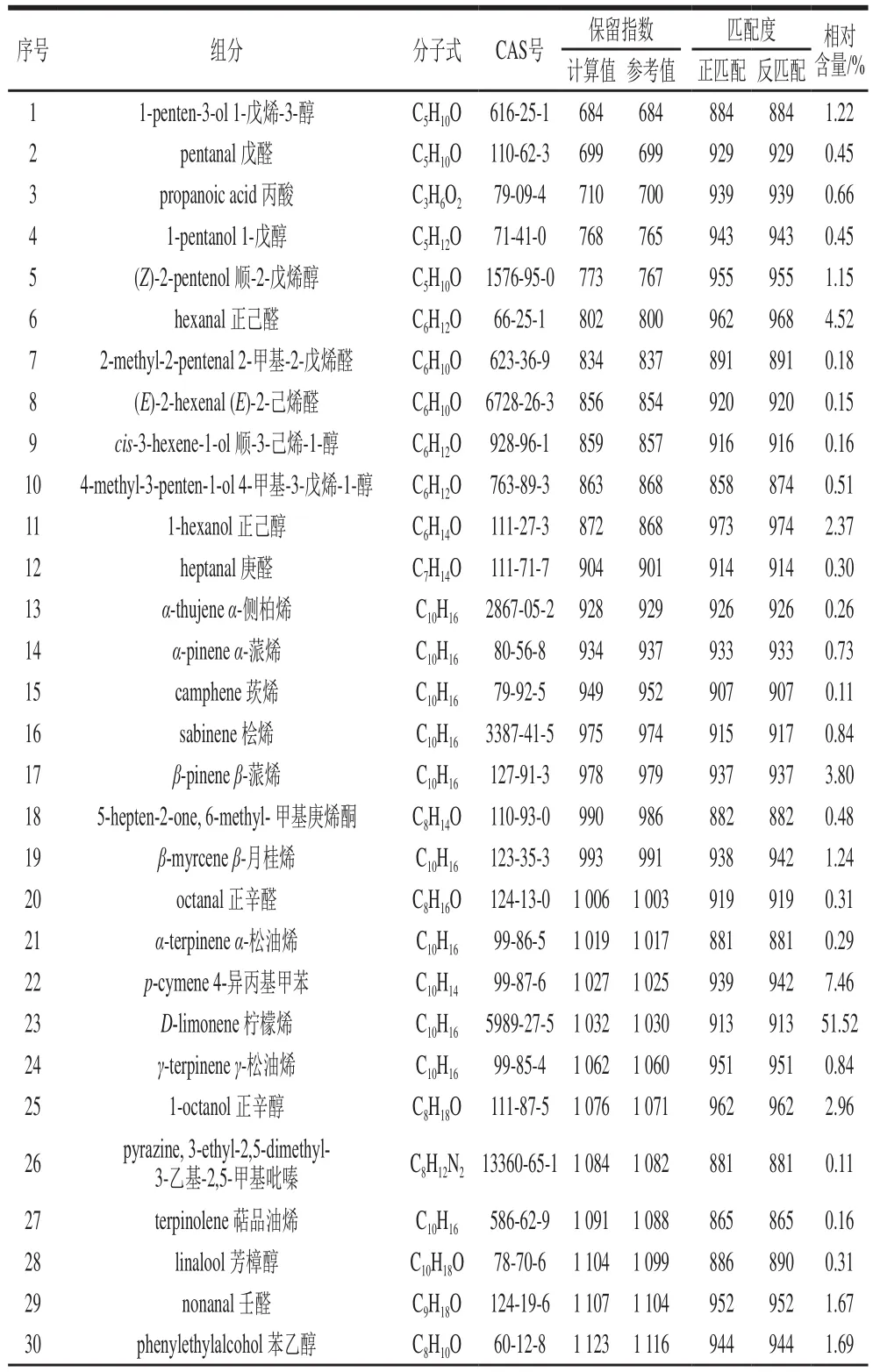
表2 HS-SPME提取物的GC-MS分析Table 2 Results of GC-MS analysis of HS-SPME extract

续表2
2.3 SD-GC-QTOF MS法分析
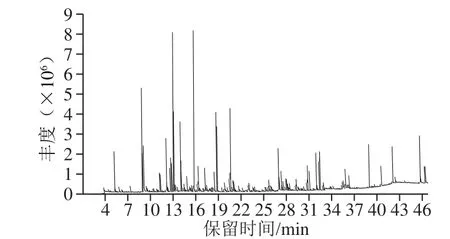
图3 SD提取物的总离子流图Fig. 3 Total ion current chromatogram of SD extract
利用GC-QTOF MS检测SD法提取的山银花挥发油,得到山银花挥发油总离子流图(图3),并对各色谱峰进行定性分析。结果显示,共检测到102 个峰,鉴定出其中68 种组分(表3),占挥发性物质总峰面积的91.69%,分别为20 种醇类化合物(36.44%)、7 种醛类化合物(14.20%)、10 种酮类化合物(10.35%)、6 种酚类化合物(9.54%)、10 种酯类化合物(7.85%)、3 种酸类化合物(1.70%)和12 种其他种类化合物(11.62%)。其中含量最高的组分为α-松油醇(9.45%),其次是芳樟醇(8.23%)、苯甲醛(7.00%)、4-乙烯基-2-甲氧基苯酚(5.54%)、大马士酮(4.61%)、苯乙腈(4.54%)、脱氢芳樟醇(4.20%)、3-乙烯基吡啶(3.75%)、3-糠醛(2.95%)、顺-芳樟醇氧化物(2.83%)等。
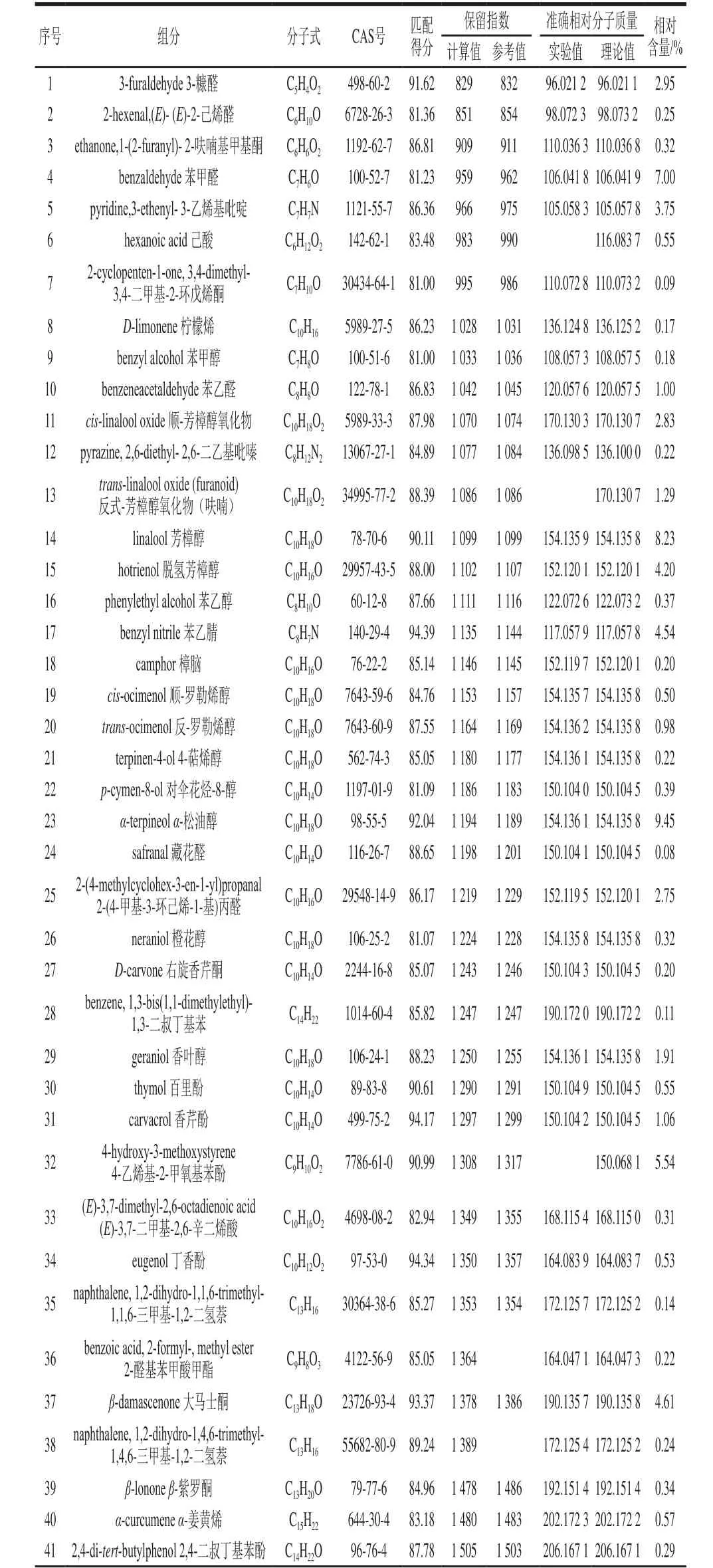
表3 SD提取物的GC-QTOF MS分析结果Table 3 Results of GC-QTOF MS analysis of SD extract
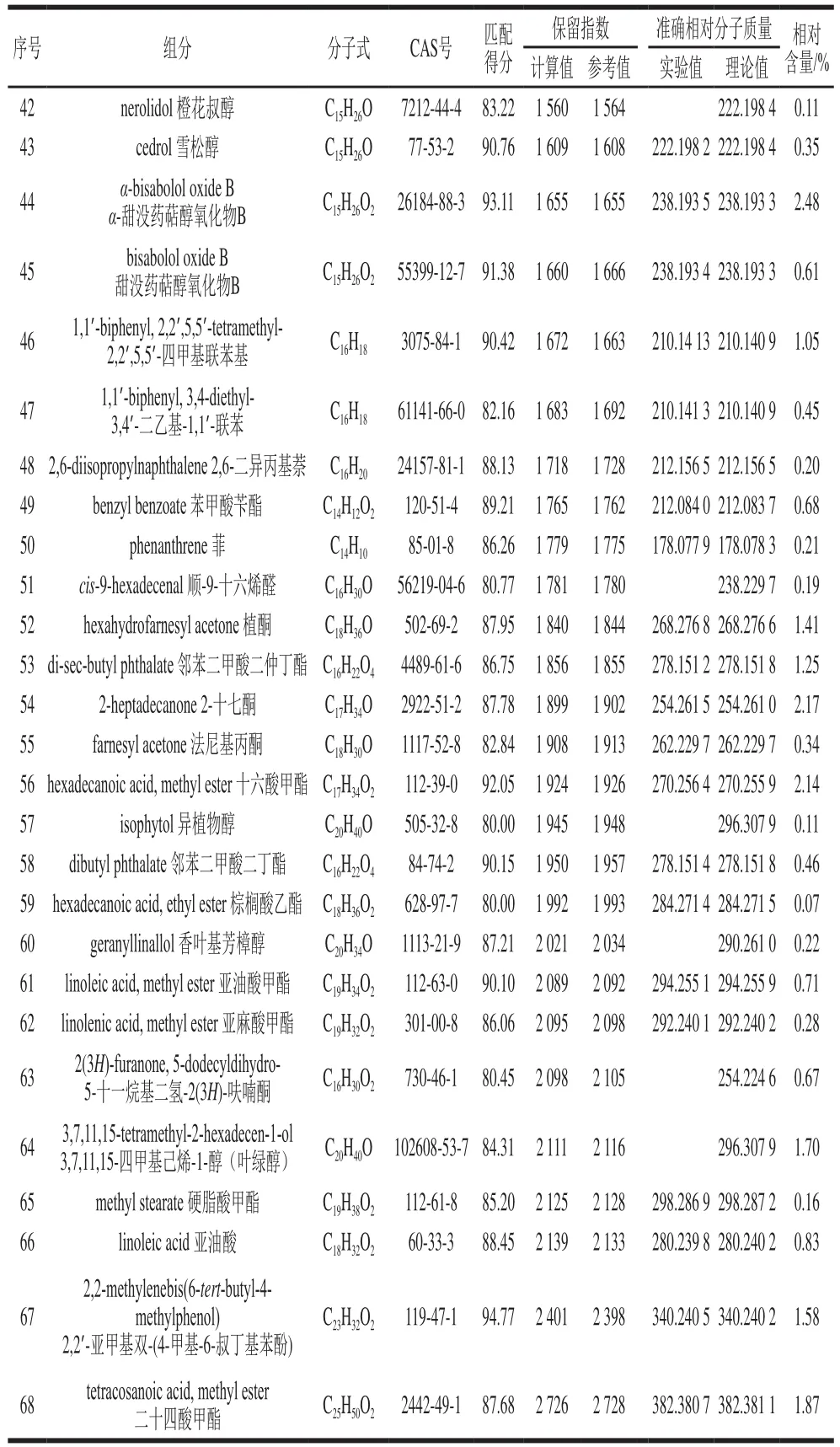
续表3
2.4 HS-SPME法与SD法提取物挥发性组分比较
经比较发现,HS-SPME法和SD法提取物的组分种类及含量差异较大。两种方法共鉴定出116 种化合物,其中有11 种为共有组分,即:(E)-2-己烯醛、D-柠檬烯、芳樟醇、苯乙醇、樟脑、右旋香芹酮、百里酚、α-姜黄烯、雪松醇、2,2’,5,5’-四甲基联苯基和邻苯二甲酸二丁酯,共有组分占各自总量的56.48%(HS-SPME法)和12.38%(SD法)。HS-SPME法提取物的主要成分为萜烯类化合物,含量最高的D-柠檬烯占总量的51.52%,其次为醇类化合物,而SD法中仅鉴定出两种萜烯类化合物,分别为D-柠檬烯和α-姜黄烯且均在HS-SPME法中检出;SD法提取物的主要成分为醇类化合物,其次为醛类化合物,含量最高的α-松油醇未在HS-SPME法中检测到。
这可能是因为HS-SPME法提取温度低,加热时间短,对一些低分子质量、高挥发性物质有较强的富集作用,组分不易被破坏[27-28]。而传统的SD法样品用量大,浸泡和提取时间长,加热温度高,所以提取的挥发油组分沸点较高,但这可能会使部分沸点低、挥发性强的组分流失,一些组分甚至发生分解或变性,易破坏山银花原有的香气成分[29-30]。由此可知,HS-SPME法对一些低沸点的萜烯类和小极性化合物有较好的选择性;SD法更适合分析高沸点的酯类及大极性的醇类等化合物。
3 结 论
本研究通过单因素试验和正交试验优化了HS-SPME法萃取山银花挥发性成分的条件,即:50/30 μm DVB/CAR/PDMS SPME萃取头、1.0 g样品、萃取温度60 ℃、萃取时间60 min、平衡时间25 min以及解吸时间5 min。在该优化条件下,鉴定出59 种组分,占挥发性物质总量的97.17%,含量最高的组分为柠檬烯。
比较HS-SPME法和SD法提取物的共性和差异。结果显示,二者的组分种类及含量差异较大,共鉴定出116 种化合物,有11 种共同组分。其中,HS-SPME法提取物中低沸点、易挥发的萜烯类化合物较多,SD法提取物中酯类及大极性的醇类化合物较多。因此,结合2 种方法共同分析山银花的挥发性成分能够得到更加全面的信息。本研究为山银花药材及相关产品的质量评价和控制提供了参考价值。

