用作锂离子电池负极的FeS2微球的制备及性能
荣 华,王春刚,周 明
(1. 吉林建筑大学材料科学与工程学院,长春 130118;2. 东北师范大学化学学院,长春 130024)
锂电池凭借其诸多优点成为新一代绿色二次电池,负极材料作为锂电池的重要组成部分之一,优良的容量和倍率性能是衡量负极材料的重要指标. 过渡金属氧化物的高容量优点使其成为研究较多的负极材料,但目前过渡金属氧化物的研究已经到了瓶颈期; 与过渡金属氧化物材料相比,过渡金属硫化物具有更强的导电能力,成为继过渡金属氧化物之后极具潜力的材料[1~7]. 目前,有关硫化物材料的制备报道较多,与其它结构相比,简单易得的硫化物纳米片材料更具有优势[8,9]. 因此,制备不同尺寸、形貌的纳米片材料成为一项有意义的工作.
黄铁矿(FeS2)因其在地壳中含量丰富、低毒性,一直是电化学能量储存装置的廉价原料[10,11]. 近年来,FeS2由于具有894 mA·h·g-1的理论容量和1313 W·h·kg-1的高理论能量密度引起了广泛关注[12,13]. 但FeS2也存在由于剧烈体积膨胀而引起的循环稳定性差、容量衰减快及首圈库伦效率不高等问题[14~17]. 为了克服上述问题,研究者通过水热法[14]、溶胶-凝胶法[15]和化学气相沉积法[18]等不同的合成方法,设计合成了微纳米级的多孔八面体、大量小粒子堆积成的微球及核壳纳米结构等特殊形貌. 如,Liu等[15]利用水热反应,将聚乙烯吡咯烷酮(PVP)作为软模板经多次反应得到多孔FeS2@C八面体. 该材料表现出极好的倍率性能,在1,2.5和5 C的大电流倍率下,可分别贡献出439,340和256 mA·h·g-1的可逆容量; 同时也表现出良好的循环稳定性,在0.5 C的电流倍率下,50次循环后容量仅衰减10%,可逆容量保持在495 mA·h·g-1. Ding等[19]用六水硫酸铁铵的乙二醇溶液与硫脲的乙二醇溶液(体积比1∶1)混合在200 ℃下水热反应24 h,再在500 ℃高温下煅烧2 h得到了由纳米片组装成的2~5 μm的FeS2微米球,并测试了其电化学性能,发现其在1~2.4 V电压区间内循环730次后可逆容量保持在216.8 mA·h·g-1. 上述工作为FeS2材料的未来应用提供了理论支持,但目前FeS2的合成过程复杂耗能,而且需要使用活性剂及模板进一步加工合成,这都将影响其在锂离子电池中的实际使用. 本文通过简单的一步水热法,在不添加活性剂的情况下合成了由FeS2纳米片堆积而成的FeS2微球,并探讨了其形成机理. 该堆积结构能缩短Li+传输路径并增加材料与电解液的接触面积,良好的结构优势使FeS2微球表现出稳定且良好的循环性能,对FeS2材料的实际应用起到了推动作用.
1 实验部分
1.1 试剂与仪器
FeCl2·4H2O(纯度99.0%)和Na2S2O3(纯度99.0%),国药集团化学试剂有限公司; 异丙醇(纯度99.0%),北京化工厂; 乙炔黑和聚偏氟乙烯(PVDF),均为电池级,上海市东氟化工科技公司;N-甲基吡咯烷酮(NMP,电池级),天津市科密欧化学试剂公司; 双(三氟甲基磺酰)亚胺锂(LiTFSI)、1,3-二氧戊烷(DOL)和乙二醇二甲醚(DME),均为电池级,阿拉丁试剂有限公司; Celgard 240隔膜,深圳市科晶智达科技有限公司; 锂片(纯度99.999%),天津中能锂业公司; 铝片(电池级),东莞新能源科技有限公司.
JEOL-2100F型透射电子显微镜(TEM),日本电子株式会社; XL30型场发射扫描电子显微镜(SEM),美国FEI公司; EscaLab 250Xi型X射线光电子能谱仪(XPS),美国Thermo Fisher公司; D8 Focuss型粉末X射线衍射(XRD)仪,德国Bruker公司; Prodigy型电感耦合等离子体原子发射光谱仪(ICP-AES),美国利曼公司; CT2001A型电池测试仪,武汉金诺电子有限公司; CHI760E型电化学工作站,上海辰华仪器有限公司.
1.2 实验过程
1.2.1 FeS2微球的制备 Scheme 1示出了FeS2微球的制备过程.

Scheme 1 Synthetic route of FeS2 microspheres
分别称取0.5 mol的FeCl2·4H2O和0.5 mol的Na2S2O3置于50 mL烧杯中,加入20 mL去离子水,搅拌至固体粉末完全溶解; 随后转移至40 mL带有聚四氟乙烯内衬的反应釜中,在鼓风干燥箱中于200 ℃恒温反应10 h; 待反应釜冷却至室温后,倾倒除去上层清液,将沉淀离心,用乙醇和水交替洗涤数次,将所得样品置于50 ℃烘箱中烘干,备用. 实验中考察不同反应时间的影响时,只改变恒温水热时间,其它条件不变; 考察反应物用量的影响时,只改变FeCl2·4H2O/Na2S2O3的摩尔数(1.5/1.5,1/1,0.5/0.5,0.25/0.25),其它条件不变.
1.2.2 电极片的制备 将制备的活性材料、乙炔黑导电剂和NMP按质量比7∶2∶1的比例混合,在研钵中进行充分研磨,然后转移至5 mL试管中,加入适量NMP搅拌成浆料,用涂布机将浆料在涂炭铝箔上涂抹成平整的一层,随后转移至真空干燥箱中于80 ℃ 干燥12 h,干燥后的极片经冲片、压片及再干燥工序即制得测试所需负极电极片.
1.2.3 电池的组装和测试 组装电池全程在充满氩气的手套箱中进行. 电池组装部件依次为负极电池壳、负极极片、聚丙烯多孔隔膜、适量电解液(1 mol/L LiTFSI+DOL+DME,VDOL∶VDME=1∶1)、金属锂片(作为对电极)、不锈钢垫片、弹性垫片及正极电池壳. 将各部件依次组装好后在封装机上完成电池封装,将封装好的电池置于恒温柜中12 h等待测试. 使用LAND测试仪进行恒电流充电/放电测试,使用电化学工作站进行循环伏安(CV)及电化学交流阻抗谱(EIS)表征. 恒电流测试电压区间为1.0~3.0 V,交流阻抗测试频率区间为0.1 Hz~100 kHz.
2 结果与讨论
2.1 材料的形貌和结构表征

Fig.1 SEM images of samples reacting for 1 h(A),2 h(B),3 h(C) and 4 h(D),respectively
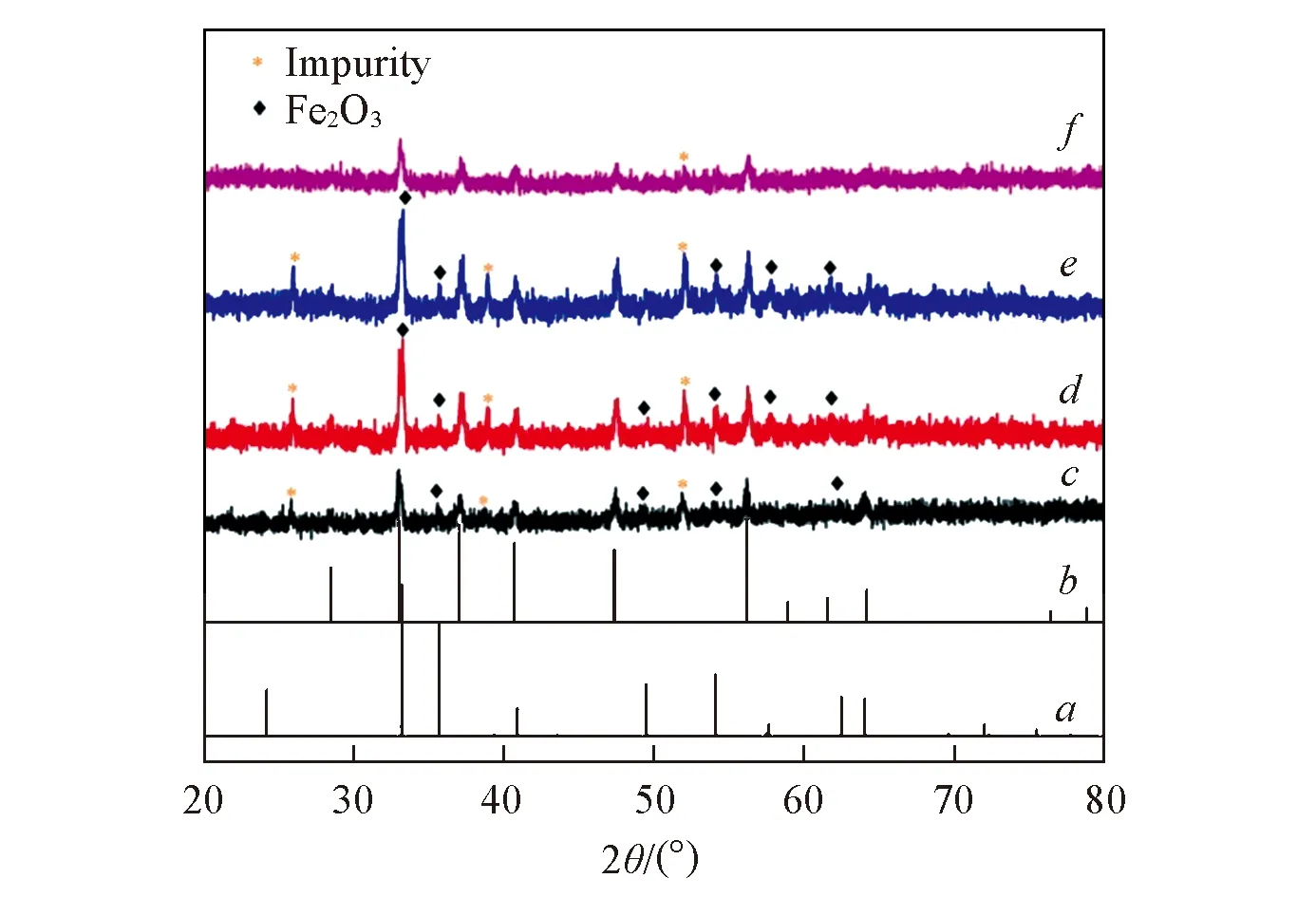
Fig.2 XRD patterns of samplesa. Fe2O3,JCPDS No.33-0664; b. FeS2,JCPDS No.71-1680. Reaction time/h: c. 1; d. 2; e. 3; f. 4.
图1示出了水热反应时间为1~4 h样品的SEM照片. 可见,在反应初期的4 h内粒子即已形成分散的球形形貌,粒径大小为4~7 μm,不同之处在于各时间段形成的粒子表面状态不同. 图1中各插图为相应粒子的局部放大图,由图1(A)插图可见,样品表面由大量细棒状和颗粒状的粒子相互交错堆积组成,结构疏松. 当反应时间达到2 h时[图1(B)插图],粒子表面发生明显变化,在细棒状结构的基础上颗粒相互黏连成型,并且棒开始加粗,结构由疏松状态向紧凑状态转变. 当反应进行到3 h时[图1(C)插图],从棱柱体的断裂面可以看到棱柱体内部由多个小粒子相互连接堆积而成,这说明棱柱体的形成可能是在之前粒子相互连接堆积的基础上发生了二次结晶造成的. 反应4 h时[图1(D)插图]也可观察到这一特征,另外,棱柱体上粒子的颗粒度明显高于反应3 h时的状态. 对此反应过程中的产物进行了XRD表征,由图2可见,反应1 h时出现的衍射峰与FeS2标准卡片(JCPDS No.71-1680)完全吻合[8],衍射峰强度较弱,峰形不尖锐,由此可以判断反应开始生成结晶度较低的FeS2. 此外,除FeS2的衍射峰外还检测到Fe2O3衍射峰的存在,FeS2衍射峰的强度逐渐发生变化,表明FeS2晶形越来越完整,结晶度也越来越高,Fe2O3衍射峰逐渐消失,同时还伴随杂质峰的出现. 随着反应时间的延长,生成的产物向纯FeS2相转变,但杂质峰仍然存在,至此,体系中以FeS2的生成为主. 实验过程中,打开反应釜后能闻到明显的刺激性臭鸡蛋气味,反应液经pH试纸检测呈酸性,说明有H2S气体生成并溶于水; 还在得到的沉淀中观察到红棕色物质,结合XRD表征结果可知该物质为Fe2O3. 基于此,对反应过程进行了如下推断: 反应初始阶段,投入原料后一部分Fe2+水解生成Fe(OH)2,Fe(OH)2在釜内空气和水的作用下逐渐转变成Fe(OH)3,随着温度的升高再生成Fe2O3. 涉及的化学反应过程如下:

(1)

(2)

(3)
Na2S2O3发生水解反应生成H2S,其反应历程如下:

(4)

(5)
H2S气体逐渐充满整个釜内,且会有部分溶于水,这也是反应后溶液呈酸性的原因,其中存在以下电离平衡:

(6)

(7)
另外部分的Fe2+会与S2-,H2S反应得到FeS2:

(8)

(9)
随着反应时间的延长,Fe2O3逐渐转变为FeS2:

(10)
(11)
当水热反应4 h时Fe2O3消失,但此时也不足以生成高结晶度的纯FeS2. 因此,后续延长了水热反应时间,并进行了一系列表征作为对比.
图3(A)~(D)分别为反应5,10,15和20 h时单个粒子的SEM照片,可见,随着水热反应时间的延长,产物依然保持较好的球形结构且由多个粒子堆积而成,产物粒径约8 μm. 在水热反应5 h时产物呈棱柱体堆积,反应时间10 h时产物呈片状堆积,而在反应15和20 h这2个时间段里,粒子的堆积逐渐紧凑且趋于不规则化. 对反应时间为10 h的产物进行了元素面扫描,由图3(E)~(G)所示结果可知,Fe和S元素均匀分布在粒子中.

Fig.3 SEM images of single particle reacting for 5 h(A),10 h(B),15 h(C) and 20 h(D) and elemental mapping of Fe(E), S(F) and the overlap of Fe and S for the single particle(G)
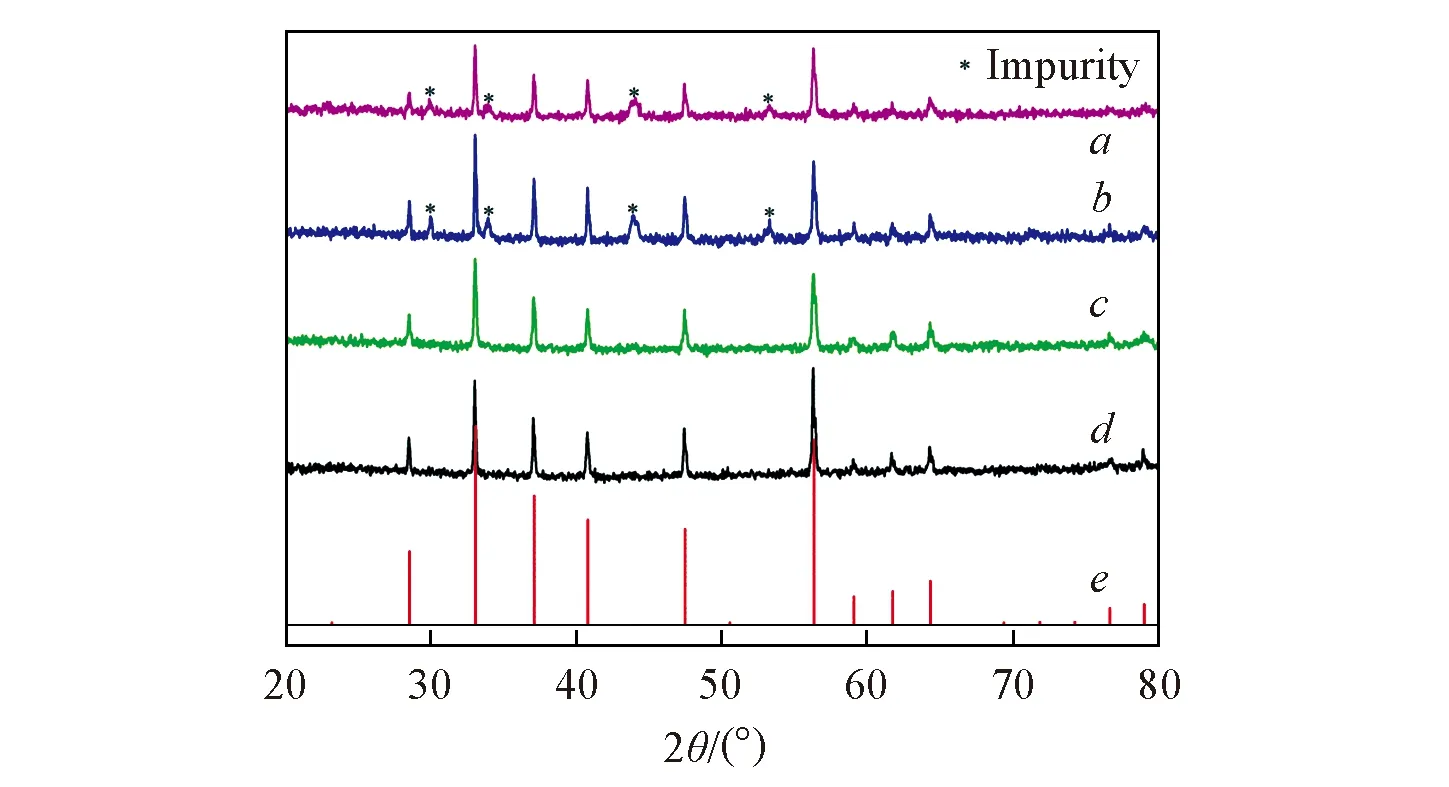
Fig.4 XRD patterns of samples Reaction time/h: a. 20; b. 15; c. 10; d. 5. e. FeS2,JCPDS No.71-1680.
图4为反应5,10,15,20 h时产物的XRD谱图. 可见,反应5和10 h时,衍射峰与FeS2的标准卡片(JCPDS No.71-1680)完全吻合,衍射峰尖锐且强度较高,无杂质峰出现,表明此时产物为高结晶度的纯FeS2; 而反应15和20 h时的产物则出现杂峰,经Jade 5软件分析可知杂质为Fe7S8. 综合以上数据分析发现,水热时间延长太久不利于得到纯的FeS2,且FeS2衍射峰强度也不再增强,说明已经形成了完整的FeS2晶体. 为了研究样品结晶度对电化学性能的影响,分别选取水热反应时间为5 h(S5)和10 h的产物(S10)进行了电化学性能测试.

Fig.5 SEM images of samples with different FeCl2/Na2S3O4 molar contents of 1.5/1.5(A),1/1(B),0.5/0.5(C) and 0.25/0.25(D)

Fig.6 XRD patterns of samples with different FeCl2/Na2S3O4 molar contentsFeCl2/Na2S3O4 molar content: a. 1.5/1.5; b. 1/1; c. 0.5/0.5; d. 0.25/0.25; e. FeS2,JCPDS No.71-1680.
其它反应条件不变,改变FeCl2/Na2S3O4的摩尔数分别为1.5/1.5,1/1,0.5/0.5和0.25/0.25考察了浓度对反应的影响. 图5为不同FeCl2/Na2S3O4摩尔数样品的SEM照片,可见当二者摩尔数为1.5/1.5时,形成的产物粒子杂乱无序,成型比例低,粒径约为2~8 μm. 当摩尔数为1/1的时候,粒子成型比例较高,粒径约为3~7 μm; 而二者在摩尔数为0.5/0.5的时候,粒子呈规则球形且成型比例高,分散均一,粒径约为8~10 μm; 当二者摩尔数降至0.25/0.25时,粒子分散性较好且成型比例高,尺寸均一,粒径约为3~5 μm. 利用XRD对不同摩尔比的产物进一步表征,图6中4个样品的衍射峰均与FeS2标准卡片(JCPDS No.71-1680)完全吻合,且未出现其它杂质峰,衍射峰强度较高,以摩尔数为0.5/0.5样品的衍射峰强度最强,同时该样品的衍射峰尖锐平滑,说明与其它摩尔数产物相比,0.5/0.5摩尔数条件下生成的FeS2具备最高的纯度和结晶度. 通过ICP测试可知,Fe和S的摩尔比为1/1.98,非常接近1/2,这进一步证明形成了FeS2. 综合以上分析可知,通过改变FeCl2与Na2S3O4的用量可以得到较高纯度和较好结晶度的FeS2,后续选择以FeCl2/Na2S3O4摩尔数为0.5/0.5为最佳比例进行实验.
为进一步研究反应产物的元素化学价态,利用XPS对产物进行了分析. 图7(A)所示为Fe2p谱图,出现了4个平滑的特征峰,在结合能为706.9和720 eV处出现的2个特征峰分别对应于Fe2p3/2和Fe2p1/2,表明Fe为正二价[17]. 另外,位于711和723 eV处的2个峰为Fe3+的特征峰,推测可能是产物中存在极少量的Fe2O3所致,这与XRD表征结果相符. 在O1s谱图[图7(B)]中于531.4 eV处也出现了氧化铁的特征峰. 与图7(A)不同的是,在图7(C)所示的S2p谱图中,只观察到2个特征峰(位于162.2和163.4 eV处),分别与S2p3/2和S2p1/2相对应,可判断此处的S是负二价[19],再次证明了反应产物中FeS2的存在.

Fig.7 XPS spectra of Fe2p(A) ,S2p(B) and O1s(C) for the sample with a FeCl2/Na2S3O4 molar content of 0.5/0.5
2.2 材料的电化学性能

Fig.8 First three CV curves at a scanning rate of 1 mV/s
为了考察该材料的电化学反应机理及性能,利用电化学手段进行了检测并推测了可能的反应机理. 图8所示为材料的前3圈CV曲线图,电压区间为1.0~3.0 V,扫描速率为1 mV/s.
由图8可见,在第一圈的放电过程中1.51 V处出现一个突出还原峰,这主要是由于发生了如下反应[15,16]:

(12)

(13)
在室温下,由于Li+到FeS2电极的传输速度较慢,所以上述2个反应进行得十分缓慢,才会导致在约1.5 V出现一个较长的平台,即在CV曲线中出现的首个强还原峰. 在第一圈的充电过程中,分别在1.97和2.35 V处观察到2个氧化峰,其存在归因于以下反应过程[8]:

(14)

(15)

(16)
随着充电过程的进行,在FeS2电极上会产生ortho-FeS2,FeS8/7和S等物质,导致充放电机理在第二圈以后发生变化,对于半电池来说,在随后的循环中氧化还原峰的位置会发生改变. 随着循环次数的增加,还原峰偏移到1.46~1.5 V之间,在2.08 V附近也出现了不明显的还原峰,表明在第一圈和之后的循环之间,Li+/FeS2之间的反应发生变化,这是一个不可逆的化学过程. 随着循环次数的增加,CV曲线较好地重合在一起,说明FeS2电极具备较好的稳定性. 为进一步测试其是否具备高容量性能,选取样品S5和S10(铁源和硫源摩尔数为0.5/0.5)进行了容量性能对比测试.
材料的充放电容量及库伦效率是衡量其在电池应用领域潜力的重要参数. 图9示出了500 mA/g电流密度下前3圈循环及第50圈循环的充放电曲线. 由图9可知,在2张充放电曲线图中,首次放电曲线在1.5 V附近均存在一个长又平滑的放电平台,放电电压只发生少许变化,这一电压平台的出现与CV曲线中出现的还原峰电压位置基本吻合,其形成原因可能是发生了材料锂化反应[式(12)和(13)]. 样品S5首次放电容量可达710 mA·h·g-1,首次充电容量可达600 mA·h·g-1,首次库伦效
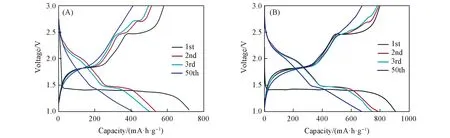
Fig.9 Voltage-capacity curves of S5(A) and S10(B)
率达到80%,50次循环后衰减较严重,仅呈现401 mA·h·g-1的可逆容量; 样品S10则表现出更优的充放电容量,首次放电容量可达905 mA·h·g-1,首次充电容量达到800 mA·h·g-1,首次库伦效率为88%,循环50次后仍然能贡献680 mA·h·g-1的可逆容量. 对2种样品进行充放电测试时均出现前几次循环容量衰减的情况,尤其以样品S5更严重,容量衰减可归因于充放电期间锂离子的嵌入和脱嵌引起体积膨胀,致使材料出现一定的结构坍塌. 与样品S5相比,样品S10为纳米片堆积结构,能有效缓冲体积膨胀,缩短Li+传输路径,在循环几次后逐渐形成稳定的固态电解质膜(SEI),容量逐渐趋于稳定. 对两者进行对比测试发现,样品S10容量性能更优. 优良的容量性能可归于其纳米片堆积的结构,增加了电极材料与电解液有效接触面积,大量的纳米片同时也为Li+提供了更多的活性位点.
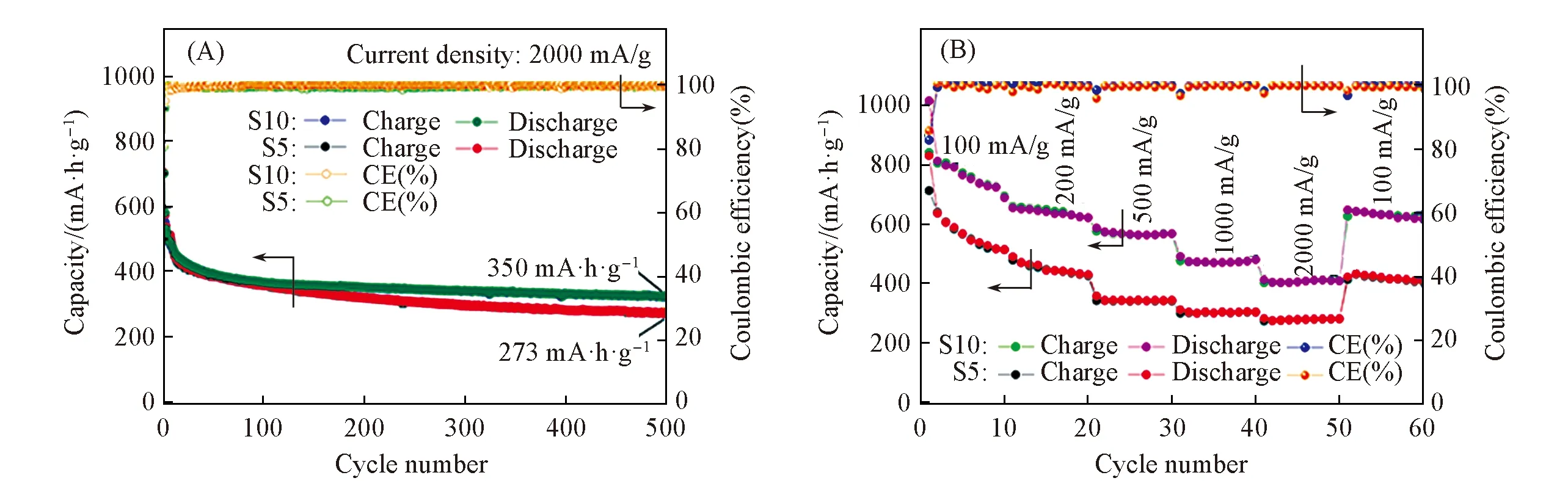
Fig.10 Long cycling performance(A) and rate performances(B) of FeS2 microspheres

Fig.11 SEM image of sample-S10 after cycling at 2000 mA/g for 500 cycles
通过恒电流充放电实验对2种样品进行了长循环性能的测试,结果如图10(A)所示. 当电流密度增加到2000 mA/g时,经过500次的充放电循环后样品S5的大电流循环稳定性稍弱于样品S10,前者仅表现出273 mA·h·g-1的可逆容量,而后者则表现出350 mA·h·g-1的可逆容量. 后者具有更良好的循环稳定性应得益于其特殊的堆积结构,纳米片的相互堆积为材料提供了一定的体积膨胀缓冲地带,使材料不至于粉碎严重而脱落. 图11为样品S10在2000 mA/g电流密度下循环500圈后的SEM照片,可见材料结构在循环后保持得很完整.
倍率性能作为衡量电极材料电化学性能的一项重要指标,决定着材料的应用前途. 图10(B)为样品S5和样品S10在电流密度分别为100,200,500,1000,2000和100 mA/g时的倍率性能图,可见,样品S10在各电流密度下分别表现出690,632,602,500,410和680 mA·h·g-1的可逆容量,而样品S5仅表现出510,430,380,310,290和403 mA·h·g-1的可逆容量. 可见,在所测电流密度下样品S10均表现出更高的可逆容量.

Fig.12 EIS data of samples S5(a) and S10(b)
通过交流阻抗(EIS)实验对样品S5和S10进行了表征. 如图12所示,两者的交流阻抗曲线均由高频区的一个半圆和低频区的一条斜线组成,半圆代表材料与电解液的接触阻抗,半径越大说明阻抗越大,斜线代表的是离子的扩散阻抗[20,21]. 可见,样品S5的半圆直径更大,其接触阻抗为1000 Ω,而样品S10的接触阻抗为490 Ω; 此外,样品S10的斜线角度更接近45°,表明样品S10有更好的导电性且传输Li+的速度更快,致使其具有更好的电化学性能. 综上分析,适当延长水热时间可得到纯度更高和结晶度更完整的FeS2,从而达到优化电化学性能的目的.
3 结 论
通过简单的水热法制备了纳米片堆积结构的FeS2微球. 探讨了反应时间以及铁源与硫源摩尔比对产物的影响,同时也推测了FeS2微球的生长机理,利用SEM和XRD表征手段进行了反应条件的优化筛选,选取5和10 h作为反应时间,铁源和硫源的摩尔比为0.5/0.5进行投料. 对样品S5和样品S10进行了电化学性能测试,结果显示,样品S10的各项电化学性能均优于样品S5,最终确定水热反应时间为10 h. 本文利用简单方法制备的FeS2微球表现出良好的循环稳定性及较长的循环寿命,为FeS2的未来研究及应用提供了科学论据.

