小檗碱对大鼠脑缺血/再灌注损伤的保护作用及免疫机制*
孙 科, 罗招亮, 胡 琛, 龚廷亮, 唐国华, 吴绍萍
(1. 重庆市中医院脑病科, 2. 心内科, 重庆 400011)
目前,全球老龄化严重,缺血性脑卒中是老年人常见疾病,该疾病日益成为全球关注的健康难题。缺血性脑卒中是临床常见的心脑血管疾病,主要由于血栓形成、血管畸形造成脑组织局部缺血缺氧而导致神经细胞凋亡、坏死,具有发病率高、死亡率高及致残率高等特点。脑缺血/再灌注损伤(cerebral ischemia/reperfusion injury, CI/RI)是脑缺血恢复供血后,其功能未能恢复,反而引起较缺血性脑卒中更严重的脑机能障碍,常导致神经元脱失、变性及功能的改变,影响神经信息传递和神经功能恢复[1]。
小檗碱(BBR)为中药黄连(Coptischinensis)中提取的主要活性成分。研究显示小檗碱具有抗炎、抗血栓、抗氧化应激、抗动脉粥样硬化、调血脂及抗肿瘤等多种药理作用[2]。据报道,小檗碱具有良好的治疗缺血性脑卒中及脑缺血/再灌注损伤保护作用[3-4]。但小檗碱对脑缺血/再灌注损伤保护的作用机制研究有待深入。本文拟通过观察小檗碱干预后脑缺血/再灌注大鼠的神经功能,考察其对大鼠氧化应激、免疫炎症反应以及NF-κB-NLRP3信号轴的调控作用,探讨小檗碱对大鼠脑缺血/再灌注损伤的保护作用及机制。
1 材料与方法
1.1 试剂
小檗碱对照品(批号:110713-201212,中国食品药品检定研究院);2,3,5-三苯基氯化四氮唑(TTC,批号:20160500,上海灵锦精细化工有限公司);鼠NO、SOD、GSH-Px、TNF-α、IFN-β及IL-6检测试剂盒(批号分别为20176020NOM、20174899SODM、20146660GSHM、20175200IFNM、20170052TNFM、20170588IL6M,上海拜力生物科技有限公司);APC anti-Rat CD4、FITC anti-CD8抗体(美国e Bioscience);Trizol试剂(批号:20150502,美国Invitrogen公司);SYBRGreen PCR试剂盒、逆转录试剂盒(批号分别为A5001-1、AA406-1,日本TaKaRa公司);兔抗NF-κB p65、NLRP3、ASC和caspase-1多克隆抗体(批号分别为ab16502、08063965、2813878和GR202191-1,英国Abcam公司);β-actin兔抗鼠一抗、HRP标记山羊抗兔IgG二抗、蛋白质分子量Marker及BCA蛋白定量试剂盒(批号分别为00021408、00081307、00131456及23072018,北京康为世纪生物科技有限公司);生理盐水(批号:2A15090928,浙江莎普爱思药业股份有限公司);其余试剂均为分析纯。
1.2 仪器
R-4100型酶标仪(美国Dynatech公司);FA1004N电子天平(上海民桥精密科学仪器有限公司);-80℃超低温冰箱(美国Thermo公司);FACSAriaⅢ型流式细胞仪(美国BD公司);F6-10手提式电动匀浆机(德国FLUKO公司);ABI-7300 Real-time检测仪(美国ABI公司);D-37520型低温离心机(赛默飞世尔科技公司);PowerPac HC高电流电源电泳仪((美国Bio-Rad公司)。
1.3 动物
SPF级的SD大鼠50只,雄性,体重(200.0± 5.2) g,均购自浙江省医学科学院实验动物中心,合格证编号:SCXK(浙2015-0033)。
1.4 造模与给药
SD大鼠随机均分为5组:假手术组(Sham组)、模型组(Model组)、小檗碱高中低剂量组(BBR-H、BBR-M、BBR-L组)。适应性饲养一周后,以Longa等线栓法[5,6]脑缺血/再灌注造模方法为参考。其中Sham组仅分离血管,不插入线栓。各组均进行缺血2 h后,再灌注24 h处理。造模成功后2 h灌胃,BBR-H组大鼠给予100 mg/kg小檗碱、BBR-M组大鼠给予50 mg/kg小檗碱、BBR-L组大鼠给予25 mg/kg小檗碱、假手术组及模型组灌以等体积(1.5 ml)的生理盐水[7,8]。给药后24 h,麻醉处死,将新鲜全脑组织,滤纸吸干表面水分,称质量后将其置于-20℃冰箱中速冻20~30 min备用。眼眶静脉丛采血,加大鼠淋巴细胞分离液分离,以3 000 r/min低温离心15 min,取血清和白膜层备用。
1.5 神经功能缺损程度评分
采用Longa法进行神经功能缺损程度评分,主要包括提尾反射、行走测试、感觉测试、平衡测试、反射缺失和反常运动,各项目总和记为最终评分:1~6分为轻度损伤,7~12分为中度损伤,13~18分为严重损伤[9]。
1.6 脑梗死率的测定
取各组大鼠全脑组织,制成2~3 mm间距行冠状切片,用配好的1%TTC溶液染色30 min,分离梗死组织呈苍白色部分并称质量,然后计算脑梗死率(脑梗死率=脑梗死组织质量/脑组织质量×100%)。
1.7 抗氧化因子活性、细胞因子及NO含量测定
取各组大鼠的血清,按ELISA试剂盒说明书测定SOD、GSH-Px抗氧化酶活性及细胞因子TNF-α、IFN-β、IL-6和NO的含量。
1.8 免疫功能测定
取各组大鼠的白膜层,再分别加入APC anti-Rat CD4和FITC anti-CD8抗体,混匀,40℃避光孵育30 min,标记细胞表面抗原CD4、CD8染色。离心5 min后弃上清,加入PBS 1.5 ml混匀。重复离心5 min弃上清,加入0.5 ml PBS重悬细胞于离心管,立即用流式细胞仪检测。
1.9 大鼠脑组织中NF-κB-NLRP3信号轴关键基因的测定
将大鼠脑组织在匀浆机中迅速匀浆,先按RNA提取试剂盒说明书提取总RNA,符合实验要求的RNA采用逆转录试剂盒逆转录为cDNA。将上述cDNA进行PCR扩增,反应条件为:95℃预变性10 min,95℃变性15 s,60℃退火、延伸45 s,共40个循环。β-actin作为内参基因,在Real-time PCR检测仪上检测NF-κB p65、NLRP3、ASC及caspase-1基因表达。经仪器分析得出各个样品量的Ct值,所有样品基因均经过内参均一化处理,然后用公式2-△△Ct计算mRNA的相对表达量,△△Ct计算公式如下:△△Ct=(Ct目的基因-Ct内参)实验组-(Ct目的基因-Ct内参)假手术组。各引物由上海生工生物工程股份有限公司设计并合成,各引物序列见表1。NF-κB p65 上游引物5' GCACAGATACCACCAAGAC 3',下游引物5' AGCCTCATAGTAGCCATCC 3'。NLRP3上游引物5' CTCGCATTGGTTCTGAGCTCA 3',下游引物5' AGTAAGGCCGGAATTCACCA 3'。ASC上游引物5' TGGAGTCGTATGGCTTGGAG3',下游引物5' TGTCCTTCAGTCAGCACACT3'。caspase-1上游引物5' ACTCGTACACGTCTTGCCCTC 3',下游引物5' CTGGGCAGGCAGCAAATTC 3'。β-actin 上游引物 5' GTGACACCCACTCTTCCACC 3',下游引物 5' GTGGTCCAGGAGGCTCTTAC 3'。
1.10 大鼠脑组织中NF-κB-NLRP3信号轴关键蛋白的测定
按照1∶10(g/ml)的比例加入RIPA裂解液,按BCA蛋白定量试剂盒说明书方法测定所提取的各组大鼠脑组织的总蛋白含量,以确保每组样本之间的上样量相同。裂解、提取各组大鼠脑组织蛋白后,经SDS-PAGE电泳分离,转至硝酸纤维素膜,将转好的PVDF膜于5%脱脂奶粉溶液中室温封闭2 h,TBST洗涤液漂洗3~4次。加入一抗,4℃孵育过夜。再漂洗3~4次,加入HRP标记的二抗体,室温孵育2 h,漂洗3~4次。化学发光检测底物ECL工作液显色,采用Image J图像分析系统对蛋白显影图进行灰度分析,分别考察各组大鼠脑组织中NF-κBp65、NLRP3、ASC及caspase-1的蛋白表达水平。
1.11 统计学处理

2 结果
2.1 实验大鼠神经功能缺损程度评分
与Sham组比较,Model组神经功能缺损程度评分显著提高(P<0.01)。BBR-H、BBR-M、BBR-L组神经功能缺损程度评分与Model组比较,均显著下降(P<0.01),且随浓度降低,神经功能缺损程度评分下降趋势减少。提示,不同剂量小檗碱治疗可减轻脑缺血/再灌注大鼠的神经功能缺损程度(表1)。
Tab. 1 Effects of berberine on the scores of neurological deficit in rats with cerebral ischemia/reperfusion injury n=10)
2.2 实验大鼠脑梗死率的检测
与Sham组比较,Model组大鼠脑梗死率显著上升(P<0.01)。BBR-H、BBR-M、BBR-L组的脑梗死率与Model组比较,均显著下降(P<0.05),且可见各剂量组间存在一定量效关系。提示,小檗碱治疗可减少脑缺血/再灌注大鼠的脑部的梗死。结果见表1。
2.3 实验大鼠血清抗氧化指标及细胞因子的检测
与Sham组比较,Model组大鼠血清中NO、TNF-α、IFN-β、IL-6含量升高,血清中SOD、GSH-Px活性下降(P<0.01);与Model组比较,BBR-H、BBR-M、BBR-L组大鼠血清NO、TNF-α、IFN-β及IL-6含量显著下降(P<0.05),血清中SOD、GSH-Px活性升高,且BBR-H组的变化程度均高于BBR-M、BBR-L组(P<0.05,表2)。
Tab. 2 Effects of berberine on thelevels of serum antioxidant factors and cytokines in rats with cerebral ischemia/reperfusion injury n=10)
2.4 实验大鼠血清T淋巴细胞亚群的检测
与Sham组比较,Model组大鼠的T淋巴细胞亚群CD4+、CD8+及CD4+/CD8+水平显著下降(P< 0.01)。BBR-H、BBR-M、BBR-L组大鼠血清中CD4+、CD8+及CD4+/CD8+水平与Model组比较,均显著提高(P<0.01)。提示,小檗碱干预24 h后,可提高脑缺血/再灌注大鼠的免疫功能(表3,图1)。
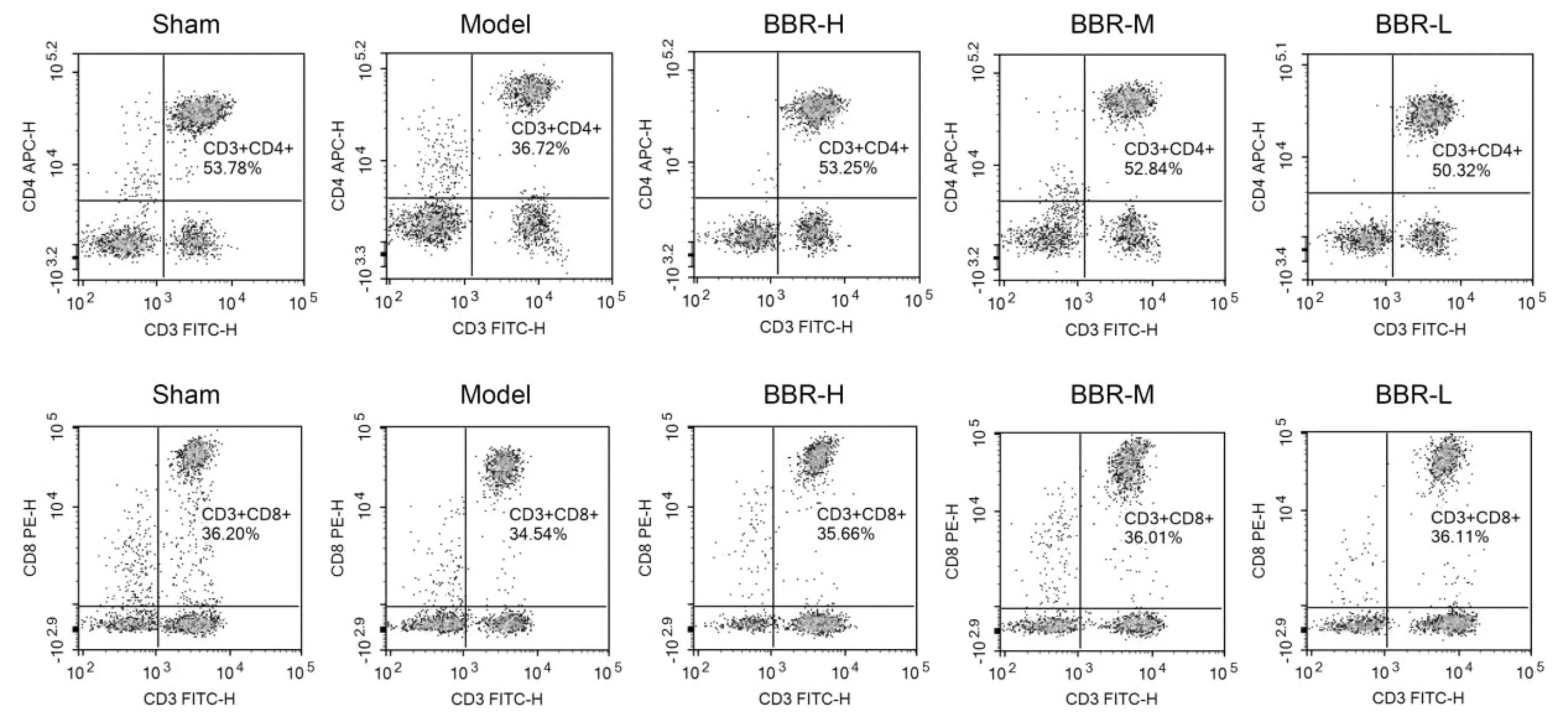
Fig. 1 Flow result diagram of T lymphocytes induced by berberine in rats with cerebral ischemia-reperfusion injury n=3)
Tab. 3 Effects of berberine on the levels of T lymphocyte subsets in rats with cerebral ischemia-reperfusion injury n=3)
2.5 实验大鼠脑组织中NF-κB-NLRP3信号轴基因与蛋白表达
与Sham组比较,Model组大鼠脑组织NF-κBp65、NLRP3、ASC及caspase-1的mRNA与蛋白表达量均显著升高(P<0.01)。与Model相比,小檗碱各组大鼠脑组织NF-κBp65、NLRP3、ASC及caspase-1的mRNA与蛋白表达量均显著降低(P<0.05,图2,表4,表5),且小檗碱高中低剂量组间具有一定的量效关系。

Fig. 2 Effects of berberine on the expressions of NF-κB-NLRP3 signaling axis-related proteins in brain tissue of rats with cerebral ischemia-reperfusion injury
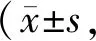
Tab. 4 Effects of berberine on the expressions of NF-κB-NLRP3 signaling axis-related genes in brain tissue of rats with cerebral ischemia-reperfusion injury n=10)
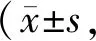
Tab. 5 Effects of berberine on the expressions of NF-κB-NLRP3 signaling axis-related proteins in brain tissue of rats with cerebral ischemia-reperfusion injury n=3)
3 讨论
我国每年约300万人死于缺血缺氧性心脑血管病[10],严重危害人类健康。但临床上对脑缺血/再灌注损伤的防治手段有限,为目前亟待解决的难题[8]。脑缺血/再灌注损伤(CI/RI)涉及机制较为复杂,涉及氧化应激、炎症反应、神经功能性毒性及机体信号传导等方面[8,11,12]。
CI/RI会导致机体神经功能缺损,神经元脱失、变性及功能的改变,影响神经信息传递和神经功能恢复[1]。本文建立脑缺血/再灌注损伤大鼠模型,考察小檗碱干预后对CI/RI大鼠神经功能的治疗作用。结果发现,小檗碱治疗后,可观察到大鼠的提尾、行走、反常运动等有明显改善,进一步研究发现CI/RI大鼠的神经功能缺损程度明显改善,脑梗死率显著降低,因此提示小檗碱可有效提升模型大鼠的神经功能并较少脑梗死率,与文献报道具有一致性[13]。
为探究小檗碱治疗CI/RI大鼠的作用机制,本文检测了模型大鼠血清抗氧化因子及细胞因子水平,并考察其免疫功能。据报道,氧化应激是脑缺血/再灌注发生过程的一种重要机制,因缺血引起氧和能量供应不足使线粒体功能紊乱,细胞内氧自由基生成增加或自由基清除能力不足,氧自由基在细胞内积聚,诱导细胞凋亡和坏死,因此降低氧化应激为治疗脑缺血的重要策略。NO作为重要的细胞间信号传递分子,在脑缺血/再灌注损伤等状态下,激活诱导型iNOS能够催化生成大量NO,其与ROS生成ONOO-和N2O3,诱导氧化应激损伤和亚硝基化损伤,导致SOD、GSH-Px活性降低[14]。因此SOD、GSH-Px、NO均在脑缺血的氧化应激中发挥重要作用。同时,细胞因子在神经系统疾病及相关炎性水肿中起关键作用。在缺氧情况下相应细胞会释放出炎症介质,CI/RI后脑组织内会渗入血液系统的成分,导致血源性水肿。继而导致内皮细胞的细胞因子TNF-α、IFN-β及IL-6等的基因表达上调,释放炎症细胞因子,引发炎症反应[15]。此外,T淋巴细胞可抑制炎性反应及维持免疫稳态,在CI/RI的防治中亦具有重要作用[16,17]。T淋巴细胞主要分为辅助性CD4+T细胞和杀伤性CD8+细胞,研究认为CD4+T细胞作为IL-2、TNF-α等细胞因子的主要来源,可分泌大量的细胞因子,诱导体液免疫细胞的激活,同时通过信号传导激活CD8+T淋巴细胞;CD8+T淋巴细胞通过多种机制发挥免疫作用,两者体现机体免疫功能强弱[18]。因此,降低氧化应激及细胞因子,提高机体炎症免疫功能可视为CI/RI研究的有效途径。本文研究结果显示,小檗碱可调节CI/RI大鼠抗氧化因子(SOD、GSH-Px、NO)及细胞因子水平(TNF-α、IFN-β及IL-6),以降低机体氧化应激与炎症反应,提高脑缺血/再灌注损伤大鼠的抗炎免疫功能。
据文献报道,机体免疫存在NLRP3炎性体(NLRP3-ASC-caspase-1),该炎性体可由TLRs(Toll like receptors)信号激活的转录因子NF-κB诱导形成[19,20]。NF-κB信号与NLRP3炎性体的信号传导关系即为NF-κB/NLRP3信号轴,其与调控机体免疫应激及炎症相关发病机制有关[20]。提示NF-κB/NLRP3信号轴可能调控机体氧化应激及炎症反应,而影响脑缺血/再灌注的发生发展。本文检测NF-κB/NLRP3信号轴相关蛋白时发现,小檗碱可显著降低模型大鼠脑组织NF-κBp65、NLRP3、ASC及caspase-1基因与蛋白表达,提示小檗碱可通过抑制NF-κB/NLRP3信号轴,发挥对大鼠脑缺血/再灌注损伤的保护作用。可见NF-κB/NLRP3信号轴可能关联机体免疫应激及炎症反应机制发挥治疗CI/RI作用。
综上,小檗碱可通过调控氧化应激与炎症反应,提高大鼠免疫功能,抑制NF-κB/NLRP3信号轴关键靶点表达,从而改善脑缺血/再灌注大鼠的神经功能及减少脑死亡率,发挥免疫保护作用。

