甲基-β-环糊精载胆固醇对GV期猪卵母细胞冻融后体外成熟及其受精能力的影响
汪秋月,张靖田,罗晓彤,陈 璇,金 一,徐 妲*
(1.延边大学农学院,吉林延吉 133002;2.珲春市哈达门乡畜牧兽医站,吉林珲春 133309)
配子和胚胎的低温保存已成为保护人类和动物遗传物质的一种广泛工具[1]。卵母细胞冷冻保存及体外培养是一种具有潜在价值的技术,但与卵巢组织和整个胚胎冷冻保存研究相比,卵母细胞冷冻保存的研究仍然落后[2]。因此,提高卵母细胞的冷冻保存及胚胎发育具有很高的研究价值。哺乳动物细胞的低温保存有2种截然不同的保存方法[3],即常规的缓慢冷冻和玻璃化冷冻。缓慢冷冻会增加细胞损伤,玻璃化冷冻方法的有效性得以突出[4]。此外,成熟卵母细胞的低温保存可能导致透明带(ZP)硬化进而影响受精过程[5]。因此,无论使用任何方法冷冻保存细胞,单独或组合使用冷冻保护添加剂成为必需。近年来研究发现,环糊精能有效调节膜胆固醇含量[6],提高疏水性物质的溶解性,因此被视为一种有效的载体体系,甲基-β-环糊精载胆固醇(CLC)是最有效的环糊精家族成员。在冷冻保存前,用 CLC 对几个冷休克敏感品种的精子进行冷冻处理,可提高精子的冷冻存活率[7]。有研究表明,CLC 进入卵丘细胞和卵母细胞可提高玻璃化成熟牛卵母细胞的存活率[8]。细胞凋亡是一种必不可少的细胞程序,其中 Caspase-3 是一种经常被活化的死亡蛋白酶,催化许多关键细胞蛋白的特异性切割。Caspase-3 也是细胞凋亡的一些典型标志[9],对于所有细胞类型中的凋亡染色质浓缩和DNA片段化是必不可少的。目前关于CLC对猪GV期卵母细胞冻融体外培养成熟后细胞凋亡损伤的研究很少。因此,本研究中在玻璃化冷冻液中添加不同浓度冷冻保护剂CLC,探究CLC对GV期猪卵母细胞冻融后细胞凋亡表达,以及探索CLC在猪卵母细胞成熟、ZP硬化和精子-卵母细胞结合中的作用。
1 材料与方法
1.1 材料 猪卵巢取自于延吉市屠宰场;公猪精液取自于延吉市种猪站。
TCM-199、NaHCO3、NaCl、KCl、Hepes、EDTA、PBS、Hoechst33342、Anti-Rabbit IgG、Tris 均购自Sigma 公司;Cleaved Caspase3(Asp175)Antibody 购自CellSignaling。SDS 电泳液、ECL显色液均购自碧云天生物技术研究公司。
1.2 主要药品配置 卵母细胞成熟培养液:称取 0.274 8 g葡萄糖、1.053 g NaHCO3、0.05 g丙酮酸钠、7.5 g TCM-199、0.037 5 g青霉素、0.025 g链霉素、0.5 g聚乙烯醇溶于去离子水中定容至 500 mL,于 4℃下存放。玻璃化冷冻液:4.788 g蔗糖于50 mL离心管中,分别加入5.25 mL乙二醇、5.25 mL DMSO、3.5 mL血清、10.25 mL TCM-199,轻轻摇晃至完全溶解后,用 TCM-199 定容至 35 mL晃动溶解,-20℃冷冻保存。
1.3 卵丘一卵母细胞复合体(COCs)的获取和 GV 期卵母细胞的玻璃化冷冻 用 20 mL注射器抽取卵巢上直径为3~6 mm的卵泡中的卵泡液,将卵泡液注入到 15 mL离心管中置于 38.5℃的水浴锅中30 min,吸去上清液加入10 mL TCM-washing洗 液,在38.5℃、5% CO2、最大饱和湿度的培养箱中静置10 min,重复 2 遍后挑取COCs,即GV期卵母细胞。试验分别在玻璃化冷冻保护液中添加0(对照组)、0.5、5、10 mg/mL CLC。将挑选好的COCs在平衡液中平衡 5 min,每10枚加入50 μL的冷冻液,然后COCs转移到冷冻管,浸入液氮中进行冷冻保存。
1.4 玻璃化冷冻的卵母细胞解冻及体外成熟培养(IVM)冷冻2周后取出卵母细胞,置于解冻溶液中解冻后,再用成熟液将卵母细胞洗涤2~3次,然后转移到含有10%血清的TCM-199中恢复1 h。恢复后用预平衡的TCM 洗涤液、PBS 缓冲液和IVM溶液洗涤5次,直到卵母细胞周围没有杂质。然后将卵母细胞放置在预平衡的体外成熟培养小滴中,置于最大饱和湿度为38.5℃,5% CO2 的培养箱中培养44 h。排出第一极体标志着卵母细胞核成熟,即MⅡ期。
1.5 卵母细胞蛋白提取 分别将150枚成熟卵母细胞放入离心管中,加入 25 µL NaH2PO4缓冲液,70℃水浴40 min,然后4℃ 6 000 r/min离心2 min,取上清液-80℃待用。
1.6 蛋白免疫印迹(WB)分别取20 μL卵母细胞蛋白和5×钠-十二烷基硫酸盐缓冲液在 100℃水浴8 min,在电压为100 V 条件下进行聚丙烯酰胺凝胶电泳(SDSPAGE)。电泳完毕后,4℃电流200 mA电转移法转到PVDF膜上约40 min,不留有气泡。转膜后用TBST洗膜3次,每次10 min,室温将膜用5%牛血清白蛋白(BSA)在Tris缓冲盐水(TBST)中封闭1 h。加入一抗4℃孵育12 h,弃一抗,TBST洗膜3次。加入二抗,室温孵育2 h后弃二抗,再次洗膜3次。将ECL染色均匀滴到PVDF膜上,避光出现条带拍照保存。
1.7 ZP硬化分析 在37℃电热恒温板上,将每组10枚成熟卵母细胞放入0.05 % 的链酶蛋白酶80 μL小滴中,在显微镜下观察ZP硬化所需要的时间,将卵母细胞置于链酶蛋白酶溶液中的时间与以显微镜 200倍的放大倍数不再可见ZP的时间间隔为ZP硬化时间。
1.8 精卵结合测定 成熟卵母细胞在 PVA缓冲液小滴中清洗3次,每 15个放到1个获能小滴中,每个小滴注入50 μL精液,培养箱中孵育6 h。将受精卵在0.1% PBSPVA液中洗涤 4 次,用戊二醛溶液固定30 min,PVAPBS清洗 3次后,用Hoechst 33342染色10 min。然后在荧光显微镜下观察并拍照。
1.9 统计分析 每组试验均重复5次。使用Image J软件对Western blot结果进行分析。数据使用 SPSS 19.0软件进行方差分析,数据表示为平均值±标准误,P<0.05表示差异显著。
2 结果
2.1 CLC对猪GV期卵母细胞冻融后体外成熟率的影响由表1可见,0.5 mg/mL CLC处理组和对照组的卵母细胞成熟率差异不显著,5 mg/mL CLC处理组的卵母细胞成熟率显著高于对照组和0.5 mg/mL CLC处理组,但与10 mg/mL CLC处理组差异不显著。
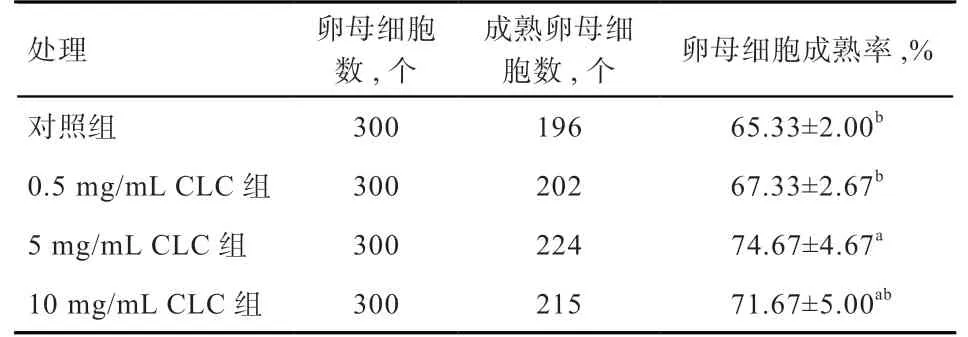
表1 CLC对GV期猪卵母细胞冻融后体外成熟率的影响
2.2 CLC对GV期猪卵母细胞冻融体外成熟培养后凋亡蛋白表达的影响 免疫印迹分析后,在 17 ku 处出现Cleaved Caspase-3蛋白条带(图1-A),灰度值分析结果显示(图1-B),5 mg/mL CLC处理组的Cleaved Caspase-3蛋白表达量显著低于对照组和0.5 mg/mL CLC处理组,与10 mg/mL CLC处理组没有显著差异。
2.3 CLC对GV期猪卵母细胞冻融体外成熟培养后透明带硬化时间的影响 由表2可见,5 mg/mL CLC处理组ZP的硬化时间显著低于对照组和0.5、10 mg/mL CLC处理组。

表2 CLC对 GV期猪卵母细胞冻融体外成熟培养后透明带硬化时间的影响 s
2.4 CLC对GV期猪卵母细胞冻融体外成熟培养后精-卵母细胞结合力的影响 由图 2 可见,0.5、5、10 mg/mL CLC处理组蓝色荧光数量均显著高于对照组,亮蓝色即为卵母细胞上黏附的精子。分析后得出,0.5、5、10 mg/mL CLC处理组精卵结合率显著高于对照组(图3)。
3 讨 论
目前,在各种物种中,冷冻保存的卵母细胞体外发育水平仍然很低[10]。其中卵母细胞质量和冷冻保存程序是影响卵母细胞成活的主要因素。在慢速冷冻过程中,可以形成细胞周围的液氮蒸汽并产生绝缘层,随后导致冷却速率降低并且可能发生细胞结晶[11],而卵母细胞的玻璃化溶液可以确保细胞被液氮包围而不是蒸汽包围。玻璃化冷冻克服了慢速冷冻方法的缺点,适用于卵母细胞冷冻保存。胆固醇是膜的主要结构并调节其功能,具有高浓度胆固醇的膜在低温下更具流动性,在冷却过程中更能抵抗损伤[12]。CLC具有很高的亲和力,使用 CLC来改变细胞膜胆固醇的水平,能提高绵羊[13]、牛[14]和马[15]对冷冻保存的耐受性和冷冻存活率。本研究发现,冷冻保护剂中添加5 mg/mL CLC显著提高了卵母细胞成熟率,说明CLC在猪GV期卵母细胞的冻存中对卵母细胞膜起到了保护作用,对细胞的冷冻损伤起到缓解作用。
凋亡性细胞死亡是卵泡闭锁过程中细胞损失的潜在机制[16]。在整个卵泡发育过程中,颗粒细胞和卵母细胞可以通过间隙连接相互连通,这些通道允许转移营养素和调节因子。凋亡是由 Caspases介导的,Caspases是半胱氨酸蛋白酶家族的一种,通常以不活跃的酶原的形式存在于健康细胞中,但当受到刺激时,它们会经历自溶裂解而变得完全活跃,这可能导致底物的活化、失活、重新定位或重构。因此,许多裂解片段在凋亡过程中保持完整,可以使用基质特异性抗体检测[17]。Caspase在细胞凋亡过程中负责大部分的蛋白水解,所以检测裂解的 Cleaved Caspase-3被认为是细胞死亡或凋亡死亡的可靠标记[18]。本研究中5 mg/mL CLC处理组Cleaved Caspase-3蛋白表达量显著降低,但与10 mg/mL CLC处理组差异不显著,需要更进一步深入研究。Cleaved Caspase-3蛋白表达量越低说明对卵母细胞凋亡损伤越小。
在卵母细胞成熟过程中,细胞质细胞器经历了各种重塑和再分配过程。在玻璃化冷冻中,细胞器的皮质颗粒受到严重影响,这可能会损害受精并损害胚胎发育。ZP是围绕哺乳动物卵母细胞和植入前胚胎的抗遗传和生化复合物糖蛋白网状结构[19]。在受精过程中精子必须首先粘附在ZP表面并在它们到达卵子的质膜之前穿透ZP[20]。冷冻可诱导卵母细胞ZP硬化[21]。在冷冻保存期间,皮质颗粒被释放到细胞质中,卵母细胞可能会被人工激活[22],并且在实际受精之前卵母细胞的内容物会融入透明带层,从而诱导ZP硬化。本研究中,在冷冻保护剂中添加浓度为 5 mg/mL的CLC时ZP的硬化时间最短。可见在冷冻液中添加适宜浓度的 CLC 降低卵母细胞ZP硬化时间,可防止多精入卵的情况发生。
4 结 论
本研究结果表明,在玻璃化冷冻保护剂中添加5 mg/mL CLC可以提高冻融后卵母细胞成熟率,降低体外成熟培养后卵母细胞Cleaved Caspase-3凋亡蛋白的表达量,减少透明带硬化时间,提高精-卵结合能力。可见,CLC缓解了猪卵母细胞在冷冻解冻过程中由低温造成的冷冻损伤,提高了卵母细胞冻融后体外成熟培养水平,为猪卵母细胞的冷冻保存及体外培养发育提供了理论依据。然而,对于猪卵母细胞的冷冻保存技术还需要更进一步研究和提高。
——以1985—2020年为例

