矾根“草莓漩涡”对高温胁迫的生长及生理响应
陈丽花,王朝英,3,谢英赞,马立辉,刘 杨
(1.重庆城市管理职业学院,重庆 401331;2.重庆市林业科学研究院,重庆 400036;3.重庆山地型城市森林生态系统(国家)定位观测研究站,重庆 400036)
矾根“草莓漩涡”(Heucheramicrantha“Strawberry Swirl”)是虎耳草科(Saxifragaceae)矾根属(Heuchera)多年生草本地被观赏植物,具有花期早、花量大、颜色异(浅粉橙色),叶色鲜亮、叶片美感度高(褶皱的绿叶上被有银灰色斑纹)等特点,极具观赏价值。近年来,随着园林建设新风向花境建设的兴起,矾根的应用规模、应用范围不断扩大,各地对矾根的引种栽培和应用逐年扩大。作为矾根植物中优秀观赏植物的一种,草莓漩涡自2015年春季由重庆城市管理职业学院工程管理学院和重庆市林业科学研究院分别引入重庆。
重庆地处我国西南,位于长江中上游,属典型的亚热带季风气候区,夏季气温不断升高,
极易形成高温天气,居我国传统的“四大火炉”城市之首。草莓漩涡引进重庆后势必难以避开夏季高温天气的侵扰。温度是影响植物种子萌发、幼苗生长、形态建成以及生殖、扩散等的重要环境因子。大量的研究结果表明,高温环境下植物的生殖、生长均受到不同程度的不利影响。例如:高温环境胁迫下,芹菜种子发芽能力显著降低,高温对芹菜幼苗的根系生长和生长量积累具有明显的抑制作用[1]。高温胁迫不仅导致小麦、黑麦草和芍药的生长减缓[2~4],还会造成酸枣、灰枣和棉花叶片叶绿素含量降低,净光合速率、蒸腾速率等光合生理指标下降[5~6]。高温还会造成植物过氧化物水平升高,细胞膜稳定性遭到破坏,膜脂过氧化程度加剧[7]。进一步致使膜系统和抗氧化酶系统遭到破坏,植物受到严重热害,直至枯萎、死亡[8,9]。高温胁迫严重威胁着植物的生长、生存,长期的进化和自我保护使得植物在应对高温胁迫不利环境条件时形成一系列的生理生化反应以应对一定程度的高温伤害。番茄随着高温胁迫时间的延长,其叶片中的抗氧化酶活性、渗透物质和膜质过氧化物质含量呈现出先上升后下降的趋势[10]。在21个山茶种质和金花茶的研究中发现,高温胁迫环境条件下这些植物叶片的相对电导率、渗透物质含量和抗氧化酶活性表现出随胁迫时间的延长不断提升的趋势[11,12]。高山杜鹃叶片SOD、CAT和POD的活性随温度的升高而升高,同一温度下SOD、CAT和POD的活性随时间推移呈先升高后降低的趋势[13]。因此,了解植物的高温耐受能力高低是重庆市植物品种引进和应用的关键步骤之一。本文拟通过对引进的矾根“草莓漩涡”的高温生长和生理响应研究,了解草莓漩涡对高温环境条件的耐受状况,为草莓漩涡在重庆地区的科学应用提供理论指导。
1 材料和方法
1.1 材料
实验材料为矾根“草莓漩涡”炼苗后3个月的组培苗。
1.2 方法
1.2.1实验设计
2018年春季(3月5日),选择植株健壮、长势好、大小均匀的矾根“草莓漩涡”炼苗后3个月的组培苗120株,分别移栽至内径22 cm、高度20 cm的塑料花盆内,浇透水后养护1个月,之后置于温度夜间/白天为(18±3)℃/(28±3)℃、空气湿度为(70±5)%的人工温室中继续培养,保持草莓漩涡根际土壤含水量在(20±5)%。2018年4月,将60盆草莓漩涡移至温室外,置于自然环境中,搭2 m高透明塑料遮雨棚遮雨,土壤湿度与温室内草莓漩涡盆栽保持一致。将60盆草莓漩涡按照10盆1组分成6组(5盆用于生理指标测定取样,5盆用于生长指标测定)。分别于2018年7月15日、18日、23日、28日以及8月3日、7日由其中1组生理指标取样株每株各自采取叶片2~3片用于生理指标的测定,生长指标测定株每株量取株高、冠幅后仔细挖出,清洗干净后用于鲜重、干重的测定。试验期间试验地气温走势见图1。
1.2.2指标测试方法

图1 处理期间试验场地气温走势
1.2.3数据处理与分析
数据分析使用SPSS19.0版进行单因素方差分析,并用Duncan′s多重比较法检验每个指标(α=0.05)的差异显著性。图表使用Microsoft Office Excel 2003,根据SPSS分析结果制作。
2 结果与分析
2.1 高温胁迫对矾根“草莓漩涡”生长指标的影响
2.1.1高温胁迫对草莓漩涡株高生长的影响
不同处理下矾根“草莓漩涡”株高变化见表1。

表1 不同处理下矾根“草莓漩涡”株高变化
注:同列不同小写字母表示二者间差异显著,即P<0.05;同列字母相同而大小写不同表示二者间差异极显著,即P<0.01(下同)。
通过表1数据可以看到,2种处理方式下草莓漩涡在株高生长上发生了较大程度的差异。对照处理条件下(CK组),草莓漩涡平均株高在24 d内由14.51 cm增长至22.60 cm,增长为试验初始时的155.8%;高温处理条件下(HT组),草莓漩涡平均株高在经过24 d的生长期后,平均株高仅17.17 cm,较试验初始时增长率仅为118.1%。数据分析结果显示,试验开始14 d以后,CK组的草莓漩涡平均株高极显著高于HT组,表明高温胁迫对草莓漩涡的株高生长具有一定的影响,且这种影响随着高温环境条件的不断持续会表现出对草莓漩涡株高生长抑制程度不断加剧的趋势。
2.1.2高温胁迫对草莓漩涡冠高生长的影响
不同处理下矾根“草莓漩涡”冠幅变化见表2。
根据表2数据可以看到,高温环境条件下不利于草莓漩涡冠幅的正常生长。数据测定结果显示,试验初始时CK组和HT组草莓漩涡在冠幅上基本一致,二者间没有显著性差异。随着试验时间的推进,两组草莓漩涡冠幅间的差距逐渐扩大,至试验后第9天开始,二者间差异达到极显著差异水平,此时HT组草莓漩涡冠幅约为CK组的78.62%,至试验结束时,HT组草莓漩涡冠幅仅为CK组的39.69%。
2.1.3高温胁迫对草莓漩涡生物量积累的影响
不同处理下矾根“草莓漩涡”生物量积累(鲜重、干重增长)变化见表3。
根据表3中数据可以明显看出,高温环境胁迫条件下矾根“草莓漩涡”在生物量积累(鲜重、干重增长)上受到较大程度的抑制。鲜重增长方面,在高温处理第3天时HT处理组即显著低于CK处理组。随着处理时间的推移,HT组草莓漩涡鲜重增长较CK组差距不断扩大,至第8天、13天、18天、23天时,HT组草莓漩涡鲜重分别为CK组的92.29%、73.36%、59.08%和51.88%。CK组草莓漩涡鲜重在整个试验周期内增加至试验初始时的2.33倍,而HT组草莓漩涡鲜重在整个试验周期内仅增加至试验初始时的1.21倍。干重增长上,草莓漩涡呈现出与鲜重大致相似的变化趋势,但差异变化较鲜重变化相对推迟。在高温处理后第8天时草莓漩涡干重开始显著低于CK组,此时HT组干重为CK组的89.22%。随着试验时间的延长,至第13天、18天、23天时,HT组草莓漩涡干重分别为CK组的74.43%、63.64%和47.30%。CK组草莓漩涡干重在整个试验周期内增加至试验初始时的2.55倍,而HT组草莓漩涡干重在整个试验周期内仅增加至试验初始时的1.22倍。综合比较可知,高温胁迫会导致矾根“草莓漩涡”生物量积累效率降低,整体上高温对草莓漩涡干重积累的影响程度大于鲜重积累。
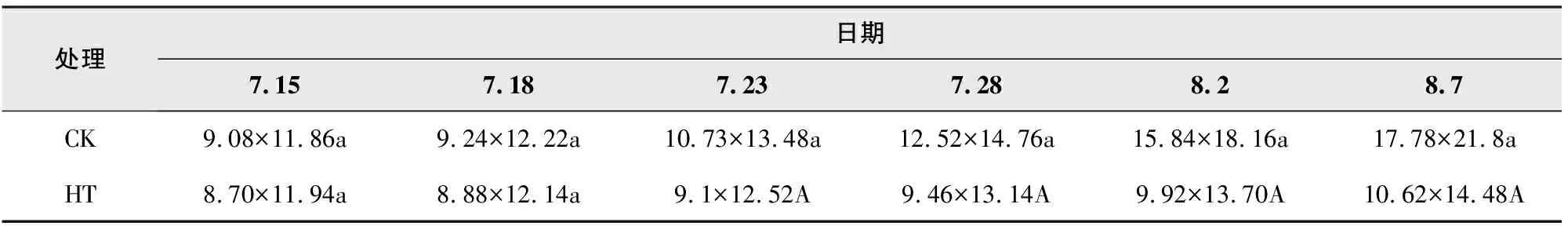
表2 不同处理下矾根“草莓漩涡”冠幅变化
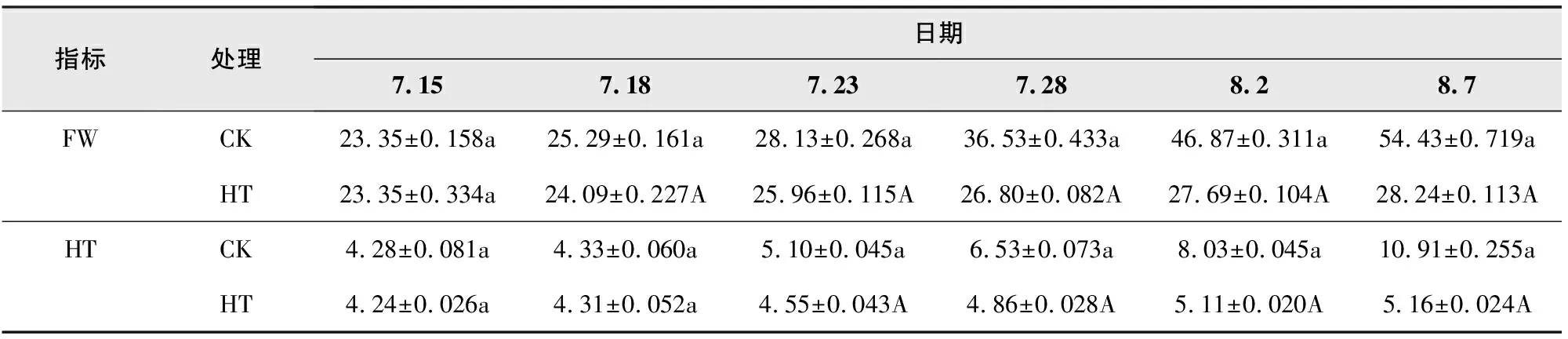
表3 不同处理下矾根“草莓漩涡”生物量积累变化
2.2 高温胁迫对矾根“草莓漩涡”渗透调节物质含量的影响
2.2.1高温胁迫对草莓漩涡可溶性糖含量的影响
不同处理下矾根“草莓漩涡”可溶性糖含量见图2。

图2 不同处理下矾根“草莓漩涡”可溶性糖含量
如图2所示,高温环境下矾根“草莓漩涡”叶片可溶性糖含量与CK组相比发生了较大程度的波动。整个试验周期内,CK组草莓漩涡叶片可溶性糖含量呈现出基本稳定缓慢增长的趋势,而HT组草莓漩涡叶片可溶性糖含量则呈现出先快速增高后逐步降低的趋势。与CK组相比,试验开始后第3天时,HT组草莓漩涡叶片可溶性糖含量升高至(33.39±0.439)mg/g·FW,与CK组相比差异达到极显著水平,为CK组的1.28倍。至试验开始后第8天时,HT组草莓漩涡叶片可溶性糖含量升高至本次试验最高值,为(42.63±0.350)mg/g·FW,为CK组的1.60倍。之后HT组草莓漩涡叶片可溶性糖含量逐步降低,至试验开始后第18天时降低至(27.32±0.424)mg/g·FW,与CK组(处于基本持平水平)二者间差异不显著。至试验开始后第23天时,HT组草莓漩涡叶片可溶性糖含量极显著低于CK组,此时HT组草莓漩涡叶片可溶性糖含量降低为CK组的75.78%。
2.2.2高温胁迫对草莓漩涡可溶性蛋白含量的影响
不同处理下矾根“草莓漩涡”可溶性蛋白含量见图3。
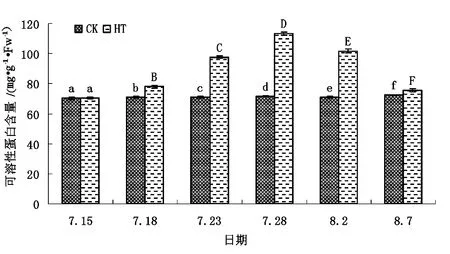
图3 不同处理下矾根“草莓漩涡”可溶性蛋白含量
据图3可以明显看出,高温胁迫环境条件对矾根“草莓漩涡”叶片可溶性蛋白含量具有较大程度的影响,整体上随高温环境条件时间的不断延长,草莓漩涡叶片可溶性蛋白含量呈现出先逐步升高后逐步降低的趋势。适宜的生长环境下(CK组),草莓漩涡叶片可溶性蛋白含量基本保持稳定,而高温处理第3天时(HT组)草莓漩涡叶片可溶性蛋白含量已达(77.87±0.829)mg/g·FW,极显著高于CK组的(71.00±0.373)mg/g·FW。高温处理第8天、第13天时草莓漩涡叶片可溶性蛋白含量持续增高,分别达到(97.78±0.875)mg/g·FW和(113.31±0.937)mg/g·FW,为CK组的1.38倍和1.58倍。之后HT组草莓漩涡叶片可溶性蛋白含量逐步降低,至试验结束时虽仍显著高于CK组,但整体上差距极小,仅为CK组的1.05倍。数据分析结果表明,矾根“草莓漩涡”能够通过调节自身渗透物质可溶性蛋白含量来响应高温环境胁迫,应对高温环境。
2.3 高温胁迫对矾根“草莓漩涡”过氧化物含量的影响
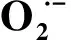
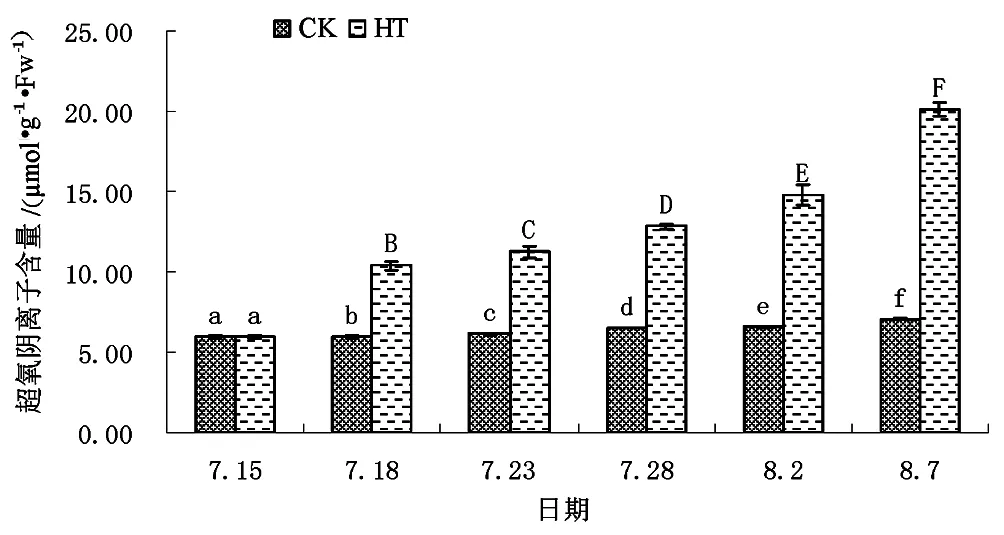
图4 不同处理下矾根“草莓漩涡”超氧阴离子含量 content of H.micrantha ‘Strawberry Swirl’ with different treatment
2.3.2高温胁迫对草莓漩涡H2O2含量的影响
不同处理下矾根“草莓漩涡”H2O2含量见图5。
根据图5可知,适宜的生长条件下(CK组)矾根“草莓漩涡”叶片H2O2含量会随生长期的不断延长呈现出基本保持稳定,长期略有升高的趋势。试验初始至试验结束时,CK组草莓漩涡叶片H2O2含量自(5.71±0.046)μmol/g·FW增高至(6.48±0.110)μmol/g·FW,整体上增高了1.13倍。高温环境条件会导致草莓漩涡叶片H2O2含量迅速增高,并表现出随高温时间的延长而不断加速积累的现象。试验伊始,HT组草莓漩涡叶片H2O2含量为(5.71±0.058)μmol/g·FW,至试验开始后第3天始HT组草莓漩涡叶片H2O2含量即极显著高于CK组,试验开始后第3天、第8天、第13天、第18天和第23天时HT组草莓漩涡叶片H2O2含量分别为(8.85±0.124)μmol/g·FW、(9.15±0.121)μmol/g·FW、(9.61±0.102)μmol/g·FW、(11.01±0.248)μmol/g·FW和(12.51±0.286)μmol/g·FW,分别为CK组的1.52、1.56、1.59、1.75和1.93倍。整体上,随高温时间的延长草莓漩涡叶片H2O2含量的积累速率不断提高。
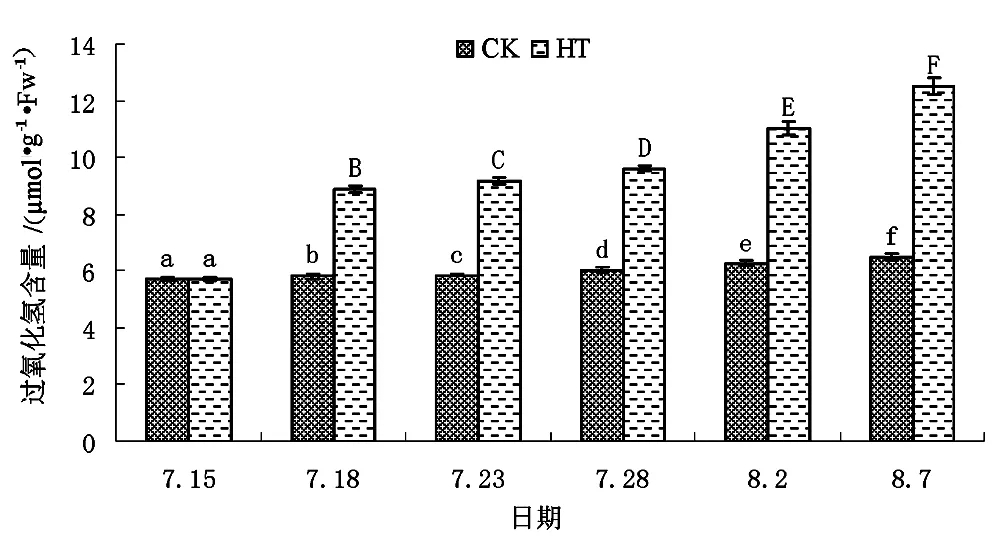
图5 不同处理下矾根“草莓漩涡”过氧化氢含量
2.3.3高温胁迫对草莓漩涡MDA含量的影响
不同处理下矾根“草莓漩涡”MDA含量见图6。
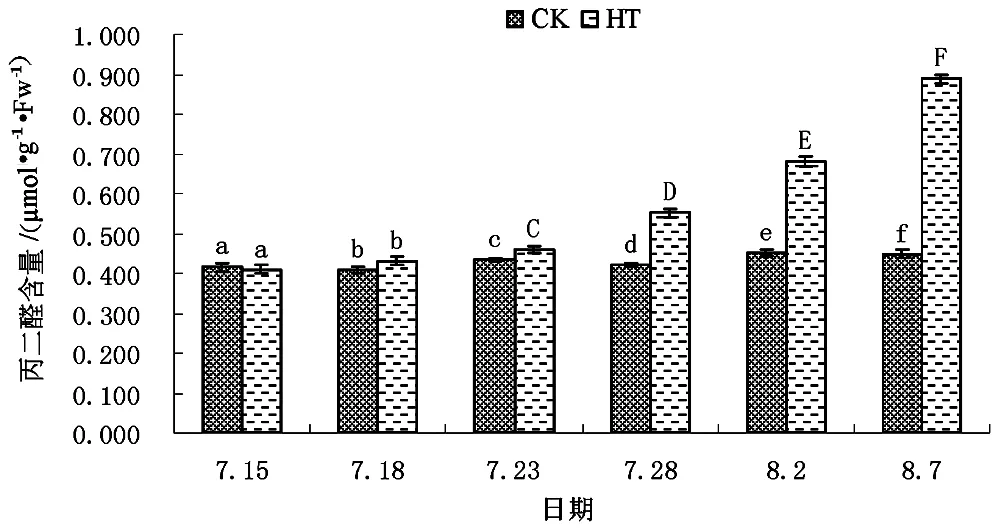
图6 不同处理下矾根“草莓漩涡”MDA含量
如图6所示,适宜的生长条件下矾根“草莓漩涡”在生长进程中叶片MDA含量基本处于相对稳定,长期略有波动升高的状态。试验期间,CK组草莓漩涡叶片MDA含量自试验开始时的(0.415±0.010)μmol/g·FW波动增高至试验结束时的(0.448±0.010)μmol/g·FW,整个试验期间CK组草莓漩涡叶片MDA含量最高值(0.453±0.009)μmol/g·FW出现在试验开始后第18天,最低值(0.408±0.009)μmol/g·FW出现在试验开始后第3天。高温胁迫下(HT组)草莓漩涡叶片MDA含量变化趋势与CK组相比完全不同。HT组草莓漩涡MDA含量在整个试验周期内表现出线性增长趋势。试验初始,HT组草莓漩涡叶片MDA含量仅(0.410±0.011)μmol/g·FW,与CK组无明显差异。至试验开始后第8天,HT组草莓漩涡叶片MDA含量开始极显著高于CK组,且随试验时间的延长差距不断扩大。至试验结束时,HT组草莓漩涡MDA含量达(0.888±0.010)μmol/g·FW,为CK组的1.98倍。
2.4 高温胁迫对矾根“草莓漩涡”抗氧化酶活性的影响
2.4.1高温胁迫对草莓漩涡SOD活性的影响
不同处理下的矾根“草莓漩涡”SOD活性见图7。
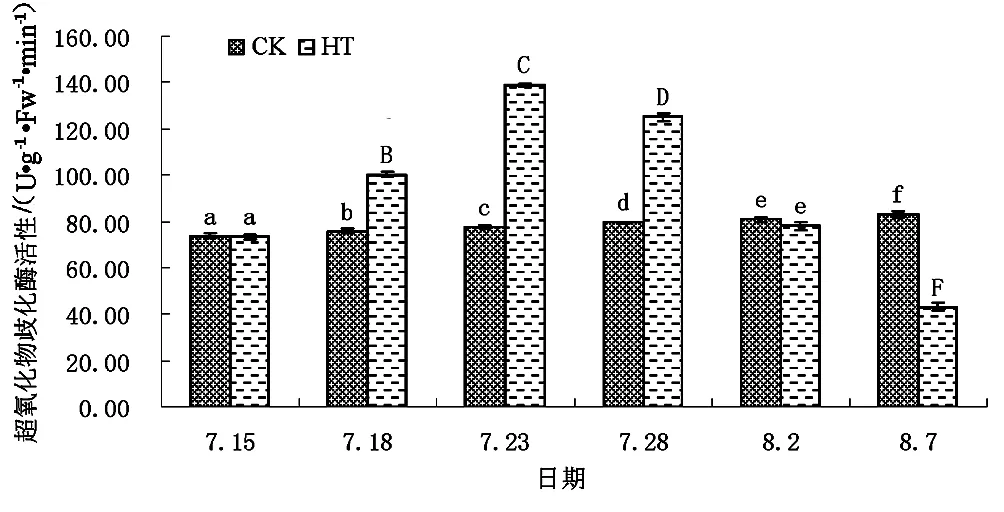
图7 不同处理下矾根“草莓漩涡”SOD活性
根据图7可以明显看出,正常环境条件下矾根“草莓漩涡”叶片SOD活性长期保持基本稳定状态,而高温环境下草莓漩涡叶片SOD活性则出现一定程度的波动变化。整体上,HT组草莓漩涡叶片SOD活性表现出先逐步增高,后渐渐降低的趋势。数据分析结果显示,试验开始后第3天时,HT组草莓漩涡叶片SOD活性开始极显著高于CK组,并于试验开始后第8天达到最大值。之后HT组草莓漩涡叶片SOD活性逐渐降低,至试验开始后第18天时将至与CK组无显著性差异水平,第23天时极显著低于CK组。
2.4.2高温胁迫对草莓漩涡POD活性的影响
不同处理下矾根“草莓漩涡”POD活性见图8。
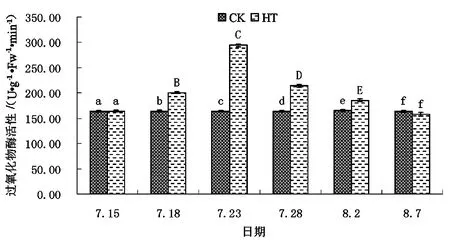
图8 不同处理下矾根“草莓漩涡”POD活性
如图8所示,适宜环境条件下矾根“草莓漩涡”叶片POD活性随时间的延长表现出基本稳定、缓慢升高的趋势,而高温胁迫下草莓漩涡POD叶片活性则表现出随胁迫时间的延长先增高后逐步降低的趋势。试验开始时,CK组草莓漩涡叶片POD活性为(163.44±1.25)U/g·FW·min,HT组草莓漩涡POD叶片活性为(164.11±1.96)U/g·FW·min,二者间无显著差异。随着试验的继续,至第3天时,HT组草莓漩涡叶片POD活性升高至(200.77±1.67)U/g·FW·min,为CK组的1.22倍,极显著高于CK组。试验开始后第8天时,HT组草莓漩涡POD叶片活性达到本次试验期间最高值,为(294.16±3.12)U/g·FW·min,是同时期CK组的1.79倍。之后HT组草莓漩涡叶片POD活性开始逐步下降,至试验结束时降低至与同时期CK组无显著性差异水平。试验和数据分析结果表明,POD是矾根“草莓漩涡”抗击高温环境胁迫,调节自身氧化物质平衡的重要酶之一,能够在较长的时间内发挥作用。
2.4.3高温胁迫对草莓漩涡CAT活性的影响
不同处理下矾根“草莓漩涡”POD活性见图9。
如图9所示,CK组处理下矾根“草莓漩涡”叶片CAT活性相对较为稳定,长期波动不大,自试验开始至试验结束仅增加了102.95%。HT组处理下草莓漩涡叶片CAT活性则表现出较大幅度的变化,整体上在试验周期内展现出先快速增高,后持续降低的趋势。试验开始后第3天时,HT组草莓漩涡叶片CAT活性达(109.43±1.493)U/g·FW·min,为CK组的1.20倍,极显著高于CK组。之后HT组草莓漩涡叶片CAT活性不断降低,自第18天时始极显著低于同时期CK组,至试验结束时,HT组草莓漩涡叶片CAT活性仅(57.79±1.114)U/g·FW·min,为同时期CK组的62.17%。
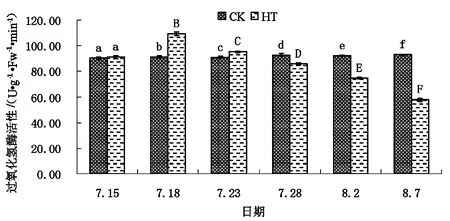
图9 不同处理下矾根“草莓漩涡”CAT活性
3 讨论
3.1 高温胁迫对矾根“草莓漩涡”生长的影响
高温是限制植物正常生长发育的重要逆境因子之一,高温环境胁迫往往导致植物植株矮小、植物生物量积累下降[20,21]。高温胁迫初期,植株往往出现叶片气孔大量关闭、植株光合和呼吸作用降低等反应。随着高温胁迫时间的延长,植株叶片保卫细胞受损、叶绿体解体等不可逆损伤,最终导致植株光合效率持续走低,植株生产力下降等[22~24]。本试验测定结果与前人的研究结果类似,高温胁迫下矾根“草莓漩涡”在株高生长、冠幅生长和鲜重、干重增加方面也均表现出受到较大程度的抑制作用,这是因为矾根“草莓漩涡”在高温环境条件下植株器官受损、细胞功能结构被破坏、功能降低等导致的植株光合效率降低所致。此外,由于夜间较高的温度,草莓漩涡夜间呼吸效率相对提高,自身消耗相对增大,反应在植株上势必造成植株生物量积累的能力降低。
3.2 高温胁迫对矾根“草莓漩涡”渗透调节物质含量的影响
渗透物质是调节植物细胞内压、维持植株生理环境稳定的重要物质,在植株应对逆境环境中发挥着重要作用。大量研究结果表明,植株在应对高温环境的胁迫压力时,为躲避伤害,调节自身渗透物质含量是较为及时和有效的方法[25~27]。高温胁迫能够诱导植株功能基因的表达量和表达效率,促进可溶性糖和可溶性蛋白的快速积累,提高细胞膨压、减少水分逸散、稳定细胞内环境[28]。本研究中,高温环境初期矾根“草莓漩涡”可溶性糖和可溶性蛋白含量均出现快速升高的现象,表明矾根“草莓漩涡”也是首先通过调节自身渗透物质含量的方法来改善因环境胁迫压力造成的植株细胞内环境的不利变化,保障植株在适应突发环境变化中的存活概率。
3.3 高温胁迫对矾根“草莓漩涡”过氧化物含量的影响
3.4 高温胁迫对矾根“草莓漩涡”抗氧化酶活性的影响
应对高温等不利环境胁迫的威胁,启动植株抗氧化酶系统,解决因环境胁迫压力带来的细胞内环境持续恶化,清除氧化自由基尤为重要。植株抗氧化酶系统功能的发挥效率决定着植株应对不利环境条件的抗性强弱。邓茳明等通过对不同耐高温品系棉花的研究结果显示,SOD、POD、CAT活性的强弱决定着棉花品系的高温耐受能力[34],王文举研究结果证明,外源物质添加能够通过提高葡萄CAT、APX和SOD酶活性来改善葡萄的耐热能力[35],李大红等发现不同品种羽衣甘蓝的高温耐受能力强弱与其SOD、POD同工酶的关系密切[36]。本研究发现,高温下矾根“草莓漩涡”SOD、POD和CAT活性增高明显,且在较长时间范围内能够持续保持较高水平。因此,矾根“草莓漩涡”能够长期在高温胁迫环境下存活,主要是因为高温条件下草莓漩涡植株SOD、POD和CAT活性的增强所致,SOD、POD和CAT活性的增强提高了草莓漩涡对长期高温环境胁迫的耐受能力。

