2型糖尿病患者单核细胞亚群CD36水平与Lp-PLA2表达的研究
孙明忠,居会祥,陈红梅,周中卫,季禹乔,江冬梅 (东南大学医学院附属盐城医院,.检验科,.内分泌科,江苏盐城 224001)
2型糖尿病(type 2 diabetes mellitus,T2DM)患者病理变化为胰岛素抵抗伴代谢紊乱,导致血管内皮细胞损伤,进而形成动脉粥样硬化(Atherosclerosis,As)[1]。在此过程中,单核细胞通过细胞表面清道夫受体CD36摄取氧化型低密度脂蛋白(oxidized LDL,oxLDL)[2],促进单核细胞分泌脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2, Lp-PLA2)[3],水解低密度脂蛋白上的氧化卵磷脂,生成氧化游离脂肪酸和溶血卵磷脂,参与As形成[4]。单核细胞基于CD14和CD16表达分为经典型CD14++CD16-、中间型CD14++CD16+和非经典型CD14+CD16++,3个亚群在T2DM疾病过程中具有不同的功能[5]。本课题组前期研究表明,T2DM患者单核细胞向中间型和非经典型极化,且高表达Lp-PLA2[6]。但CD36在3个亚群表达及其促进Lp-PLA2分泌功能的差异缺乏研究。本研究分析T2DM患者外周血单核细胞3个亚群CD36表达,并检测其活化后细胞分泌Lp-PLA2的功能,从而探讨其在T2DM疾病过程中促进As的机制。
1 材料和方法
1.1研究对象 选择2018年1—11月在盐城市第三人民医院就诊的T2DM患者50例,根据是否合并颈动脉病变分为单纯糖尿病组(n=26)和合并颈动脉病变组(n=24)。其中,男性26例,女性24例,年龄(45.6±7.9)岁,T2DM符合《中国2型糖尿病防治指南(2010版)》诊断标准。排除标准:合并各种急慢性感染、自身免疫病、血液系统疾病、恶性肿瘤、外伤患者。同时选择年龄、性别相匹配的健康人26例作为健康人对照组(HC组),其中,男性14例,女性12例,年龄(44.5±8.2)岁。本研究经研究对象书面同意和医院伦理委员会批准(批准文号:伦研2017-04)。颈总As采用超声诊断仪检测,探头频率7.5 MHz,测量颈动脉分叉部动脉中膜厚度,两侧各2个点,取均值。动脉中膜厚度>0.9 mm或颈动脉斑块形成诊断为As病变。
1.2试剂和仪器 藻红蛋白-鼠抗人CD36单克隆抗体(monoclonal antibodies,mAb)、叶绿素蛋白-cy5.5鼠抗人CD16 mAb和异硫氰酸荧光素-鼠抗人CD14 mAb(BD Biosciences公司),DiI荧光探针标记的氧化型LDL(DiI-ox-LDL)和oxLDL(美国Biomed Tech公司),CD36 阻断性抗体(Abcam公司)。7700生化分析仪及其配套血糖、血脂试剂(Beckman公司),Ficoll-Hypaque密度梯度试剂(上海西糖生物公司),Aria Ⅱ流式细胞分析仪(美国BD公司),化学发光法仪及配套Lp-PLA2试剂(诺尔曼公司)。
1.3标本采集与处理 研究对象清晨空腹采集静脉血10 mL,肝素钠抗凝,其中2 mL经离心收集血浆,检测空腹血浆葡萄糖(FBG)、血脂(包括Lp-PLA2)等生化指标,1 mL用于流式细胞术检测单核细胞亚群CD36平均荧光强度(MFI),另外7 mL用于分选单核细胞亚群。
1.4单核细胞亚群CD36表达水平检测 在100 μL肝素钠抗凝静脉血中加入10 μL 藻红蛋白-鼠抗人CD36、10 μL 异硫氰酸荧光素-鼠抗人CD14和叶绿素蛋白-cy5.5鼠抗人CD16,避光温育20 min,然后与500 μL红细胞裂解液混匀温育10 min,用磷酸盐缓冲液洗涤并重悬,终体积400 μL。流式细胞分析仪先选取单核细胞,根据其表面CD14和CD16,分为CD14++CD16-、CD14++CD16+和CD14+CD16++亚群,然后检测各亚群细胞表面CD36 MFI,作为CD36表达水平。
1.5单核细胞亚群分选培养及诱导的巨噬细胞DiI-oxLDL摄取测定 采用Ficoll-Hypaque密度梯度离心法分离7 mL外周血中的单个核细胞,然后在RPMI1640完全培养基中贴壁培养4 h,去除不贴壁细胞,然后继续培养2 h,收集单核细胞,用异硫氰酸荧光素-鼠抗人CD14和叶绿素蛋白-cy5.5鼠抗人CD16 mAb进行细胞染色,随后流式细胞仪基于细胞CD14和CD16表达分选收集3个单核细胞亚群,浓度为1×104/L,细胞用含有10%胎牛血清的RPMI-1640完全培养基在5%CO2、37 ℃条件下培养。分选的单核亚群细胞(1×104/mL)经160 nmol/L佛波酯诱导48 h后,单核细胞分化为巨噬细胞。去除培养上清液,加入不含有胎牛血清的RPMI 1640培养液饥饿培养12 h,随后加入30 μg/mL DiI-oxLDL,继续培养24 h,然后用流式细胞仪检测DiI MFI。DiI是一种亲脂性荧光染料,进入细胞膜后被激发后可发出橙红色荧光。
1.6单核细胞亚群诱导的巨噬细胞分泌Lp-PLA2测定 上述分选的单核细胞亚群诱导形成的巨噬细胞,不含有胎牛血清的RPMI 1640培养液饥饿培养12 h,然后上清液中加入10 μg/mL CD36阻断性抗体,37 ℃温育1 h,弃上清液,分2组,一组为空白对照组,另一组加入100 μg/mL ox-LDL,继续培养24 h,然后收集上清液,用荧光素增强免疫化学发光法检测Lp-PLA2浓度。
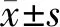
2 结果
2.1流式细胞术检测单核细胞亚群CD36表达水平 与HC组相比,T2DM患者中间型单核细胞CD36表达水平上升,差异有统计学意义(P<0.05),经典型和非经典型单核细胞CD36表达水平差异均无统计学意义(P均>0.05),结果见表1。
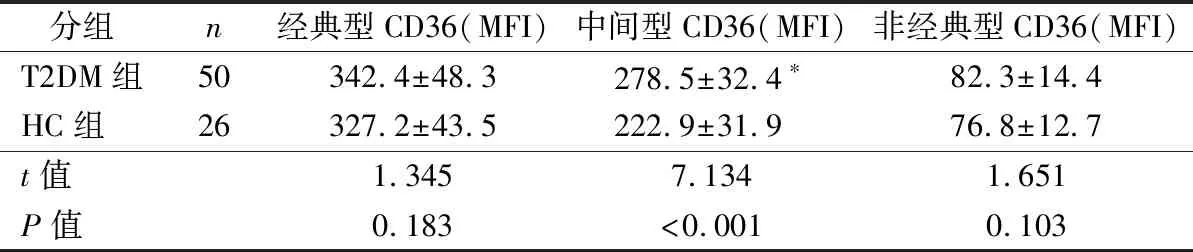
表1 T2DM患者单核细胞亚群表面CD36表达水平比较
注:*, T2DM组vs HC组,P<0.05。
2.2T2DM合并颈动脉病变患者单核细胞CD36表达水平比较 与单纯糖尿病组相比,合并颈动脉病变组中间型单核细胞CD36表达水平上升,差异有统计学意义(P<0.05);经典型和非经典型单核细胞CD36表达水平差异均无统计学意义(P均>0.05),结果见表2。

表2 T2DM合并颈动脉病变单核细胞亚群CD36表达水平比较
注:*,单纯糖尿病组vs T2DM合并颈动脉病变组,P<0.05。
2.3单核细胞亚群体外诱导的巨噬细胞摄取DiI-ox-LDL比较 与HC组相比,T2DM组中间型单核细胞诱导的巨噬细胞摄取DiI-ox-LDL升高(n=25,等距随机抽样),差异有统计学意义(P<0.05);经典型和非经典型单核细胞诱导的巨噬细胞摄取DiI-ox-LDL差异无统计学意义(P>0.05),结果见表3。
表3 单核细胞亚群体外摄取DiI-ox-LDL(MFI)比较
注:*,HC组vs T2DM组,P<0.05。
2.4T2DM患者单核细胞CD36表达水平及分泌Lp-PLA2与血清Lp-PLA2相关性分析 T2DM患者组中间型单核细胞CD36表达水平(r=0.416,P=0.003)及其诱导的巨噬细胞(n=25,等距随机抽样)分泌Lp-PLA2(r=0.497,P=0.001)与血清Lp-PLA2浓度呈正相关,见图1。非经典型和中间型单核细胞CD36表达水平及其诱导的巨噬细胞分泌Lp-PLA2与血清Lp-PLA2浓度无相关性(P>0.05)。
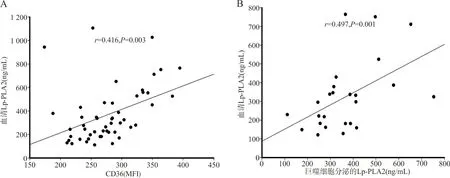
注:A,中间型单核细胞CD36与血清Lp-PLA2相关性;B,上清液Lp-PLA2与血清Lp-PLA2相关性。
2.5阻断T2DM患者单核细胞CD36抑制细胞分泌Lp-PLA2 T2DM患者(n=25,等距随机抽样)单核细胞亚群经CD36抗体阻断,经典型单核细胞、中间型单核细胞和非经典单核细胞分泌Lp-PLA2浓度均下降,差异均有统计学意义(P<0.05),结果见表4。
表4CD36抗体阻断对T2DM患者单核细胞分泌Lp-PLA2(ng/mL)影响比较
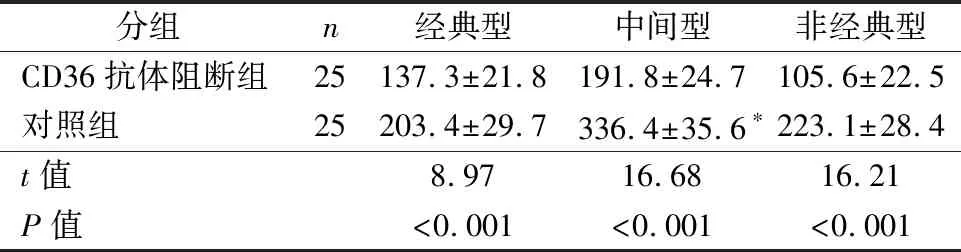
分组n经典型中间型非经典型CD36抗体阻断组25137.3±21.8191.8±24.7105.6±22.5对照组25203.4±29.7336.4±35.6∗223.1±28.4t值8.9716.6816.21P值<0.001<0.001<0.001
注:*,HC组vs T2DM组,P<0.05。
3 讨论
在T2DM患者As形成过程中,单核细胞在趋化因子的作用下向内皮下募集,分化成巨噬细胞,并通过清道夫受体CD36摄取oxLDL,引发炎症信号级联反应,诱导巨噬细胞向M1致炎型极化,促进泡沫细胞形成,参与As的形成,CD36缺陷可减少As的形成[7-8]。
本研究证实,与健康对照者相比,T2DM患者中间型单核细胞CD36表达升高,伴发颈As病变的T2DM患者中间型单核细胞CD36升高尤为显著。Lopez-Carmona等[9]检测未分群单核细胞,证实T2DM患者单核细胞CD36表达增加。血浆中循环CD36形式的水平与颈动脉内膜中层厚度(IMT)、胰岛素抵抗和As斑块不稳定有关[10]。
本研究还发现,与健康对照组相比,中间型单核细胞分化的巨噬细胞摄取oxLDL增加。Xu等[11]证实单核细胞摄取脂质,产生泡沫单核细胞表型并迁移到新生的As斑块中。较早研究将单核分为2群,与CD14++CD16-细胞相比,CD14++CD16+细胞通过CD36摄取较多的oxLDL,更容易形成泡沫细胞[12-13]。
CD36还参与细胞内信号转导活化磷脂酶A2[14-15],人单核THP-1细胞CD36通过摄取oxLDL上调Lp-PLA2的表达,Lp-PLA2正反馈促进巨噬细胞中的脂蛋白摄取[3]。本研究表明,T2DM患者中间型单核细胞CD36表达水平和血清Lp-PLA2浓度呈正相关,阻断CD36抗体可降低各亚群分泌的Lp-PLA2。
综上所述,T2DM尤其伴As患者中间型单核细胞高表达CD36,摄取较多的ox-LDL,对Lp-PLA2合成有促进作用,阻断CD36可抑制单核细胞分泌Lp-PLA2。因此,通过抑制T2DM患者中间型单核细胞及其CD36表达可能抑制T2DM患者As的形成。但中间型单核细胞CD36表达低于经典型,摄取ox-LDL的能力及分泌Lp-PLA2的能力要高于经典型,具体机制不明,需进一步研究。

