高纯硫酸锰中的杂质特性及净化工艺研究
赵云浩,吴睿林,胡 平,蒋 赟,蒋逸伦
(1.贵州能矿锰业集团有限公司,贵州 铜仁 554300;2.贵州省电池用锰材料工程技术研究中心,贵州 铜仁 554300)
以高纯硫酸锰作为正极材料之一的锂电池,是新一代高性能、绿色环保的新能源电池,硫酸锰纯度直接影响电池使用性能。由于原材料中的钾、钠、钙、镁等杂质对锂电池的高温形貌及循环性能有重要影响。
其中钾钠杂质的原子半径及性质与锂离子比较接近,容易阻碍锂离子的迁移,使电池放电过程难以进行,直接影响电池容量及循环性能[1]。对于高纯硫酸锰的制备生产技术,在国内目前已经工业化、产业化,由于矿石中的钙镁等重金属使用现有的方法去除难以达到期望的效果或生产中产生的废弃物对环境有较大的污染,因而,研究高纯硫酸锰生产过程中产生的杂质特性,开发新技术,是有效改变这一现状的途径之一[2]。
1 高纯硫酸锰生产工艺介绍
硫酸锰生产方式大致有两类:菱锰矿法以及软锰矿法,其中软锰矿法根据浸出工艺的不同又分为:两矿焙烧法、二氧化硫法、焙烧-酸浸法、硫酸亚铁法、两矿加酸法、硫酸还原浸出法等。
高纯硫酸锰为纯净度更高的硫酸锰,其生产方式主要有:①以工业级硫酸锰进一步净化除杂再浓缩得到高纯硫酸锰;②使用两矿法酸浸(软锰矿与硫铁矿)得到硫酸锰溶液,再净化除杂,浓缩蒸发结晶得到产品;③使用软锰矿焙烧法制得一氧化锰矿,再经酸浸~除杂~结晶工艺制得。
黔东某工厂采用上述第3种生产方式,即采用一氧化锰焙砂为原料,经浸出化合~净化~蒸发结晶~干燥的工艺制备高纯一水硫酸锰。其溶液主要除杂工艺包含以下几点。
1.1 浸出化合阶段
矿中其他杂质成分以氧化物形式存在,与硫酸最终形成硫酸物质(制液):

CuSO4:溶于水、甲醇,不溶于乙醇;FeSO4:溶于水、甘油,不溶于乙醇;NiSO4易溶于水,微溶于乙醇、酸、氨水;CoSO4溶于水、甲醇,微溶于乙醇;ZnSO4易溶于水;CaSO4微溶于水、溶于盐酸;MgSO4易溶于水,微溶于乙醇、甘油、乙醚,不溶于丙酮,如表1所示。

表1 矿石中其他杂质成分加入硫酸生成硫酸物在溶液中不同温度的溶解度(g)
1.2 除钾钠,钾钠在溶液中也以硫酸物的形式存在,添加硫酸铁,与钾钠形成沉淀 (除杂)
为完整去除钾钠,添加的硫酸铁是原计算量的1.2倍~1.5倍。

NaFe3(SO4)2(OH)6与 KFe3(SO4)2(OH)6溶解性相同不溶于水、溶于盐酸。
1.3 净化阶段
1.3.1 中和除铁,铁在溶液中以硫酸物的形式存在,调节合适ph形成氢氧化铁沉淀即可(除杂)
在除铁过程中加入氧化锰粉将PH调解到4.5-5.1,其中的硫酸铁形成氢氧化铁沉淀。
Fe(OH)3不溶于水、乙醇,溶于酸,可溶于热浓碱。加热时逐渐分解而成氧化铁和水。在酸中的溶解度随制得时间的长短而变化,新产出的氢氧化铁的易溶于酸,若放置时间长,则难溶解。
氢氧化铁的溶度积是1037,当铁离子浓度为3价时按1mol/L计算大约pH=2时氢氧化铁就开始沉淀,pH=3.7就完全沉淀:离子浓度1mol/L和0.1mol/L时,pH=1.5和2.3开始沉淀,pH=4.1时沉淀完全,氢氧化铁通常认为离子浓度小于10-5就是沉淀完全。而开始沉淀时的pH与金属离子的初始浓度有关。可以假设开始沉淀时各金属离子浓度均为1mol/L,则由Ksp值可求得氢氧化铁沉淀的PH范围分别为 :1.5~4.1。
1.3.2 加硫化钡除重金属,而钡离子与硫酸根离子形成硫酸钡沉淀(除杂)
深度净化加入的净化剂不能引入新的杂质,所以硫化剂如福美钠和乙硫氮是目前生产过程中硫酸锰溶液净化常用的重金属Co、Ni等去除剂,但由于其含有电池级硫酸锰中不希望有的碱金属杂质,使用其除重金属会增加除钠的负荷,故不能采用。同理,像硫化钠和硫化铵等也因同样的原因不能用做除重金属的硫化剂。硫酸锰体系中,硫化钡是一种可以做为除重金属硫化剂而不带入其它杂质的硫化物(前提是其本身不含有害杂质),因为钡离子与硫酸根生成了沉淀。硫化钡溶于水,加入到硫酸锰溶液中后会和重金属如镍、钴、锌、铜等发生反应,从而使硫酸锰溶液的杂质均得以去除,达到高纯硫酸锰的质量标准。硫化除杂主要方程式如下:
初中体育传统课堂教学更加注重的是课程的程序化,所以在实际教学中往往会忽略随时都可能变化的教学活动,一旦遇到突如其来的教学问题则难以有效应对。初中体育高效课堂构建的本质是教师有效完成教学任务,这就需要教师在实施教学的过程中对可能发生的一切事件进行提前的预判。即便教学环境发生改变,还是教学内容需要调整,都可以灵活应对。

CuS极难溶于水,也难溶于硫化钠溶液和浓盐酸。有还原性,易被硝酸、浓硫酸所氧化而溶解;NiS溶于盐酸、硝酸和王水。
ZnS溶于稀无机酸,可溶于碱,不溶于水;CoS不溶于水,溶于酸;Pb难溶于酸,不溶于水,不溶于碱。
1.3.3 除钙镁,溶液中的钙镁离子与氟离子形成沉淀(除杂)
氟化物法去除硫酸锰溶液中钙镁是目前工业上使用较多的方法。氟化物法是一种化学沉淀法,硫酸溶液中生成的氟化钙以及氟化镁相比氟化锰的溶解度而言要小得多,常用的氟化物沉淀剂有氟化锰、氟化铵、氟化钠等,其中氟化锰因在沉淀钙镁中带入锰元素不带入新的杂质,成为最理想的沉淀剂[3]。
由于Ca2+、Mg2+与F-形成的Ca、F2、Mg、F2的溶度积较低,而F-与Mn2+、Ni2+形成的Mn F2、Ni F2溶解度较大,所以用含氟元素的化合物除去溶液中的Ca2+、Mg2+杂质一直以来都是研究的重点
反应时溶液呈弱酸性PH5-6。
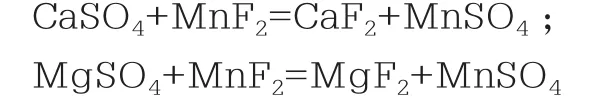
CaF2极难溶于水。可溶于盐酸、氢氟酸、硫酸、硝酸和铵盐、铝盐和铁盐溶液,不溶于丙酮;
氟化钙、氟化镁的在溶液中容易形成胶体,造成过滤非常困难,甚至无法过滤,针对于过滤之后残留在溶液中的氟化钙、氟化镁微小颗粒无法滤出的情况,或引进超重力固液分离技术分离细小颗粒,进一步降低产品当中钙镁含量。在使用氟化法的过程中,可能出现氟离子超标的现象,针对氟离子超标现象,需要进一步探索试验解决。
1.3.4 氧化除铁。
在溶液中加入双氧水,温度85℃~90℃,反应时间1h~2h,其PH值在上一段除杂过程中已处于5~6,二价铁离子被氧化后即与水解OH-形成Fe(OH)3沉淀。
2 试验高纯硫酸锰溶液除杂试验
2.1 试验步骤
称取500g一氧化锰焙砂酸性浸出,浸出液固比:5.21:1,反应温度85℃~90℃,浸出时间2h,控制浸出终点pH值为1.6~2.5;加入Fe2(SO4)3去除溶液中的Na+、K+;添加氧化锰粉中和PH,使溶液中的Fe3+水解生成氢氧化铁沉淀;添加硫化剂,使中和后液中的重金属杂质离子与形成硫化物沉淀。控制反应温度为60℃~70℃,反应时间0.5h~1h进行净化除重金属反应。
反应终点pH6.5~7,滤液静置24h~48h后加入氟化锰并通入少量蒸汽维持反应温度85℃~90℃,反应时间3h~4h;过滤后加入一定量双氧水再次净化除铁,通入少量蒸汽维持反应温度85℃~90℃,反应时间1h~2h。过滤,滤液即为高纯硫酸锰溶液。
2.2 试验结果
根据以上步骤逐步开展试验,取得较好的除杂效果,如下表:

表2 高纯硫酸锰溶液除杂试验
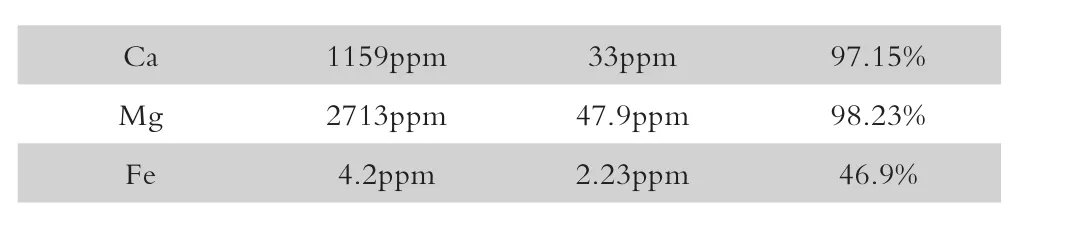
Ca 1159ppm 33ppm 97.15%Mg 2713ppm 47.9ppm 98.23%Fe 4.2ppm 2.23ppm 46.9%
3 结论
(1)黔东某公司生产高纯硫酸锰过程中,杂质去除均采用固液分离法,其均为利用其杂质离子与特定离子相互结合沉淀的特性而实现除杂的效果。
(2)通过试验研究,使用硫酸铁除钾钠、中和除铁、硫化法除重金属、氟化法除钙镁、双氧水再除铁。在整个试验过程中。钾、钠、钙、镁、重金属去除率皆达到90%以上,效果良好。但制备硫酸锰过程中所产生的杂质,如硫化渣、钙镁渣等,需要进一步开发其中的回收价值,达到环保、绿色要求。

