花铃期棉花黄萎病抗病与感病品种对土壤细菌群落结构的影响
赵卫松,郭庆港,李社增,王培培,鹿秀云,苏振贺,张晓云,马平
(河北省农林科学院植物保护研究所/河北省农业有害生物综合防治工程技术研究中心/农业农村部华北北部作物有害生物综合治理重点实验室,河北保定 071000)
0 引言
【研究意义】棉花黄萎病(cotton verticillium wilt)是由大丽轮枝菌(Verticillium dahliae)侵染引起的真菌性维管束病害,一般造成棉花减产5%—10%,严重的高达20%—30%,甚至绝收[1]。该病在我国主要产棉区均有不同程度的发生,是导致棉花减产和纤维品质下降的主要土传病害[2-3]。利用抗病品种是防治黄萎病的有效途径之一。土壤微生物之间具有群体动态效应和复杂的群落结构,与植物的生长发育和抗病性之间存在着十分密切的关系,同时研究表明作物土传病害的发生与土壤微生物群落结构密切相关[4-5]。通过研究不同抗病性品种土壤微生物多样性,揭示棉花品种抗病性与土壤微生物的相互关系,可为棉花黄萎病的生物防治和生态防治提供理论依据,同时对指导其他土传病害的防治也具有重要意义。【前人研究进展】目前,有关棉花对黄萎病抗病的研究主要集中在组织结构[6]、生理生化(毒素、可溶性糖、酶、激素)[7]、抗病基因[8]等方面,而关于土壤微生物在抗黄萎病中的作用研究相对较少。微生物群落结构多样性是维持土壤生态系统稳定和可持续的重要保障,是影响土壤微生态环境中生理活性最重要的因子[9-10]。研究表明,植物病害的发生与植物内生菌的群落结构密切相关,且植物不同生育时期的根际微生物群落结构存在差异并与品种抗病性存在十分密切的关系[11-13]。同时发现,棉花抗/感品种产生的根系分泌物种类及浓度存在差异,导致根际微生物种类和数量不同[14]。进一步研究表明,根系分泌物并不局限于对根际微生物的影响,可能对整个农田生态系统中土壤微生物环境造成影响[15-17]。土壤养分也显著影响土壤微生物的群落结构[18]。【本研究切入点】鄂荆1号和冀863品种对黄萎病具有不同的抗性,这种抗性除了自身抗病基因外,是否与抗/感品种外界环境土壤微生物有关,以及抗/感品种间土壤微生物是否存在多样性和种群结构的差异,目前尚未见报道。在国家实施“化肥、农药双减”的背景下,针对目前棉花黄萎病防治困难以及关于棉花抗/感品种在发病时期(主要为花铃期)不同阶段土壤细菌群落结构的组成变化及其与黄萎病的相互关系尚缺乏系统的研究。【拟解决的关键问题】以棉花抗/感黄萎病品种为研究材料,通过高通量测序(Illumina MiSeq)技术研究抗/感品种在花铃期不同阶段的土壤细菌群落组成变化,分析细菌群落组成与土壤理化性质之间的关系,探讨细菌群落组成和品种抗病性的关系,以期为棉花黄萎病的绿色防控提供新途径和新思路。
1 材料与方法
1.1 试验区域概况
河北省曲周县位于冀南平原,是我国五大商品棉主要生产基地,年平均气温13.1℃,无霜期平均为210 d,平均降水量为556.2 mm,70%的降水集中在6—9月。棉花是当地主要的种植作物[19]。试验在曲周县槐桥乡西漳头村银絮专业合作社开展。
1.2 试验材料
供试棉花品种鄂荆1号(感黄萎病品种,EJ)和冀863(抗黄萎病品种,J863)均为晚熟品种,分别由河北省农林科学院植物保护研究所和曲周县银絮专业合作社提供。
1.3 试验设计与土壤样品采集
2018年4月20日播种棉花,每个处理3次重复,每小区面积为45 m2(长60 m,宽0.75 m),行距0.75 m,株距0.35 m,为了避免土壤环境因素导致的误差,不同品种种植采用小区间隔排列。在棉花生长期间,按照当地生产技术进行肥水和虫草害管理。分别在盛花期(7月19日)、开花后期(8月22日)和结铃期(9月3日),按照“W”形采用多点取样法,用取土器在棉花行间距离棉花根部10 cm采集0—20 cm耕作层的土壤,每小区采集约500 g土壤混匀装于自封袋中,一部分于-80℃冰箱保存,用于后续土壤微生物群落分析,一部分用于土壤理化性质分析。
1.4 测定项目及方法
1.4.1 黄萎病调查 在黄萎病发生时期(黄河流域主要从7月中旬至9月上旬),按照李社增等[20]分级标准于盛花期、开花后期和结铃期分别调查不同品种的发病率和病情指数,分别用EJ-7、EJ-8、EJ-9和J863-7、J863-8、J863-9表示,并按照如下公式计算发病率和病情指数。病情调查标准如下,0级:棉株健康,无病叶,生长正常;1级:棉株1/4以下叶片发病,变黄萎蔫;2级:棉株1/4以上,1/2以下叶片发病,变黄萎蔫;3级:棉株1/2以上,3/4以下叶片发病,变黄萎蔫;4级:棉株3/4以上叶片发病,或叶片全部脱落,棉株枯死。
发病率(%)=(发病株数/调查总株数)×100;
病情指数(DI)=∑(相应病级×各级病株数)/(最高病级×总株数)×100。
1.4.2 土壤细菌群落高通量测序 土壤基因组DNA的提取按照FastDNATMSPIN Kit for Soil(MP Biomedicals,Solon,OH,USA)试剂盒说明书进行,DNA的纯度和浓度由NanoDrop 2000分光光度计(Thermo Fisher Scientific Inc.,Waltham,MA,USA)进行检测。细菌16S rDNA的V3-V4区采用338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)[21]进 行 扩增,通过2%琼脂糖凝胶电泳进行检测,并对其目标片段进行切胶回收。文库构建和高通量测序由上海派森诺生物科技有限公司完成。
1.4.3 土壤中大丽轮枝菌ITS基因拷贝数量的测定在盛花期、开花后期和结铃期,按照1.3方法采集耕作层土壤,提取DNA,将其作为模板进行实时荧光定量PCR反应,反应体系:2×Master Mix(德国DBI Bioscience公司)10 μL,大丽轮枝菌ITS上下游引物[22](F:CCCGCCGGTCCATCAGTCTCTCTG;R:CGGGACTCCGATGCGAGCTGTAAC)各1 μL,DNA 1 μL,ROX 0.4 μL,ddH2O补至20 μL。扩增程序:95℃预变性30 s,95℃变性5 s,60℃退火并延伸30 s,扩增40个循环。每个样品重复3次,得到不同时间样本的循环阈值(Ct),根据赵卫松等[23]前期建立的标准曲线计算土壤中大丽轮枝菌ITS基因的拷贝数量。
1.4.4 土壤理化性质测定 采用酸度计对土壤pH进行测定[24];采用KCl浸提-靛酚蓝比色法分别对铵态氮和硝态氮进行测定[24-25];采用NaHCO3浸提-钼锑抗比色法对速效磷进行测定[24];以硫酸亚铁为标准溶液采用分光光度法按照土壤有机质含量测定说明书步骤进行测定[24]。
1.5 数据分析
数据采用Microsoft Excel 2010进行整理,Origin 8.6进行作图,采用SPSS 17.0软件进行单因素方差分析、独立样本T检验和邓肯新复极差法(DMRT)多重比较统计分析。采用Canoco 4.5软件对样本微生物群落进行主成分分析(PCA)和冗余分析(RDA),并利用CanoDraw软件进行作图。
2 结果
2.1 花铃期不同阶段土壤理化性质测定
棉花抗/感品种在花铃期不同阶段对土壤理化性质存在不同程度的影响。除了土壤中无机磷含量外,感病品种EJ土壤的铵态氮、硝态氮、pH、速效磷和有机质在盛花期均高于抗病品种J863。由盛花期至结铃期,铵态氮和速效磷含量呈现先显著下降后上升的趋势,硝态氮和有机质含量呈现显著下降的趋势,pH在感病品种中变化幅度较大且存在差异,而在抗病品种中差异不显著,无机磷含量均呈现先显著上升后下降的趋势。其中,硝态氮和无机磷含量下降幅度较大,在感病品种EJ和抗病品种J863土壤中硝态氮含量分别由66.28、45.77 mg·kg-1降至2.70、7.31 mg·kg-1,无机磷含量分别由252.37、277.60 μg·g-1降至89.69、100.95 μg·g-1(表1)。
2.2 棉花抗/感品种黄萎病发生调查
在棉花盛花期、开花后期和结铃期调查抗/感品种黄萎病的发病率和病情指数,由图1可知,感病品种EJ发病率在不同时期均显著高于抗病品种J863;而病情指数仅在开花后期和结铃期显著高于抗病品种J863。
2.3 棉花抗/感品种土壤中大丽轮枝菌的数量
由图2可见,感病品种EJ在开花后期和结铃期土壤中大丽轮枝菌ITS拷贝数量显著高于盛花期,分别提高了8.19%和8.38%;对于抗病品种J863,在开花后期和结铃期土壤中病原菌ITS拷贝数量显著低于盛花期,且分别降低了6.03%和8.86%;除了在盛花期外,抗病品种土壤中的大丽轮枝菌ITS拷贝数均低于感病品种。
2.4 土壤细菌多样性分析
F检验结果表明(表2),EJ和J863在盛花期和开花后期土壤细菌的Chao1指数和ACE指数显著高于结铃期,而Shannon和Simpson指数在花铃期不同阶段差异不显著;J863在盛花期和结铃期的细菌丰富度Chao1和ACE指数均高于EJ,而均匀度Shannon和Simpson指数在花铃期不同阶段差异不显著。

表1 土壤理化性质测定Table 1 Detection of soil physicochemical properties
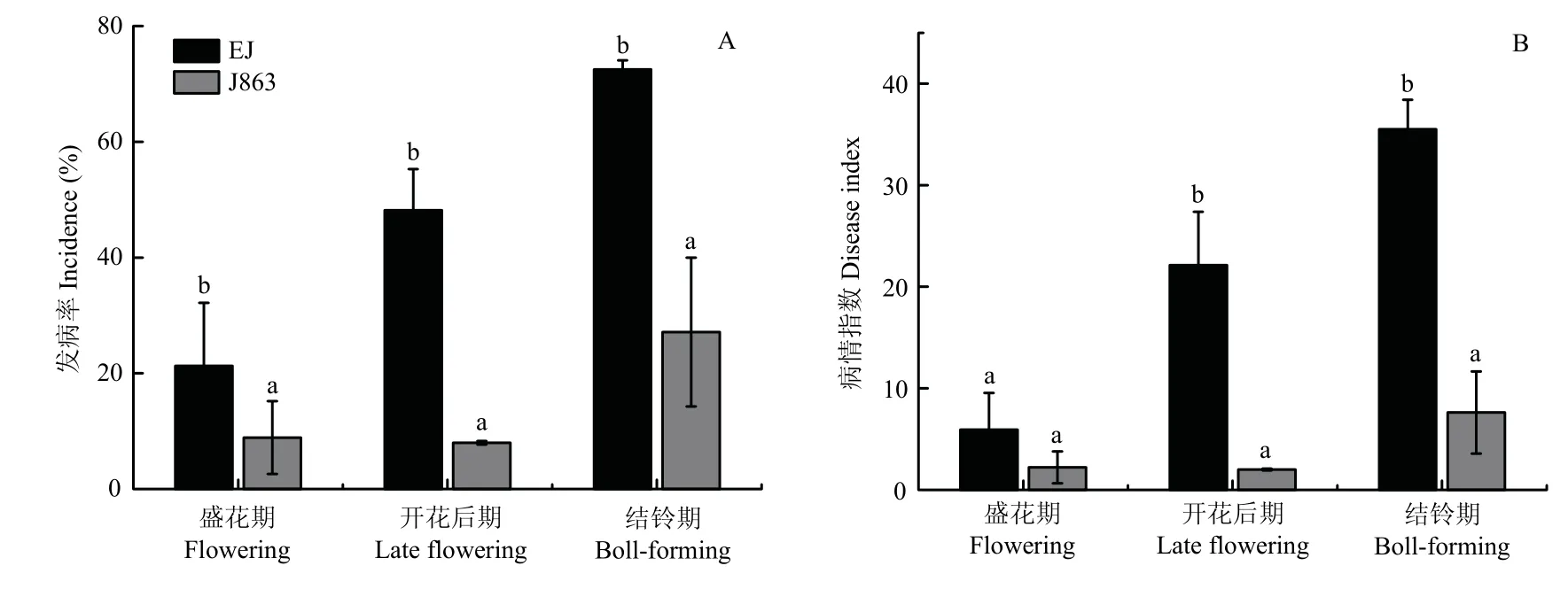
图1 棉花抗/感品种的黄萎病发生调查Fig.1 Investigation of verticillium wilt in cotton resistant/susceptible varieties

表2 棉花抗/感品种在花铃期不同阶段的细菌测序量和群落多样性Table 2 Bacterial sequencing and community diversity of cotton resistant/susceptible varieties at different flowering and boll stages
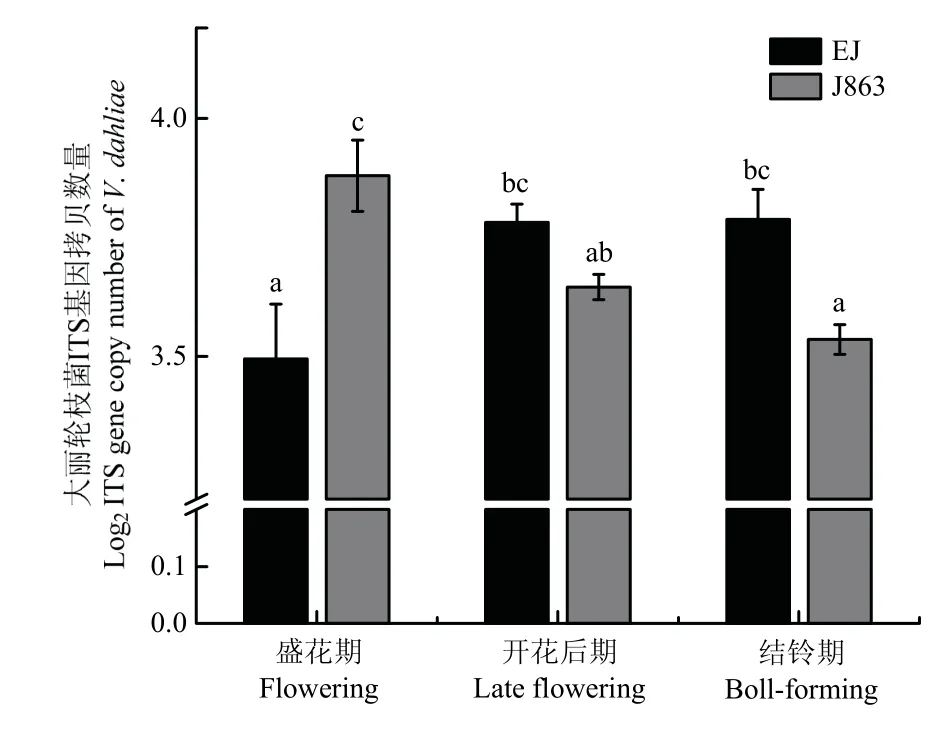
图2 花铃期不同阶段棉花抗/感品种土壤中大丽轮枝菌ITS拷贝数量Fig.2 ITS gene copy number of V.dahliae in soil of cotton resistant/susceptible varieties at different flowering and boll stages
2.5 棉花抗/感品种细菌群落结构比较
抗/感品种样本的细菌群落结构主成分分析表明(图3),所有样品在主成分坐标中位于不同的象限,说明抗/感品种在不同时期土壤样品的细菌群落结构存在差异。进一步分析发现,门水平下第一主成分(PCA1)和第二主成分(PCA2)分别可以解释所有变量的59.5%和31.0%,2个主成分方差累积贡献率达到90.5%,说明其能够表征微生物群落组成的特征,感病品种EJ位于第三、四象限,抗病品种J863位于第一、二象限;属水平下第一主成分(PCA1)和第二主成分(PCA2)分别可以解释所有变量的60.6%和19.3%,2个主成分方差累积贡献率达到79.9%,说明其能够表征微生物群落组成的特征,EJ位于第二、三限,J863位于第一、四象限,同一个椭圆代表品种在不同时期的微生物群落组成,品种之间不存在交叉重叠,说明抗/感品种的细菌群落结构存在差异。

图3 棉花抗/感品种在门(A)和属(B)水平下土壤细菌群落结构的主成分分析Fig.3 Principal component analysis of soil bacterial community structure of cotton resistant/susceptible varieties at phylum (A) and genus (B) levels
门水平下抗/感品种土壤细菌群落组成的研究结果表明(图4),感病品种EJ和抗病品种J863在盛花期(EJ-7/J863-7)、开花后期(EJ-8/J863-8)和结铃期(EJ-9/J863-9)获得的前15个丰度较高的菌群分别为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、Rokubacteria、硝化螺旋菌门(Nitrospirae)、疣微菌门(Verrucomicrobia)、Latescibacteria、Patescibacteria、装甲菌门(Armatimonadetes)、厚壁菌门(Firmicutes)和Entotheonellaeota,其相对丰度分别介于29.97%—34.66%、14.77%—20.97%、12.17%—20.37%、10.17%—12.87%、6.97%—8.69%、2.78%—4.04%、2.28%—3.72%、1.83%—2.49%、1.14%—1.64%、0.75%—0.95%、0.38%—1.23%、0.27%—0.69%、0.09%—0.22%、0.11%—0.20%和0.07%—0.18%。其中感病品种EJ的部分菌群平均相对丰度低于抗病品种J863,如放线菌门、芽单胞菌门、绿弯菌门、拟杆菌门、硝化螺菌门、Patescibacteria和装甲菌门,平均降低幅度分别为16.38%、4.05%、2.25%、6.58%、7.10%、20.60%和35.78%。
差异显著性分析表明,在结铃期,抗病品种土壤的变形菌门菌群的相对丰度显著下降;在盛花期和开花后期,抗/感品种间差异不显著。由盛花期至结铃期,感病品种土壤的酸杆菌门和芽单胞菌门的相对丰度呈显著下降趋势,而抗病品种表现为显著上升,且抗病品种显著高于感病品种。由盛花期至结铃期,感病品种土壤的放线菌门、绿弯菌门和Patescibacteria菌群的相对丰度分别表现为显著上升,而抗病品种表现为显著下降,其中在盛花期,感病品种土壤的放线菌门菌群相对丰度显著低于抗病品种,在结铃期品种间差异不显著;在盛花期,感病品种土壤的绿弯菌门菌群的相对丰度显著低于抗病品种,而在开花后期和结铃期显著高于抗病品种。由盛花期至结铃期,感病品种土壤的Rokubacteria菌群的相对丰度表现为显著下降,而抗病品种差异不显著。在不同生育时期,拟杆菌门、浮霉菌门、硝化螺菌门、疣微菌门、厚壁菌门和Entotheonellaeota菌群的相对丰度变化抗/感品种间差异均不显著。
属水平下抗/感品种菌群的相对丰度研究结果表明(图5),感病品种EJ和抗病品种J863在盛花期(EJ-7/J863-7)、开花后期(EJ-8/J863-8)和结铃期(EJ-9/J863-9)获得的前20个丰度较高的菌群分别为鞘氨醇单胞菌属(Sphingomonas)、溶杆菌属(Lysobacter)、芽单胞菌属(Gemmatimonas)、Haliangium、硝化螺菌属(Nitrospira)、Bryobacter、Iamia、Dongia、Pseudarthrobacter、芽球菌属(Blastococcus)、Luedemannella、红色杆菌属(Rubrobacter)、Gaiella、类诺卡氏属(Nocardioides)、Pontibacter、Ilumatobacter、链霉菌属(Streptomyces)、Gemmatirosa、微单孢菌属(Micromonospora)和Solirubrobacter,其相对丰度分别介于12.84%—26.80%、5.79%—16.78%、6.07%—10.14%、4.41%—11.38%、6.18%—9.02%、4.71%—8.30%、2.00%—6.45%、3.13%—5.16%、2.81%—4.96%、2.25%—5.51%、2.14%—3.95%、2.01%—5.08%、1.87%—5.16%、1.23%—5.97%、1.19%—4.41%、2.03%—3.67%、0.70%—3.47%、1.13%—3.04%、0.87%—3.82%和0.71%—2.32%。其中,感病品种EJ的平均相对丰度低于抗病品种J863的菌群包括鞘氨醇单胞菌属、芽单胞菌属、Bryobacter、Iamia、Pseudarthrobacter、芽球菌属、红色杆菌属、类诺卡氏属、Pontibacter、链霉菌属、Gemmatirosa、微单孢菌属和Solirubrobacter,与抗病品种J863相比,上述菌群平均相对丰度下降幅度分别为5.09%、19.41%、13.79%、2.36%、10.78%、34.47%、46.76%、61.84%、52.75%、48.61%、74.79%、9.13%和26.42%。
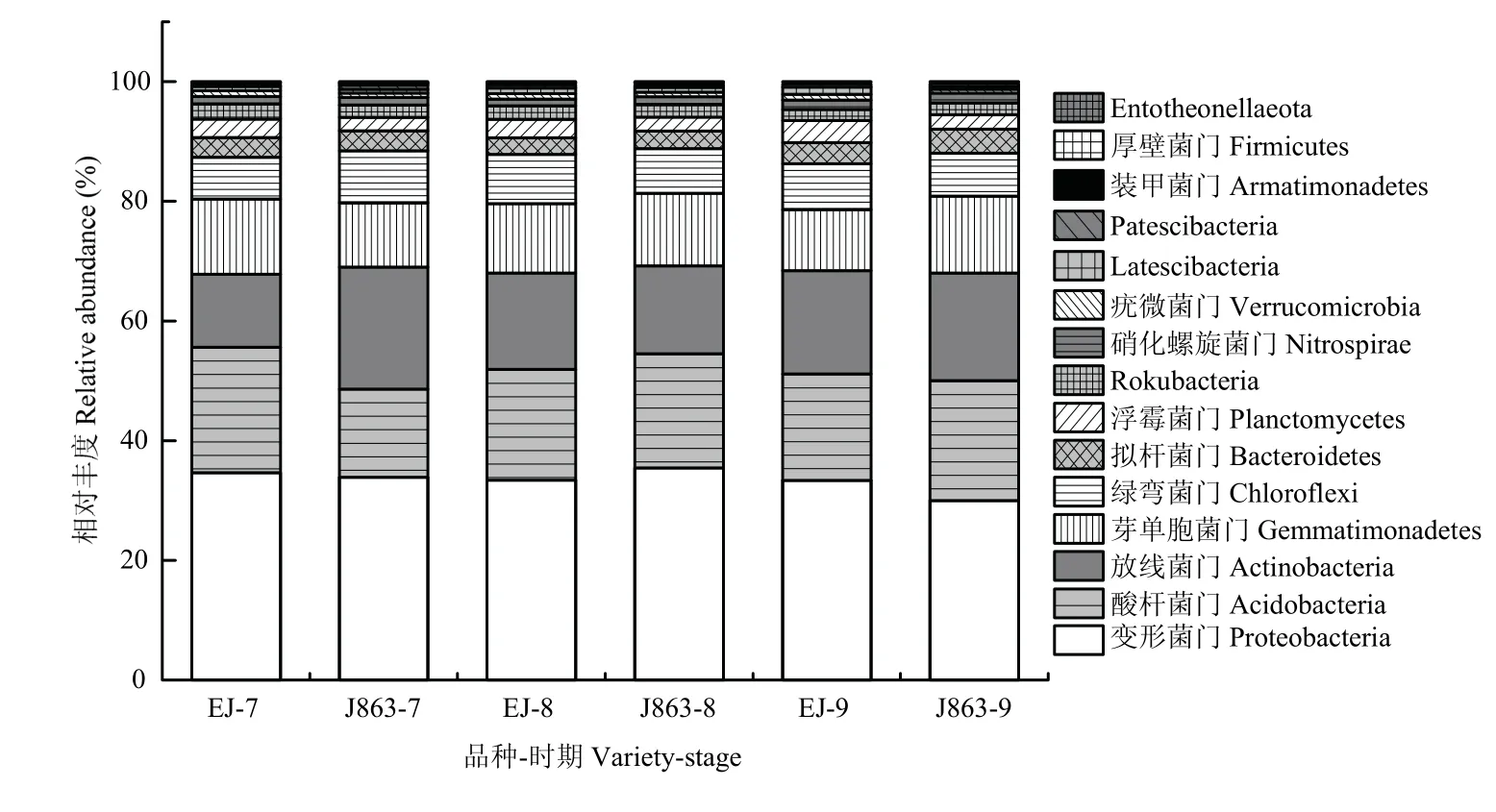
图4 棉花抗/感品种在门水平下细菌群落组成相对丰度变化(前15个)Fig.4 Relative abundance of bacterial community composition of cotton resistant/susceptible varieties at phylum level (top 15)
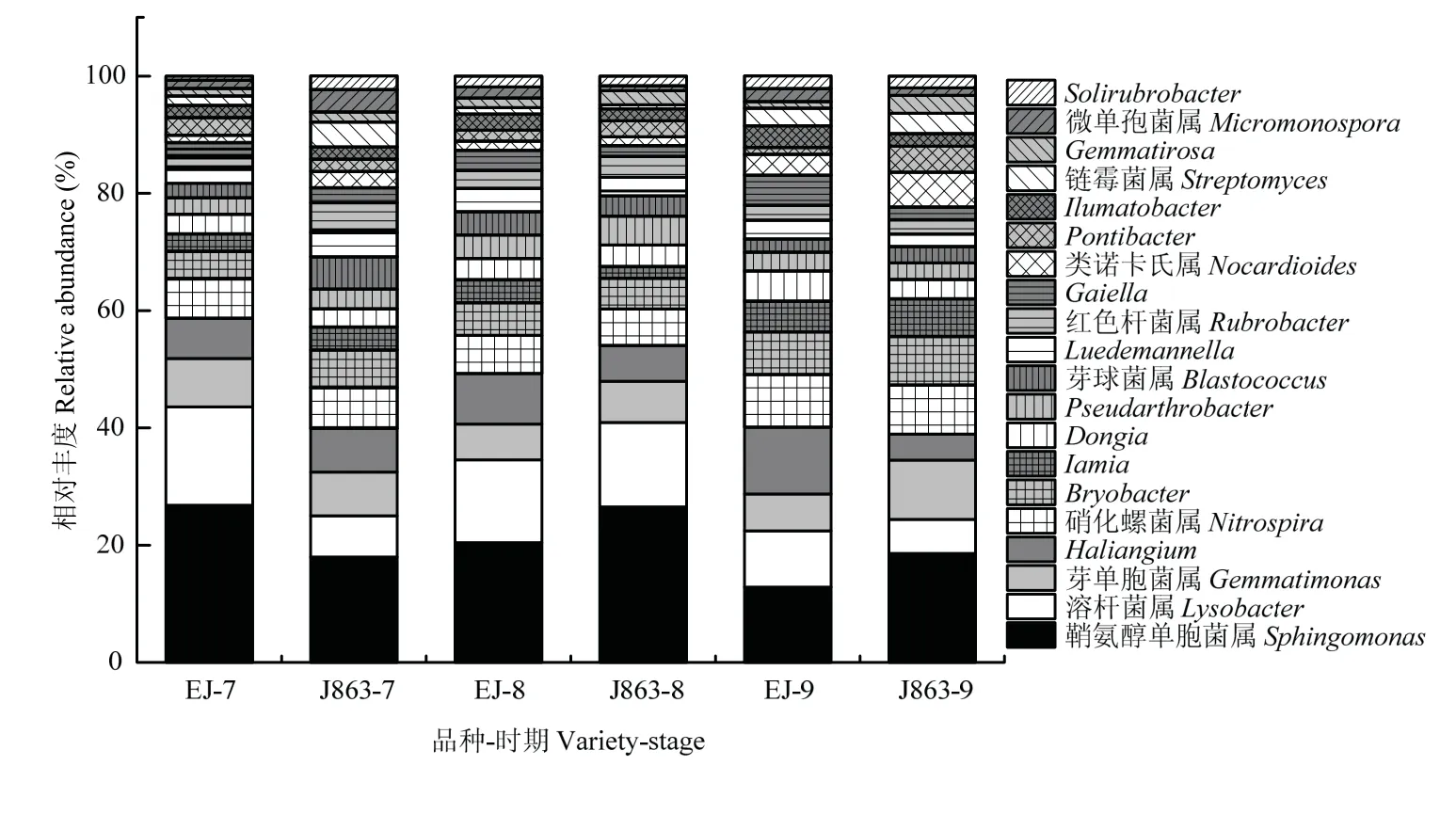
图5 棉花抗/感品种在属水平下细菌群落组成相对丰度变化(前20个)Fig.5 Relative abundance of bacterial community composition of cotton resistant/susceptible varieties at genus level (top 20)
差异显著性分析结果表明,由盛花期至结铃期,感病品种土壤中鞘氨醇单胞菌属、芽单胞菌属和Pontibacter菌群的相对丰度表现为显著下降,而抗病品种表现为显著上升;在盛花期,上述菌群的相对丰度品种间差异不显著,而在其他时期抗病品种显著高于感病品种。感病品种土壤的溶杆菌属菌群相对丰度呈显著下降趋势,而抗病品种呈现先显著上升后下降的趋势;在盛花期,感病品种该菌群的相对丰度高于抗病品种,在其他生育时期内抗/感品种间差异不显著。由盛花期至结铃期,感病品种Haliangium菌群的相对丰度呈显著上升趋势,而在抗病品种呈显著下降趋势;在结铃期,感病品种该菌群的相对丰度高于抗病品种,其他时期品种间差异不显著。在生育期内抗/感品种硝化螺菌属的相对丰度呈上升趋势但差异不显著。在结铃期,抗病品种土壤Bryobacter和Iamia菌群的相对丰度显著高于感病品种,其他时期品种间差异不显著。在结铃期,感病品种Dongia和Ilumatobacter菌群的相对丰度显著高于抗病品种,其他时期品种间差异不显著。在生育期内,Pseudarthrobacter和Luedemannella的相对丰度在品种间差异不显著。在盛花期,抗病品种土壤的芽球菌属、微单孢菌属和Solirubrobacter菌群的相对丰度均显著高于感病品种,其他时期品种间差异不显著。在结铃期,红色杆菌属的相对丰度品种间差异不显著,其他时期该菌群抗性品种显著高于感病品种。在生育期内,感病品种土壤Gaiella菌群的相对丰度呈显著上升趋势,而抗病品种差异不显著,且感病品种高于抗病品种。在结铃期,感病品种土壤类诺卡氏属菌群的相对丰度显著低于抗病品种,其他时期差异不显著。在开花后期,链霉菌属的相对丰度品种间差异不显著;在盛花期和结铃期,抗病品种的相对丰度显著高于感病品种。在生育期内,抗病品种土壤Gemmatirosa菌群的相对丰度高于感病品种,且在抗病品种中呈显著上升趋势。
2.6 细菌属水平群落组成与土壤理化性质的冗余分析(RDA)
属水平土壤中优势细菌群落与土壤理化性质的相关性分析表明(图 6),优势细菌群落对土壤理化性质的响应不同。其中,相对丰度较高的鞘氨醇单胞菌属和溶杆菌属与硝态氮、无机磷、pH和有机质呈正相关,Bryobacter与无机磷、pH和有机质呈负相关,芽单胞菌属与无机磷、pH和有机质相关性不大,Haliangium和硝化螺菌属与铵态氮、速效磷呈正相关,硝化螺菌属与硝态氮、无机磷、pH和有机质呈负相关。
进一步研究表明,抗/感品种在花铃期不同阶段的细菌群落组成与土壤理化性质之间存在相关性。其中,感病品种EJ在盛花期(EJ-7)和开花后期(EJ-8)的细菌群落组成与硝态氮、无机磷、pH和有机质呈正相关,结铃期(EJ-9)与速效磷、铵态氮呈正相关;抗病品种J863在盛花期(J863-7)的细菌群落组成与硝态氮、无机磷、pH和有机质呈负相关,在开花后期(J863-8)的细菌群落组成与硝态氮、无机磷、pH和有机质呈正相关,在结铃期(J863-9)的细菌群落组成与上述土壤理化指标之间相关性不大。
3 讨论
3.1 不同抗性品种对土壤微生物群落的影响
雷娟利等[26]研究表明,抗枯萎病西瓜品种根际土壤细菌的均匀度和多样性均高于感病品种,并且抗病品种的细菌数量高于感病品种,而真菌和放线菌数量在抗/感品种间不存在相关性;蔡秋华等[27]通过比较烤烟抗/感青枯病和黑胫病品种的根际土壤微生物变化,发现抗病品种与根际土壤细菌和放线菌呈正相关,而与真菌呈负相关;李洪连等[28]通过平板涂布法比较了棉花黄萎病不同抗/感品种与根际土壤微生物的关系,结果表明抗病品种的真菌种数多于感病品种,并且前者区系组成更为复杂,抗性品种与真菌数量呈正相关,而与细菌数量无显著相关性。

图6 土壤理化性质与细菌属水平群落组成的冗余分析Fig.6 RDA analysis of soil physicochemical properties and bacterial communities at genus level
本研究结果表明,棉花黄萎病抗/感品种之间的土壤细菌群落多样性、结构和组成方面存在差异。群落组成方面,在门水平上,抗病品种的放线菌门、芽单胞菌门、绿弯菌门、拟杆菌门、硝化螺菌门、Patescibacteria和装甲菌门菌群的相对丰度高于感病品种;在属水平上,抗病品种的鞘氨醇单胞菌属、芽单胞菌属、Bryobacter、Iamia、Pseudarthrobacter、芽球菌属、红色杆菌属、类诺卡氏属、Pontibacter、链霉菌属、Gemmatirosa、微单孢菌属和Solirubrobacter菌群的相对丰度高于感病品种,进一步验证了前人的研究观点,即抗病品种的土壤微生物群落结构优于感病品种[26,29],而与李洪连等[28]通过选择性平板法表明抗病性不同的棉花品种与根际细菌数量无明显相关性的结论存在区别,本研究认为对微生物群落的研究方法存在区别可能是导致研究结果不同的主要原因之一。此外,抗/感品种的植物根系分泌物种类和含量不同[14],且根系分泌物能够影响土壤微生物群落结构[13,30-31],推测根系分泌物是造成抗/感品种根际土壤微生物群落差异的原因之一。关于作物根系分泌物中的哪些物质通过何种代谢途径对微生物造成影响,有待于进一步研究。
3.2 作物生育时期对土壤微生物群落的影响
已有研究表明,土壤微生物群落结构受作物生育时期的影响较为明显[29-30]。BREIDENBACH等[29]比较了水稻不同生育时期对根际土壤和非根际土壤微生物群落组成的影响,发现在水稻生长早期草螺菌属(Herbaspirillum)菌群的相对丰度较高,且根际土壤高于非根际土壤;INCEOGLU等[30]研究发现,马铃薯不同品种根际土壤微生物受作物生育时期的影响,其中幼苗期和开花期的根际土壤细菌群落结构显著不同于衰老期;CHAPARRO等[13]比较了拟南芥苗期、抽薹期和开花期根际土壤细菌群落结构,结果表明幼苗期的土壤微生物群落明显不同于其他时期,并且指出植物在不同的生育时期能够招募特定的微生物种类;李洪连等[28]研究表明,抗/感黄萎病棉花品种在根际微生物区系组成的差异在苗期和现蕾期比较明显,而在花铃期差异则显著降低,说明根际微生物对棉花抗病性的影响在生长前期较大,生长后期则较小;胡元森等[32]对黄瓜不同生育时期根际土壤微生物的研究发现,根际微生物主要类群的数量与其生长发育呈正相关,且根际微生物数量在花期或盛果期时达到最高峰,之后呈下降趋势。
本研究结果表明,在盛花期、开花后期和结铃期抗/感品种之间的土壤细菌群落多样性差异性存在区别。对于抗病品种而言,由盛花期至结铃期,鞘氨醇单胞菌属、芽单胞菌属、Pontibacter和Gemmatirosa菌群的相对丰度呈上升趋势;溶杆菌属菌群的相对丰度呈先上升后下降趋势,Haliangium菌群的相对丰度呈下降趋势。而对于感病品种而言,鞘氨醇单胞菌属、溶杆菌属、芽单胞菌属和Pontibacter菌群的相对丰度呈下降趋势,Haliangium和Gaiella菌群的相对丰度均呈上升趋势。此外,由盛花期至结铃期,Pseudarthrobacter、硝化螺菌属和Luedemannella菌群的相对丰度在品种间差异不显著。在结铃期,Bryobacter、Iamia、Dongia、Ilumatobacter和类诺卡氏属菌群的相对丰度存在差异,而在盛花期和开花后期差异不显著。在盛花期,芽球菌属、微单孢菌属和Solirubrobacter菌群的相对丰度存在差异,其他时期品种间差异不显著。在结铃期,红色杆菌属菌群的相对丰度品种间差异不显著,其他时期差异显著;在盛花期和结铃期,链霉菌属菌群的相对丰度在品种间存在显著差异。抗/感品种由盛花期至结铃期的病情指数呈逐步上升趋势,本研究仅从对土壤细菌的群落组成变化进行了研究,而抗/感品种受黄萎病菌侵染后根际微生物和植物内生菌的组成及变化情况有待于进一步探究。
3.3 病原菌数量与作物品种抗病性的关系
许多学者从土壤和植株组织中的病原菌数量与作物品种抗病性的关系角度开展研究[33-35]。刘琼光等[33]研究表明,根际土壤中青枯菌数量与番茄品种抗性之间相关性不高,而植物根内青枯菌数量与番茄品种抗性密切相关;王卉等[34]研究发现,青枯菌数量在番茄抗/感品种之间存在明显差异,而病原菌数量在不同品种根部的吸附差异不显著;吴传德等[35]研究表明,棉花枯萎病抗病品种根际土壤中病原菌数量明显少于感病品种。本研究结果表明,土壤中大丽轮枝菌的数量与黄萎病发生的相关性存在差异,其中土壤中病原菌数量与感病品种鄂荆1号的发病率和病情指数呈正相关,而与抗病品种冀863相关性不强。开花后期和结铃期抗病品种冀863土壤中的病原菌ITS拷贝数低于感病品种鄂荆1号。
3.4 土壤理化性质与微生物群落的关系
土壤养分、pH、有机质等土壤理化性质是影响土壤微生物群落结构的重要因素[36-37]。ZHOU等[38]研究表明,连续多年施氮显著影响了土壤细菌和真菌的群落结构变化,该团队进一步研究发现土壤pH、有机碳和硝态氮含量是导致东北黑土中氨氧化古菌群落差异的主要因素[39],SUN等[40]施氮后获得了相似的研究结果。
菌群属水平的研究结果表明,抗病品种许多优势菌群的相对丰度高于感病品种,并且在特定时期微生物菌群的相对丰度在抗/感品种间存在显著差异,如在开花后期和结铃期,抗病品种土壤的鞘氨醇单胞菌属、芽单胞菌属和Pontibacter菌群的相对丰度呈显著上升趋势,而感病品种反呈下降趋势,且抗病品种高于感病品种。鞘氨醇单胞菌属菌群与硝态氮、无机磷、pH和有机质呈正相关,而与铵态氮和速效磷呈负相关。芽单胞菌属和Gemmatirosa菌群与硝态氮呈正相关,而与其他理化性质呈负相关。此外,尽管溶杆菌属菌群与硝态氮、无机磷、pH和有机质呈正相关,但抗/感品种间的相对丰度差异不显著。类诺卡氏属菌群与速效磷呈负相关,而红色杆菌属和链霉菌属菌群与速效磷呈正相关;芽球菌属菌群与土壤理化性质不具有相关性;微单孢菌属和Solirubrobacter菌群与铵态氮和速效磷呈负相关。
综合分析抗/感品种在花铃期不同阶段的土壤微生物群落组成与土壤理化性质之间的关系,可为合理施肥提高不同生育时期土壤优势菌群的相对丰度,进而提高植物的抗病性提供科学依据。因此,通过施用不同类型的氮肥(铵态氮型和硝态氮型)来改善土壤特定优势菌群的相对丰度是今后研究的内容之一。此外,土壤温度和湿度亦是重要的环境因子[41-42],其如何对土壤中微生物群落和病原菌数量产生影响亦有待于进一步研究。
4 结论
土壤中大丽轮枝菌的数量与棉花抗/感品种黄萎病发生的相关性存在差异,其中土壤中病原菌数量与感病品种鄂荆1号的发病率和病情指数呈正相关,而与抗病品种冀863相关性不强。抗病品种在盛花期、开花后期和结铃期土壤的细菌群落结构优于感病品种,并且生育时期的优势菌群存在不同程度的差异。土壤中细菌的多样性、相对丰度和组成受有机质、pH、氮素类型、速效磷等指标影响。同时,棉花不同生育时期对土壤中细菌群落结构存在明显影响。

