葡聚糖接枝对大豆蛋白功能特性及结构的影响
任孟珂,布冠好,左颖昕
(河南工业大学粮油食品学院,河南郑州450001)
蛋白质是人体六大营养素之一,能够为人体提供必需氨基酸,对于维持机体代谢、参与组织合成等也具有重要作用。大豆蛋白作为一种氨基酸组成合理、营养价值极高的蛋白质,且赖氨酸的含量较高,是一种理想的植物蛋白资源[1]。另外大豆分离蛋白成本低并且有良好的功能特性,如溶解性,乳化性,凝胶性,起泡性等。这些良好功能性质可以改善食品的风味、颜色、质地和储存稳定性[2]。但天然蛋白质易受物理或化学因素的影响,在加工过程中,大豆分离蛋白的功能特性容易随加工条件的改变而变化,影响其工业化生产效率和收益,不利于产品品质及稳定性,制约蛋白质新产品的开发利用。为拓宽大豆蛋白在食品工业中的应用,国内外许多学者对蛋白质改性进行了多方面的研究,使其在食品行业的应用中达到一种稳定的状态。目前蛋白质改性的主要方法有:物理改性、化学改性及酶法改性等[3-6]。
糖基化改性,即通过美拉德反应改善蛋白质的功能性质[7]。糖基化改性的传统方法有干热法和湿热法两种。经过糖基化改性后,其产物同时具备蛋白质和糖类物质的性质,可有效改善蛋白质的溶解性和持水性[8]。葡聚糖为中性多糖,它的水溶性和稳定性较好,此外葡聚糖还具有清除游离基,溶解胆固醇等功能作用[9]。如今消费者对于蛋白质的营养价值也极为重视。除了蛋白质含量、必需氨基酸模式等评价指标外,蛋白质的消化率也是一项重要的评价指标。本文通过干热法制备大豆分离蛋白(soy protein isolate,SPI)-葡聚糖接枝产物,研究葡聚糖接枝对SPI 功能性质、结构特性以及蛋白质消化率的影响,以期改善大豆蛋白的功能特性,为之后大豆蛋白糖基化产品的开发提供理论依据。
1 材料与方法
1.1 材料
大豆分离蛋白(SPI,蛋白质量分数为84.94%):河南鲲华生物技术有限公司;葡聚糖(分子量10 000 kDa,分析纯):天津市科密欧化学试剂有限公司。
1.2 仪器与设备
LGJ-18 型冷冻干燥机:北京四环科学仪器厂;pH 211 酸度计:意大利 HANNA;DHG-9240A 型电热恒温鼓风干燥箱:上海精宏实验设备有限公司;DYY-6D 型电泳设备:北京市六一仪器厂;WQF-510 型傅里叶红外光谱:北京瑞丽分析仪器有限公司;SHZ-82 恒温水浴振荡器:常州博远实验分析仪器厂;GL-20L 型高速冷冻离心机:上海安亭科学仪器有限公司;FM200 型高速均质机:上海弗鲁克流体机械制造有限公司;BT-9300S 激光粒度分布仪:丹东百特仪器有限公司;F-7000 荧光分光光度计:日立高新技术公司;UV-1901型双光束紫外可见分光光度计:北京普析通用仪器有限公司。
1.3 方法
1.3.1 SPI-葡聚糖的制备
SPI-葡聚糖的制备同之前的研究方法一致[10]。将蛋白与糖按一定比例溶于蒸馏水中,磁力搅拌30 min,使用冷冻干燥机真空干燥。将冻干粉放入恒温培养箱中反应,控制温度50 ℃~60 ℃,相对湿度为79%(饱和KBr 溶液)。所得样品与-20 ℃储存。
1.3.2 接枝度的测定
参考 Pan 等[11]的方法,用邻苯二甲醛(o-phthalaldehyde,OPA)法测定游离氨基酸含量,制作赖氨酸标曲,并计算接枝程度。
1.3.3 褐变程度的测定
参考穆丽霞[12]的方法,在420 nm 下测定吸光值。
1.3.4 溶解性测定
蛋白质浓度测定参照李江河[13]的方法,采用凯氏定氮法测定蛋白质含量。SPI 以及SPI-葡聚糖的溶解性按公式(1)计算。

1.3.5 乳化性测定
参照左颖昕等[14]的葡萄糖接枝对大豆分离蛋白功能特性和结构影响的研究方法测定乳化活性和乳化稳定性。
1.3.6 乳状液粒径测定
参照1.3.5 中的方法制备乳化液,通过激光粒度分布仪测定粒度分布。选用D10,D50,D90作为粒径评价指标。仪器参数设置为:大豆油的折光率为1.456,分散相的折光率为1.33,乳液的相对折光率为1.095,用单蒸水作为分散相。
1.3.7 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
采用Laemmli[15]的方法并稍作修改,接枝物质量浓度为3 mg/mL,使用12%的分离胶和5%的浓缩胶,分别使用考马斯亮蓝R-250 和Schiff 碱试剂进行蛋白质和糖蛋白染色(periodic acid-schiff stain,PAS)[16]。
1.3.8 傅里叶红外光谱分析
准确称取质量比为1 ∶100 的糖基化样品及干燥的溴化钾,用傅里叶红外光谱仪测定,波数范围为4 000 cm-1~400 cm-1内的吸收光谱,扫描 32 次,环境温度25 ℃[17]。使用PeakFit4.12 分析蛋白质二级结构的变化。
1.3.9 荧光光谱分析表面疏水性
将8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)作为荧光探针测定蛋白质的表面疏水性,用0.01 mol/LpH7.0 磷酸盐缓冲液作为溶剂,配制一定浓度的糖基化产物溶液,后稀释至蛋白质量浓度分别为0.02 mg/mL~0.14 mg/mL 之间的6 组样品,取20 μL8.0 mmol/L ANS 溶液(用 0.01 mol/L pH7.0 磷酸盐缓冲液完全溶解)与4 mL 不同质量浓度的样品溶液混合后用荧光分光光度计测定样品的荧光强度。仪器参数设置:激发波长390 nm;散射波长470 nm。以荧光强度为纵坐标、蛋白质量浓度为横坐标所作曲线的斜率即为蛋白质的表面疏水性指数[18]。
1.3.10 体外消化率的测定
大豆蛋白糖基化产物的体外消化率测定采用胃蛋白酶-胰蛋白酶体外消化模型。操作方法如下:
1)三氯乙酸-氮溶指数(trichloroacetic acid-nitro gensolutionindex,TCA-NSI)法[19]测定消化率。取 5mL 不同消化液于 5 mL10%TCA 中,4 000 r/min 离心 20 min,沉淀用10%TCA 洗涤2 次,离心得到TCA 不溶组分。TCA 不溶性氮含量采用凯氏定氮法GB5009.5-2016《食品安全国家标准食品中蛋白质的测定》测定。TCA的作用是使大分子蛋白质沉淀。
2)准确称取一定质量的糖基化复合物溶于蒸馏水,配制一定体积的底物浓度为50 g/L 的溶液,37 ℃水浴中预热5 min,用1 mol/L 的HCl 调溶液pH 值至3.0。加入与底物质量比为1 ∶100 的胃蛋白酶,在37 ℃恒温振荡器上反应2 h,样品煮沸灭酶后用TCA 法测消化率。
3)取2)中用胃蛋白酶消化2 h 后灭酶处理的蛋白样品,用1 mol/L 的NaOH 溶液调pH 值至7.0 终止酶解反应,加入与底物质量比为1 ∶100 的胰蛋白酶,在37 ℃恒温振荡器上反应2 h,样品煮沸灭酶后用TCA法测消化率。
4)将未发生糖基化反应的大豆蛋白在相同条件下做同样处理,探究糖基化改性作用对大豆蛋白消化率的影响。
5)TCA 沉淀法测定大豆蛋白-多糖复合物体外消化率的计算见公式(2):
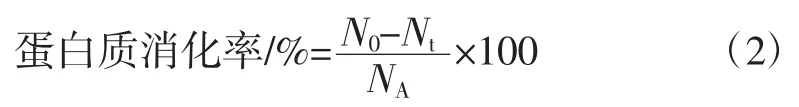
式中:N0、Nt分别为消化前、消化后样品TCA 沉淀物中的氮含量,mg;NA为蛋白质样品中的总氮含量,mg。
2 结果与分析
2.1 SPI-葡聚糖接枝反应程度的研究
不同反应条件对糖基化复合物反应程度的影响见图1。
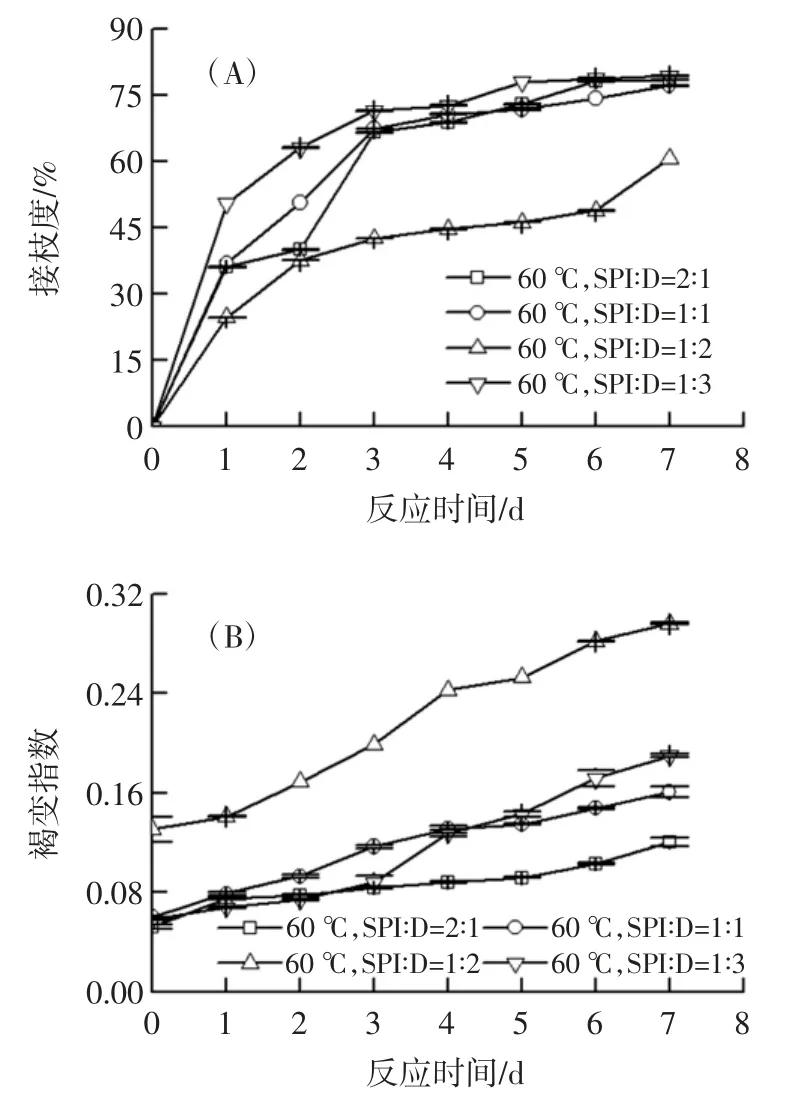
图1 底物质量比和反应时间对复合物接枝度与褐变程度的影响Fig.1 Effect of substrate mass ratio and reaction time on grafting degree and browning degree of composite
从图1(A)可以看出,在60 ℃及不同底物质量比条件下,SPI-葡聚糖的接枝度随反应时间的增加而变化,尤其在0~3 d 内迅速增加,3 d 后增长趋势变缓。其中蛋白与糖底物质量比为2 ∶1 的产物接枝度在3 d 后呈现继续上升的稳定趋势,3 d 时达到66.52%,反应终点7 d 达到78.42%。不同底物质量比的SPI-葡聚糖随反应时间的褐变程度变化如图1(B)所示,底物质量比为2 ∶1 的反应体系褐变程度较低,随着反应时间的增加,褐变程度变化趋势平稳。通过研究相同反应温度条件下,不同质量底物比和反应时间对SPI-葡聚糖糖基化反应的影响,发现在反应温度60 ℃,蛋白与糖底物质量比为2 ∶1 的反应条件下,其糖基化接枝度较高,而褐变较低。因此,选择此条件下的大豆分离蛋白糖基化产物进行下一步研究。
2.2 SPI-葡聚糖接枝物功能特性的研究
2.2.1 SPI-葡聚糖接枝产物的溶解性
2.2.1.1 反应时间对糖基化产物溶解性的影响
未改性的SPI 和不同反应时间得到的SPI-葡聚糖接枝物的溶解度见图2。
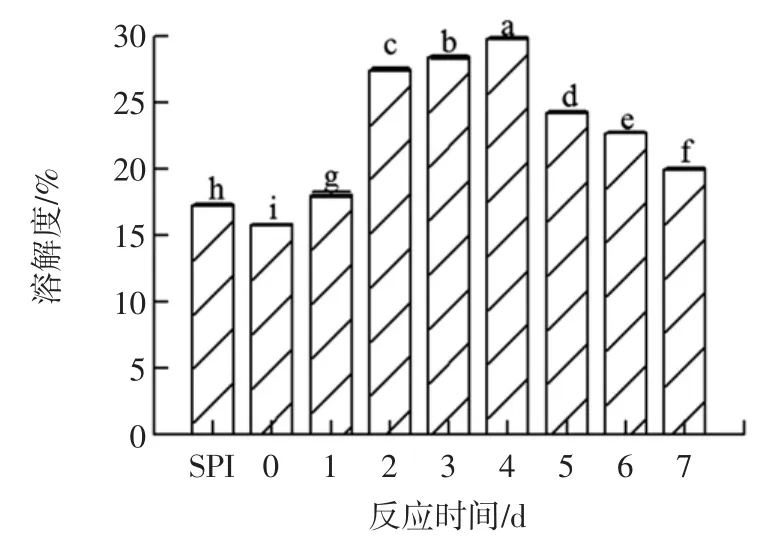
图2 不同反应时间下SPI-葡聚糖接枝产物的溶解性Fig.2 Solubility of SPI-glucan grafted product at different reaction times
由图2 可知,SPI 的溶解度在未改性时为17.28%。随着反应时间增加,SPI 的溶解性有显著变化,在4 d时达到最大值,与空白组相比,溶解性提高了72.72%。其原因可能是由于引入了羟基等亲水基团,因此溶解性提高,这与王一熹[20]的研究结果基本一致。
2.2.1.2 pH 值对糖基化产物溶解性的影响
根据2.2.1.1 中糖基化修饰对SPI 溶解性的改善效果,选择以下效果较好的样品:反应2、3、4 d 的SPI-葡聚糖样品,分别研究不同pH 值对SPI-葡聚糖溶解性的影响,结果如图3 所示。
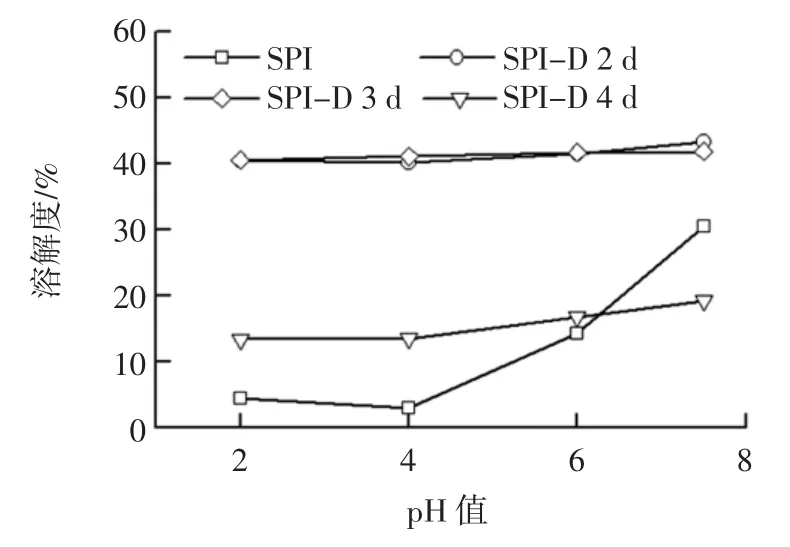
图3 不同pH 值对SPI-葡聚糖复合物溶解性的影响Fig.3 Effect of different pH values on the solubility of SPI-glucan complex
由图3 可知,未改性 SPI 在等电点 pI4~5 附近,溶解度明显下降,当pH 值远离pI 时,溶解度有所提高。此外,图3 也表明了糖基化产物在碱性环境下溶解度高,随着pH 值降低溶解度逐渐减小。SPI 与葡聚糖经糖基化修饰2 d 和3 d 后的产物在各pH 值条件下的溶解度均高于未改性SPI,且等电点处的溶解度有明显改善,证明了糖链的引入对SPI 的溶解性有积极作用。与对照SPI 相比,SPI-葡聚糖复合物的溶解度随pH 值降低的变化趋势要相对平缓,说明糖基化反应提高了SPI 的抗酸能力,这与赖颖等[21]的研究结果相符。
2.2.2 SPI-葡聚糖接枝产物的乳化性
2.2.2.1 糖基化修饰对大豆蛋白乳化活性和乳化稳定性的影响
SPI 和不同反应时间的SPI-葡聚糖接枝产物的乳化活性和乳化稳定性见图4。
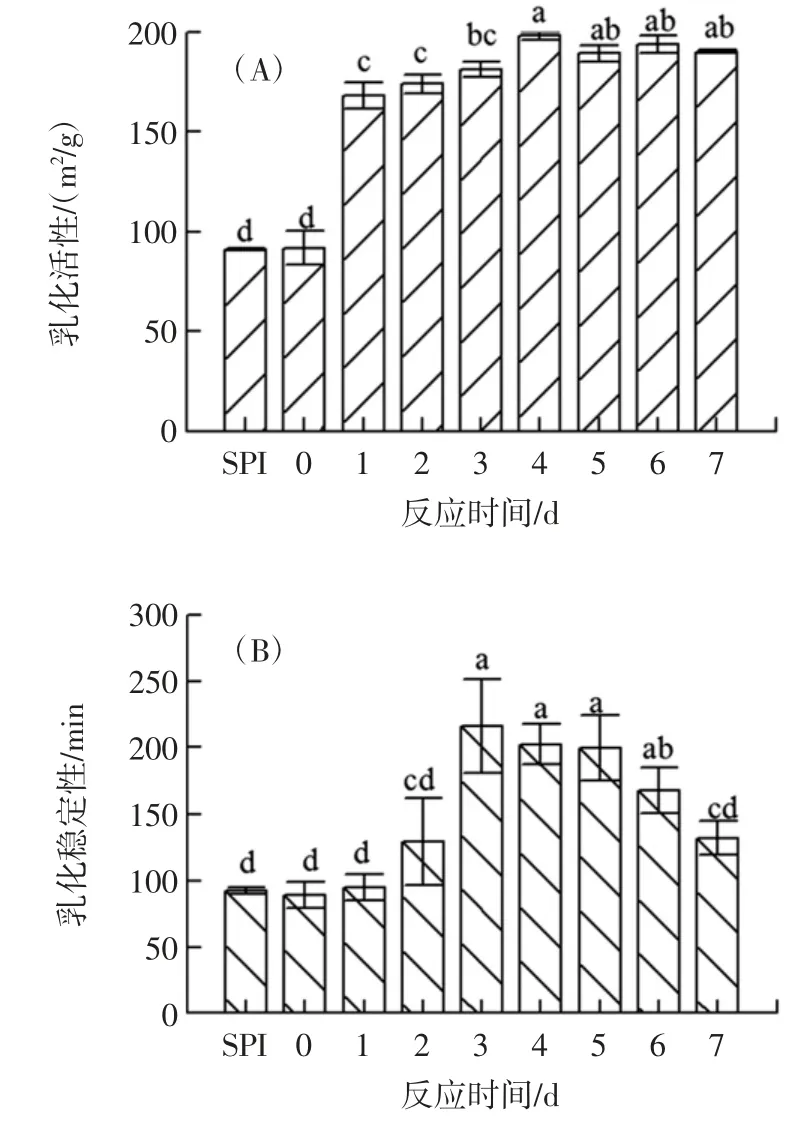
图4 不同反应时间下SPI-葡聚糖的乳化活性和乳化稳定性Fig.4 Emulsification activity and emulsion stability of SPI-glucan under different reaction times
如图4(A)所示,与对照组相比,SPI-葡聚糖的乳化活性随着反应时间呈现先增加后降低直至稳定的趋势;SPI-葡聚糖的乳化活性4 d 达到最大值198.12 m2/g,与空白SPI 相比,乳化活性提高了117.53%。分析图4(B)可知,SPI-葡聚糖的乳化稳定性先增加后减小,3 d 时达到最大值215.90 min,相比空白对照,乳化稳定性提高了134.20%,表明葡聚糖接枝对大豆分离蛋白乳化性有明显改善。原因可能是增大了吸附在油-水界面处油滴上的蛋白质与糖链结合形成的保护层厚度,使油滴更不易聚集,因此葡聚糖对大豆蛋白的乳化性质有改善效果[22]。
2.2.2.2 糖基化修饰对大豆蛋白乳化液粒径的影响
表1 为SPI 糖基化产物乳化液的粒度分布。
分析表1 发现,与空白对照相比,SPI 糖基化产物乳化液的D10、D50和D90均有所减小,说明糖基化产物在水溶分散系中均匀分布,有利于蛋白质的乳化性质[23]。结合图4 可以看出,乳化液粒径减小的趋势和其乳化性提高趋势呈现负相关的联系。粒径越小,相对应的乳化性质越好。这一结果与Yang 等[24]的研究结果相符。粒径的结果也表明了糖基化修饰可以改善大豆蛋白的乳化性质,其原因可能是引入蛋白质肽链上的糖基提供的空间位阻可有效阻止油滴的聚合[25]。
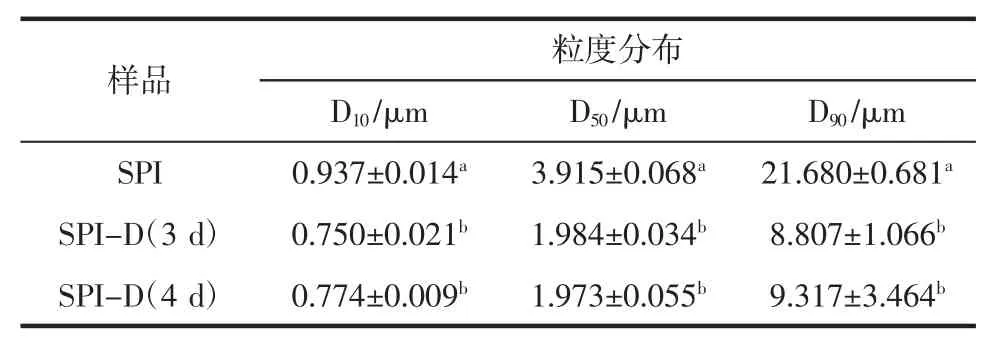
表1 大豆分离蛋白及其糖基化产物乳化液的粒度分布Table 1 Particle size distribution of soy protein isolate and its glycosylation product emulsion
2.3 SPI-葡聚糖接枝产物结构特性研究
2.3.1 SDS-PAGE 分析接枝产物分子量变化
不同反应时间得到的SPI-葡聚糖接枝产物的电泳图谱如图5 所示。
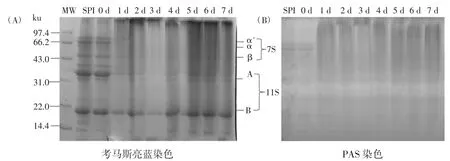
图5 不同反应时间下糖基化产物的电泳图Fig.5 Electropherogram of glycosylated products at different reaction times
图5(A)为考马斯亮蓝染色,图5(B)为糖蛋白染色(Schiff 试剂)。由图 5(A)可知,与未改性的 SPI 相比,在反应初期(0~3 d),随着反应时间的延长,糖基化产物的各亚基条带逐渐减弱;反应4 d 之后蛋白质与葡聚糖结合明显,有相对分子量大的复合物生成,且浓缩胶与分离胶区域出现较多高分子量物质,这与接枝度测定的结果相符。观察图5(B)可知,随着时间的延长,在高分子量区域颜色变深,这说明有大分子物质在此处聚集,即SPI 与葡聚糖分子之间产生共价结合,生成了相对分子量较大的物质。证明了SPI 与葡聚糖发生了糖基化反应。
2.3.2 傅里叶红外光谱分析接枝产物二级结构变化
图6 为大豆蛋白及其糖基化复合物的红外图谱。与未改性SPI 相比,糖基化产物在3 200 cm-1~3 700 cm-1范围内吸收峰变宽,证明了SPI 与葡聚糖共价结合之后,复合物的羟基数量增加,引起了C-OH 的伸缩振动[17];糖基化产物在 1 000 cm-1~1 260 cm-1,1 350 cm-1~1 500 cm-1的吸收峰的强度增加,说明了糖基化反应的发生引起了C-N、C-H 和C=O 键的伸缩振动的增加[26],这与 Mohsin 等[27]和 Fu 等[28]研究结果基本一致。
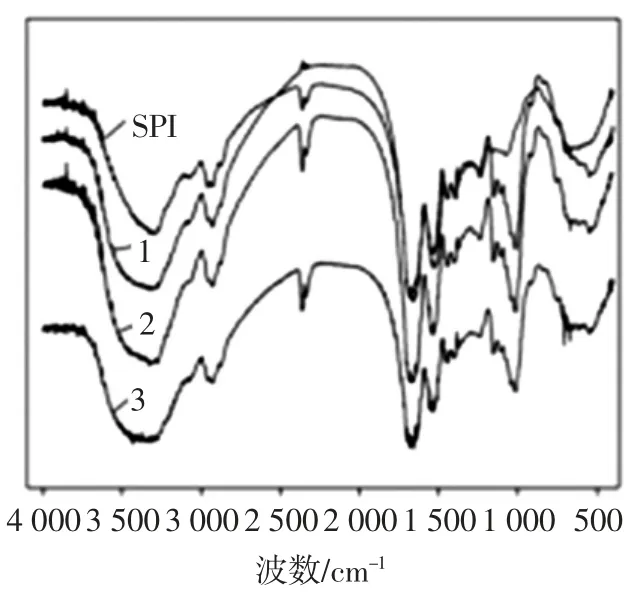
图6 SPI 及SPI-葡聚糖接枝产物的红外扫描图谱Fig.6 Infrared scanning spectrum of SPI and SPI-glucan graft products
蛋白质特征吸收谱带中的酰胺Ⅰ带(1 600 cm-1~1 700 cm-1)可以反映蛋白质二级结构的变化,参考Chen 等[29]的研究,α-螺旋、β-折叠、β-转角、无规卷曲产生伸缩振动的吸收峰选取范围分别为1 650 cm-1~1 660 cm-1、1 610 cm-1~1 640 cm-1、1 660 cm-1~1 700 cm-1、1 640 cm-1~1 650 cm-1。利用 PeakFit 4.12 软件进行去卷积二阶导数拟合计算分析SPI-葡聚糖复合物二级结构含量的变化如表2 所示。
由表2 可知,与对照SPI 相比,糖基化改性后,大豆蛋白的α-螺旋和β-转角的含量减少,而β-折叠和无序结构的含量增加,说明糖基化反应对大豆蛋白的二级结构有显著影响。原因可能是糖链的引入使蛋白质肽链展开,内部基团暴露,蛋白质的空间构象发生改变。此外反应后蛋白质的构象逐渐由有序转变为无序,蛋白质分子伸展,产物的柔韧性增加,构象稳定性有所下降,进而改善了接枝产物的功能特性,这与穆利霞[12]的研究结果相符。
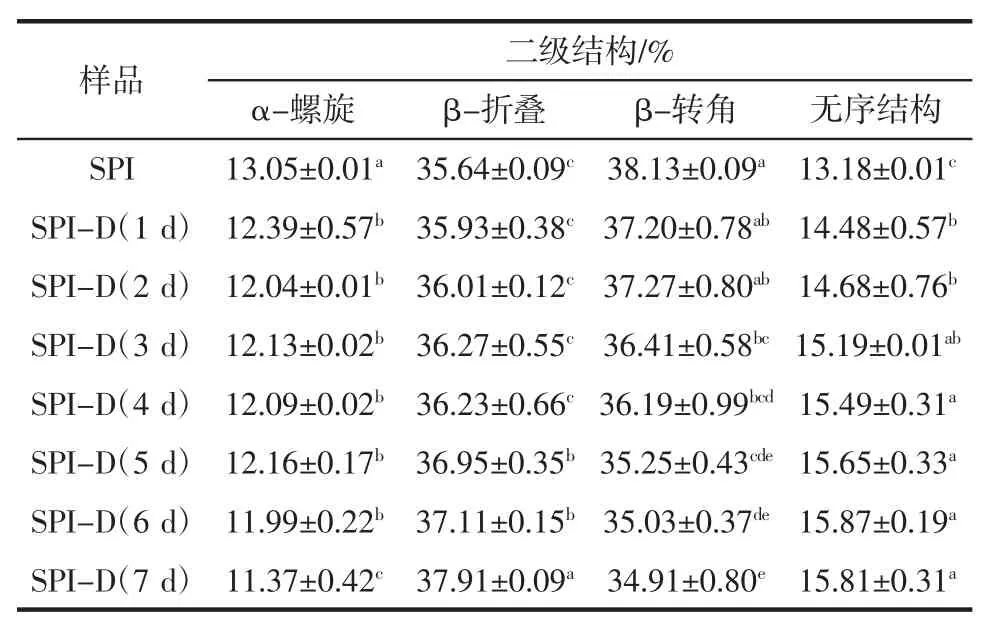
表2 大豆蛋白二级结构含量变化Table 2 Changes in the secondary structure content of soybean protein
2.3.3 糖基化产物的表面疏水性
大豆蛋白糖基化产物的表面疏水性结果如表3所示。
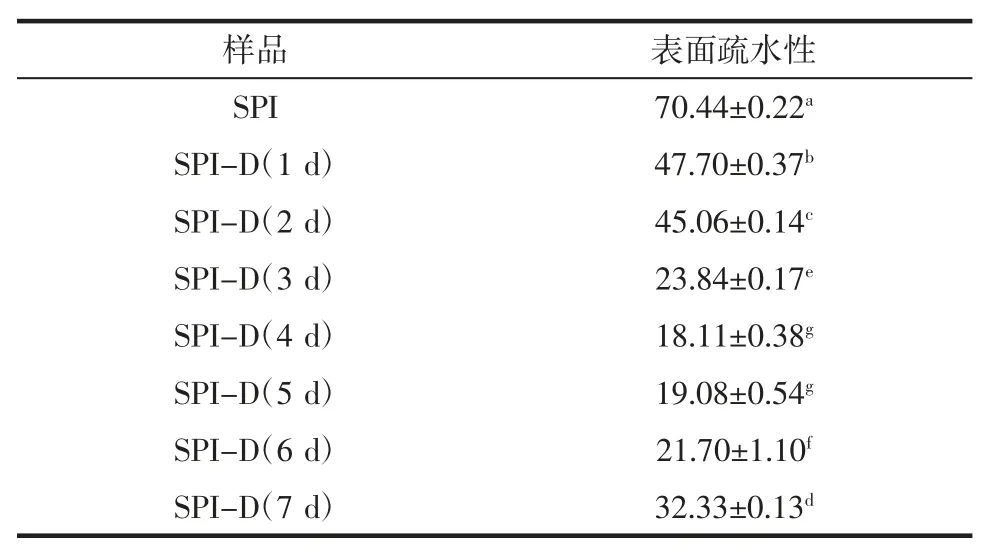
表3 大豆蛋白及其糖基化产物的表面疏水性Table 3 Surface hydrophobicity of soy protein and its glycosylation products
从表3 中可以看出随着糖基化反应的进行,产物的表面疏水性呈现先显著降低后缓慢增加的趋势,原因可能是:ANS 探针与蛋白质的疏水基团特异性结合,随着糖基化反应的进行,大豆蛋白部分结构展开,内部疏水基团暴露,然而糖基化产物实际测定的表面疏水性是降低的,这说明蛋白质与糖共价结合,引入亲水基团如羟基等,使产物表面亲水性增强,疏水性降低;同时由于糖基接入产生的空间位阻效应使分子内部的疏水基团不能完全暴露,也对表面疏水性起到一定降低作用。反应后期表面疏水性逐渐增加的原因可能是随着反应时间的延长,分子内部结构逐渐展开,更多疏水基团暴露出来,而接枝度变化已趋于稳定,空间位阻效应减弱,导致产物表面疏水性略有增加。进一步分析发现,糖基化产物表面疏水性的变化与2.2.1.1 中产物溶解度变化呈现负相关的趋势,这一点与刘春雷等[30]的结论一致。
2.4 大豆分离蛋白-葡聚糖的体外消化性研究
图7 表示SPI 及不同反应时间的大豆分离蛋白-葡聚糖复合物的体外消化性。
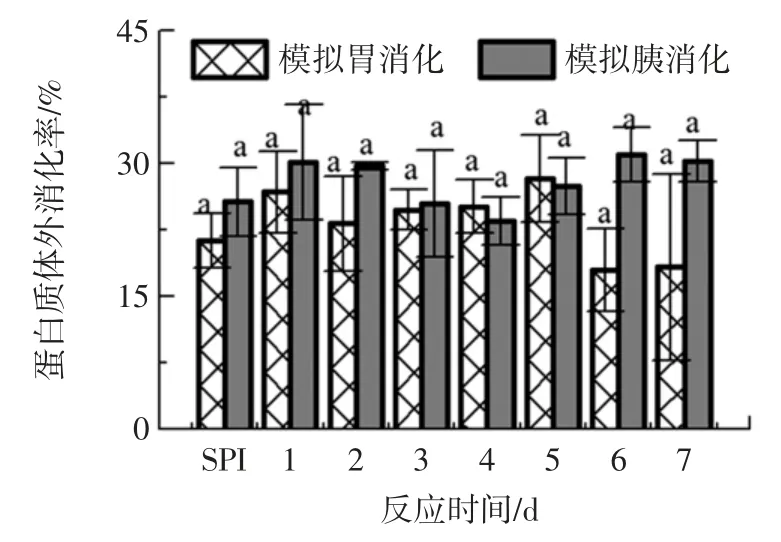
图7 SPI 及不同反应时间的SPI-葡聚糖复合物的体外消化性Fig.7 In vitro digestibility of SPI and SPI-glucan complexes with different reaction times
分析可知,在模拟胃肠道消化过程中,SPI-D 的体外消化率随着糖基化反应时间的变化呈现波动的趋势。大豆分离蛋白-葡聚糖在反应后期6、7 d 时胃消化率稍低于未改性的SPI,其它反应时间点的大豆分离蛋白-葡聚糖胃消化率有一定增加。大豆分离蛋白-葡聚糖在反应时间3、4 d 时胰消化率稍低于未改性的SPI,其它反应时间点的胰消化率有一定增加。说明葡聚糖糖基化修饰对大豆分离蛋白体外消化率的影响不显著。原因可能是葡聚糖作为一种多糖,引入到蛋白分子上的糖链分子量大,空间结构复杂,降低了消化酶的酶解位点的暴露,从而影响了大豆分离蛋白-葡聚糖的消化率。因此,葡聚糖糖基化修饰对SPI 体外消化率没有明显改善作用。
3 结论
本研究以大豆分离蛋白和葡聚糖为原料,通过干热法进行糖基化反应。结果表明,反应温度60 ℃,蛋白与糖底物质量比为2 ∶1,糖接枝产物的接枝效果好,褐变程度中等。在SPI-D 反应4 d 后,溶解性提高了72.72%;SPI-D 反应3 d 后,乳化活性和乳化稳定性分别提高了117.53%和134.20%;说明糖基化可以显著改善大豆分离蛋白的功能特性。SDS-PAGE 结果表明,随着时间的延长,在高分子量区域条带颜色变深,这说明有大分子物质在此处聚集,证明了大豆分离蛋白与葡聚糖发生了共价结合。通过红外光谱分析与对照SPI相比,糖基化改性后,大豆蛋白的α-螺旋和β-转角的含量减少,而β-折叠和无序结构的含量增加,说明糖基化反应对大豆蛋白的二级结构有显著影响。荧光光谱分析表明,产物的表面疏水性呈现先显著降低后缓慢增加的趋势。此外,葡聚糖糖基化修饰对SPI 体外消化性的改善效果不明显。该研究为拓宽大豆蛋白的应用范围及开发大豆蛋白新制品提供重要的理论依据。

