三种专用固相萃取柱-高效液相色谱法检测食品中苏丹红含量
冯寅洁1,周小清1,乔勇升1,冯成玉
(1.江苏省泰州市食品药品检验所,江苏泰州 225300;2.江苏省海安市农业农村局,江苏海安 226600)
苏丹红是一类以苯基偶氮萘酚为主要基团的偶氮化合物,主要有苏丹红Ⅰ、Ⅱ、Ⅲ、Ⅳ。化学名分别为1-苯基偶氮-2-萘酚、1-[(2,4-二甲基苯)偶氮]-2-萘酚、1-[4-(苯基偶氮)苯基]偶氮-2-萘酚、1-2-甲基-4-[(2-甲基苯)偶氮]苯基偶氮-2-萘酚,结构见图1。这类化合物不溶于水,微溶于乙醇,易溶于丙酮、苯、乙醚、正己烷、油脂等。苏丹红属于人工合成的红色染料,主要用于溶剂、油、蜡、地板、鞋等的增色和增光。
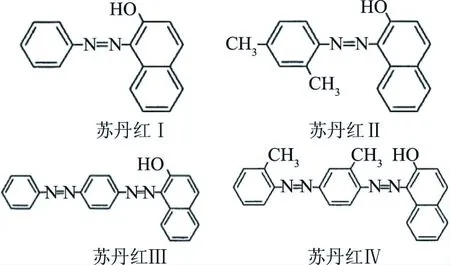
图1 苏丹红Ⅰ、Ⅱ、Ⅲ和Ⅳ结构图Fig.1 Structure of Sudan dyes
1995年,欧盟等国家已禁止苏丹红作为食品用色素。但是自从2005年,多家知名跨国公司和国内企业产品如辣椒酱、辣椒粉、新奥尔良烤翅、鸭蛋等食品中被检出苏丹红。在多项体外试验中发现苏丹红进入人体内,可代谢生成苯胺类和萘胺类物质,这些胺类物质具有致突变性和致癌性[1]。国际癌症研究机构(IARC)将苏丹红Ⅰ、Ⅱ、Ⅲ、Ⅳ列为三类致癌物,即动物致癌物。2005年4月,卫生部发布《苏丹红危险性评估报告》中指出,如果经常摄入含较高剂量苏丹红的食品会增加其致癌的危险性,特别是由于苏丹红的代谢产物是人类可能致癌物,目前对这些物质尚没有耐受摄入量,因此应尽可能避免摄入这些物质[2]。国家先后发布《食品中可能违法添加的非食用物质和易滥用的食品添加剂品种名单》第一批和第五批,将苏丹红列为严禁添加的非食用物质。针对苏丹红非食品中天然存在的物质,并且曾在食品中检出的问题,苏丹红检测一直是职能部门监督抽查和风险监测工作的重点。2019年国家食品安全抽检实施细则规定,香辛料油、辣椒及其制品、花椒及其制品、含辣椒的酱腌菜及蔬菜干制品、蛋制品、原料中添加蛋的糕点等食品必须检测苏丹红。
检测苏丹红的方法主要有酶联免疫法[3]、表面增强拉曼光谱法[4]、红外光谱法[5]、薄层色谱法[6]、液相色谱法[7-8]、液质联用法[9]等。GB/T 19681-2005[10]前处理采用自行填充的中性氧化铝层析柱,使用前需根据苏丹红的回收率调整氧化铝活度,对检测人员经验要求较高,平行性和准确度欠佳,并且耗费大量有机溶剂。这些问题导致国标方法不能适应现今大批量检测的快速、准确、便捷、节省试剂等要求。为提高实验效率,目前多采用商业化固相萃取柱(SPE柱)对食品进行净化和目标物的富集,可以在苏丹红检测中起到除杂和富集目标物作用的固相萃取柱有中性氧化铝固相萃取柱[11]、C18固相萃取柱[12]、硅胶柱[13]、分子印迹柱[14]、SAX柱[15]等,但是经过实验发现,通用型SPE柱的加标回收率偏低,而分子印迹柱仅针对某一种苏丹红。本文采用几种商业化苏丹红专用固相萃取柱,按照相应的方法进行前处理,通过高效液相色谱检测,比较苏丹红加标回收率和色谱图,确定适用于不同种类食品中苏丹红检测的方法,以期获得操作简单、溶剂耗费少、回收率高,适合于日常批量检测的苏丹红检测方法。
1 材料与方法
1.1 材料与仪器
苏丹红Ⅰ(纯度98.5%)、苏丹红Ⅱ(纯度99.6%)、苏丹红Ⅲ(纯度94.8%)、苏丹红Ⅳ(纯度99.6%) 德国Dr. Ehrenstorfer公司;正己烷、异丙醇、甲醇、乙腈 均为色谱纯,德国MERCK公司;二氯甲烷、丙酮、甲基叔丁基醚 均为分析纯,国药集团化学试剂有限公司;Cleanert Sudan固相萃取柱(A柱,500 mg/6 mL) 天津博纳艾杰尔科技有限公司;ProElut SDH固相萃取柱(B柱,500 mg/6 mL) 天津迪马科技有限公司;CNW Poly-sery MIP-SDR 固相萃取柱(C柱,500 mg/6 mL) 上海安谱实验科技股份有限公司;辣椒粉、辣椒油、番茄酱、咸鸭蛋、辣条、鸡蛋糕 均为市售。
DIONEX UltiMate 3000高效液相色谱仪串联二极管阵列检测器 美国Thermo Fisher Scientific公司;XS 204电子天平 梅特勒-托利多仪器上海有限公司;Mili-Q Reference超纯水机 美国Millipore公司;VORTEX 2旋涡混匀器 德国IKA公司;JP-100结盟牌超声波清洗机 深圳市结盟清洗设备有限公司;LD5-2B低速离心机 北京雷勃尔医疗器械有限公司;RV 10 basic旋转蒸发仪 德国IKA公司。
1.2 实验方法
1.2.1 样品前处理
1.2.1.1 苏丹红提取 辣椒粉:称取0.5 g试样于50 mL离心管中,加入10 mL正己烷混合1 min,超声提取5 min,5000 r/min离心5 min,将上清液转移至50 mL旋蒸瓶中,残留物用10 mL正己烷重复提取1次,合并上清液,在40 ℃水浴中减压旋蒸至近干,再加入5 mL正己烷混匀,待净化。
辣椒油:称取0.5 g试样与50 mL离心管中,后续处理方法同辣椒粉。
番茄酱:称取1.0 g试样于50 mL离心管中,加入1 mL水混合1 min,再加入10 mL正己烷混合1 min,后续处理方法同辣椒粉。
咸蛋黄、辣条、鸡蛋糕:称取1.0 g试样于50 mL离心管中,后续处理方法同辣椒粉。
1.2.1.2 固相萃取柱净化和富集 参考各SPE柱的操作说明。
A柱操作方法:依次加入5 mL二氯甲烷、5 mL正己烷活化SPE柱;将待净化液上样,用6 mL正己烷分两次洗旋蒸瓶,一并上样;用3 mL异丙醇-正己烷(体积比3∶97)溶液淋洗,然后将SPE柱抽干;加入10 mL二氯甲烷洗脱,收集洗脱液于25 mL旋蒸瓶;在40 ℃水浴中减压旋蒸至干,准确加入2 mL甲基叔丁基醚-甲醇(体积比4∶6)溶液溶解残渣,过0.22 μm滤膜,待液相检测。
B柱操作方法:用5 mL正己烷活化SPE柱,将待净化液上样,用6 mL正己烷分两次洗旋蒸瓶,一并上样;依次用5 mL正己烷、5 mL乙酸乙酯-正己烷(体积比1∶99)溶液淋洗,然后将SPE柱抽干;加入10 mL乙酸乙酯-正己烷(体积比3∶7)溶液洗脱,后续处理方法同A柱操作方法。

图2 苏丹红标准溶液光谱图Fig.2 Spectrogram of Sudan dyes standard solution
C柱操作方法:依次加入5 mL二氯甲烷、5 mL正己烷活化SPE柱;将待净化液上样,用6 mL正己烷分两次洗旋蒸瓶,一并上样;用5 mL正己烷淋洗,然后将SPE柱抽干;加入10 mL二氯甲烷洗脱,后续处理方法同A柱操作方法。
1.2.1.3 固相萃取柱的比较 按照1.2.1.1提取四种苏丹红的加标水平均为2.0 mg/kg的样品,参照A、B、C柱的操作方法对提取液进行净化和富集,通过液相色谱检测比较各SPE柱处理组的加标回收率。
1.2.2 苏丹红标准溶液的配制 标准储备液:按照纯度折算,分别称取苏丹红Ⅰ10.15 mg、苏丹红Ⅱ10.04 mg、苏丹红Ⅲ10.55 mg、苏丹红Ⅳ10.04 mg于50 mL烧杯中,先加入少量乙醚将苏丹红完全溶解,再用正己烷溶解转移至250 mL容量瓶中,加正己烷定容,得到浓度为40 μg/mL的苏丹红混合标准储备液。
标准工作液:吸取混合标准储备液0.1、0.2、0.4、0.8、1.6 mL于5只25 mL容量瓶中,用甲基叔丁基醚-甲醇(体积比4∶6)溶液定容,配制成浓度分别为0.16、0.32、0.64、1.28、2.56 μg/mL苏丹红Ⅰ、Ⅱ、Ⅲ、Ⅳ混合标准工作液。
1.2.3 液相色谱条件 Symmetry C18色谱柱(150 mm×4.6 mm,5 μm);Hypersil GOLD AQ保护柱(10 mm×4 mm,5 μm)。流动相:溶剂A为乙腈,溶剂B为水。梯度洗脱:0~12 min,85% A~100% A,15% B~0% B;12~18 min,100% A;18~19 min,100% A~85% A,0% B~15% B;19~22 min,85% A,15% B。流速:1.0 mL/min。进样体积:20 μL。柱温:30 ℃。二极管阵列检测器扫描波长:190~800 nm;苏丹红Ⅰ检测波长:478 nm;苏丹红Ⅱ、Ⅲ、Ⅳ检测波长:520 nm。
1.3 数据处理
每个处理6次平行。借助Thermo Scientific Dionex Chromeleon 7色谱数据系统对样品色谱图进行定性和定量分析,相同处理组数据通过Excel软件计算平均值和相对标准偏差。
2 结果与分析
2.1 检测波长的选择
二极管阵列检测器采集苏丹红Ⅰ、Ⅱ、Ⅲ、Ⅳ混合标准工作液在190~800 nm光谱图如图2。苏丹红在400~800 nm 可见光区均有吸收,最大可见光吸收波长分别为477.39、491.12、503.91、512.81 nm,苏丹红Ⅰ与苏丹红Ⅱ、Ⅲ、Ⅳ的最大可见光吸收波长相差较大。有文献采取同一检测波长检测苏丹红Ⅰ~Ⅳ[16],也有采取苏丹红Ⅰ与苏丹红Ⅱ、Ⅲ、Ⅳ不同的检测波长[17]。考虑到工作中需优先采用国家标准进行检测,以及与其他检测机构出具的报告数据具有可比性,本实验采用与GB/T 19681-2005一致的检测波长,苏丹红Ⅰ检测波长为478 nm,苏丹红Ⅱ、Ⅲ、Ⅳ检测波长为520 nm。
2.2 色谱条件的选择
实验选用C18柱对样品进行分离。GB/T 19681-2005采用0.1%甲酸的水溶液∶乙腈(体积比85∶15)为溶剂A,0.1%甲酸的乙腈溶液∶丙酮(体积比80∶20)为溶剂B,通过梯度洗脱对四种苏丹红进行分离,单次进样时间为40 min。采用国标方法,每次检测前需根据进样数计算流动相用量,流动相不够时需再次配制,耗费一定时间。同时,混合有酸、水和有机溶剂的流动相具有不稳定性,再加上梯度洗脱,容易导致苏丹红保留时间的重现性不理想。实验发现,采取常用的流动相乙腈和水分别作为溶剂A和溶剂B,不需要进行流动相的配制,再通过梯度洗脱,也可以实现四种苏丹红的完全分离,并且进样时间缩短至22 min。2.56 μg/mL苏丹红混合标准溶液的色谱图如图3所示。按照摸索后确定的梯度洗脱条件运行,苏丹红保留时间的重现性较好。

表1 苏丹红的线性回归方程、线性范围和相关系数Table 1 Linear regression equations,linear ranges and correlation coefficients
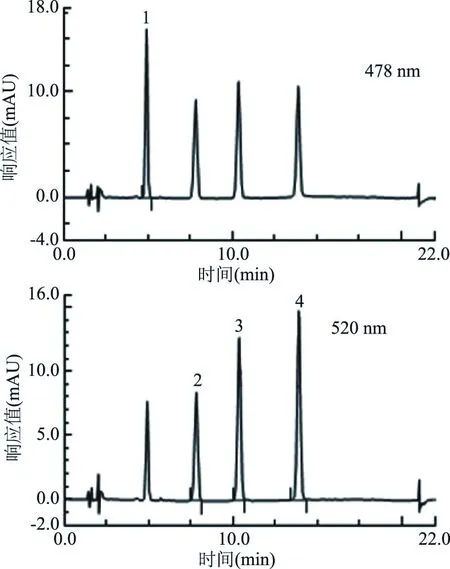
图3 苏丹红混合标准溶液色谱图Fig.3 Chromatogram of sudan dyes mixed standard solution注:1:苏丹红Ⅰ;2:苏丹红Ⅱ;3:苏丹红Ⅲ;4:苏丹红Ⅳ。
2.3 标准曲线、线性范围及检出限
将配制的混合标准溶液0.16~2.56 μg/mL按浓度由低到高依次进样。以峰面积Y(mAu·min)对相应的浓度X(μg/mL)进行线性回归,得到方程见表1。对空白样品加标,按照1.2.1.1和1.2.1.2 B柱操作方法进行处理,得到不同食品基质的苏丹红Ⅰ、Ⅱ、Ⅲ、Ⅳ检出限(S/N=3),如表2所示。方法检出限与食品种类、称样量、试剂、SPE柱、最终样液定容体积、仪器噪声等有关。辣椒粉、辣椒油的称样量为0.5 g,其余样品的称样量为1 g,而辣椒油空白样品的噪音值比辣椒粉略大,因此在6种食品中,辣椒油中苏丹红的检出限最高,其次是辣椒粉;称样量均为1 g的食品中,咸蛋黄空白样品的噪音值比其他空白样品略大,检出限低于辣椒粉,其余三种样品的称样量和噪音值相同,检出限也相同。
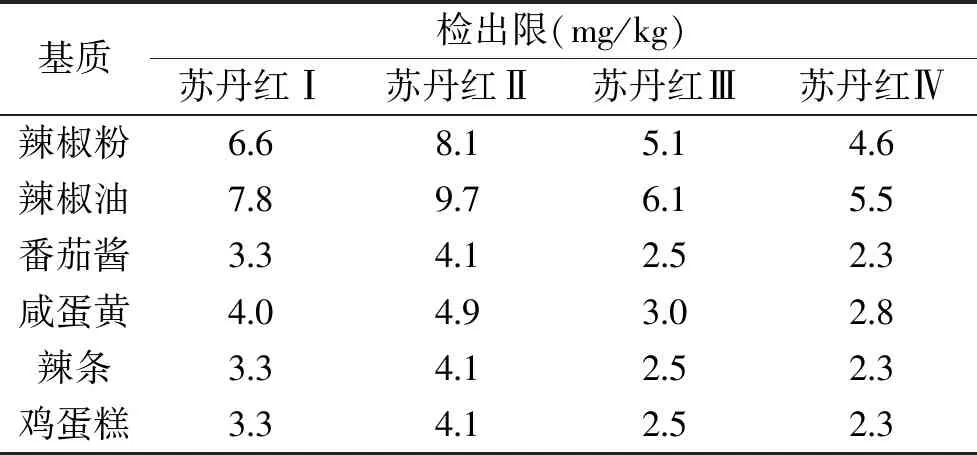
表2 苏丹红的检出限Table 2 Detection limits of Sudan dyes
2.4 溶液提取次数的选择
前处理过程中使用的提取溶剂有正己烷[18-20]、丙酮[21]、乙腈[12]、乙酸乙酯[22]等,采用正己烷提取,可以较好地将这种油溶性染料从食品中溶解出来;同时在本实验中,正己烷是SPE柱的活化试剂,因此以正己烷为提取液,有利于加快在SPE柱的上样速率。在咸蛋黄中加标2.0 mg/kg,分别用正己烷(10 mL×2次)和正己烷(10 mL×3次)提取,通过B柱净化后检测,四种苏丹红的加标回收率为85.2%~97.9%和84.3%~95.9%。在番茄酱中加标2.0 mg/kg,分别用正己烷(20 mL×2次)和正己烷(20 mL×3次)提取,B柱净化后检测,四种苏丹红的加标回收率为85.6%~98.3%和85.8%~92.1%。正己烷提取2次和3次的回收率差别不大,因此选择提取2次。
2.5 固相萃取柱的比较
在番茄酱、咸蛋黄中加标2.0 mg/kg,按照1.2.1.1提取后,分别借助SPE柱A、B、C进行净化和富集,每个处理6次平行,通过液相检测比较不同SPE柱处理组的加标回收率,结果见图4。实验发现,A柱处理咸鸭蛋加标样品,苏丹红Ⅱ回收率为73.1%~83.8%,相对标准偏差(RSD)为5.0%;A柱处理番茄酱加标样品,苏丹红Ⅱ回收率为71.9%~88.4%,RSD为7.6%。在实际操作中,对于深色样品如番茄酱,需要多次添加正己烷洗下旋蒸瓶内的残渣后上样,直至旋蒸瓶内溶液无色;对于含油高的样品如咸蛋黄,上样后需要增加淋洗溶液异丙醇-正己烷以去除填料中的油脂,否则洗脱液中将含有较多油脂。A柱处理加标样品,上样溶液和淋洗溶液的增多会导致被SPE柱吸附的苏丹红Ⅰ、Ⅱ逐渐被洗下,尤其是苏丹红Ⅱ损失明显,导致回收率偏低。B、C柱处理加标样品,不会因上样溶液和淋洗溶液增加导致苏丹红有明显损失,填料吸附目标物的能力稳定,加标回收率理想。B柱处理番茄酱和咸蛋黄加标样品,四种苏丹红的平均加标回收率分别为85.2%~91.1%和83.7%~89.1%,RSD分别为4.8%~6.2%和2.4%~5.5%。C柱处理两种加标样品,苏丹红的平均加标回收率分别为85.5%~91.7%和85.8%~91.3%,RSD分别为3.8%~5.6%和3.2%~5.1%。
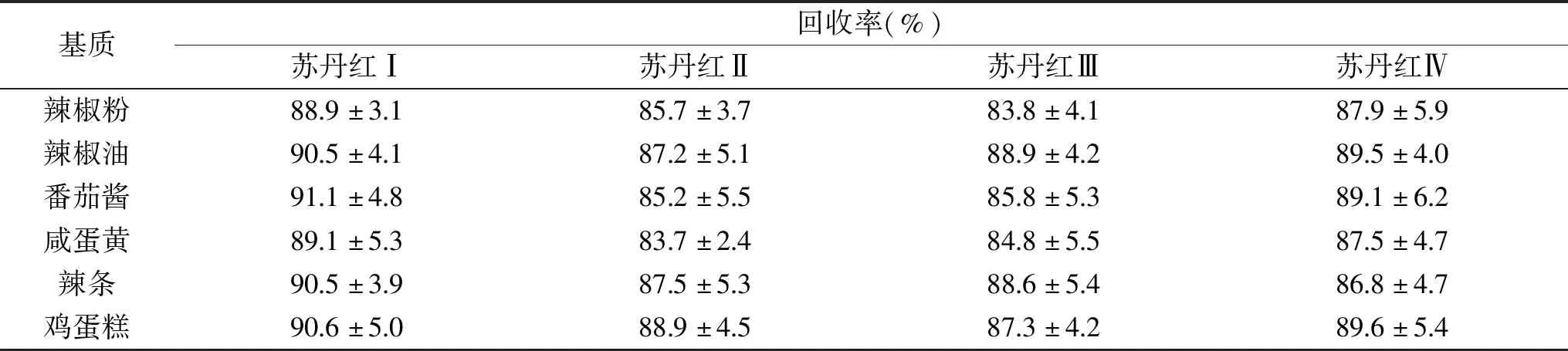
表3 B柱处理加标样品的回收率Table 3 Recoveries of spiked samples treated by SPE cartridge B
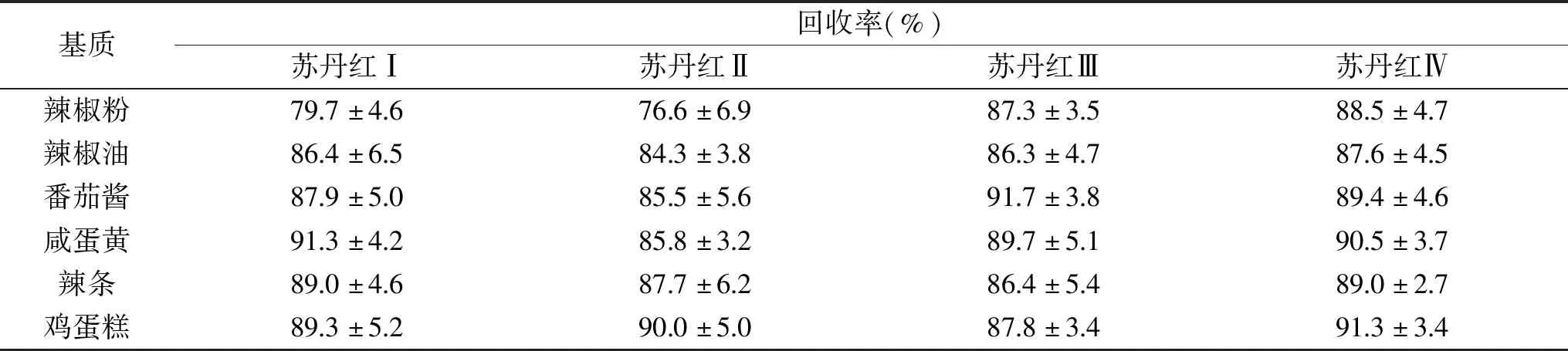
表4 C柱处理加标样品的回收率Table 4 Recoveries of spiked samples treated by SPE cartridge C
图4 不同固相萃取柱处理番茄酱(a)和咸蛋黄(b)加标样品的回收率Fig.4 Recoveries of spiked ketchup(a) and salt yolk(b)treated by different SPE cartridges
2.6 样品检测
对辣椒油、辣椒粉、番茄酱、咸蛋黄、辣条和鸡蛋糕6种食品分别加标2.0 mg/kg,按照1.2.1.1对空白样品和加标样品进行提取,采用能稳定吸附苏丹红的SPE柱B和C进行净化和富集,每个处理平行测定6次。通过液相检测,6种空白样品均未检出苏丹红。表3中,B柱处理加标样品,苏丹红的平均加标回收率83.7%~91.1%,相对标准偏差为2.4%~6.2%。表4中,C柱处理加标样品,除辣椒粉以外,平均加标回收率84.3%~91.7%,辣椒粉加标样品中苏丹红Ⅰ、Ⅱ的平均加标回收率偏低,分别为79.7%和76.6%。比较图5和图6,辣椒粉基质中存在干扰物质,经B柱处理后可消除杂峰,C柱处理后不能消除干扰。图6辣椒粉加标样品谱图中,杂峰影响了苏丹红Ⅱ、Ⅲ的出峰,需要重新调整色谱条件。实验发现,对SPE柱洗脱后,B柱上仍然吸附了部分有色物质,而C柱上的有色物质则完全被洗脱出来,干扰物与目标物均在洗脱液中,因此C柱对于辣椒粉的净化能力不及B柱。
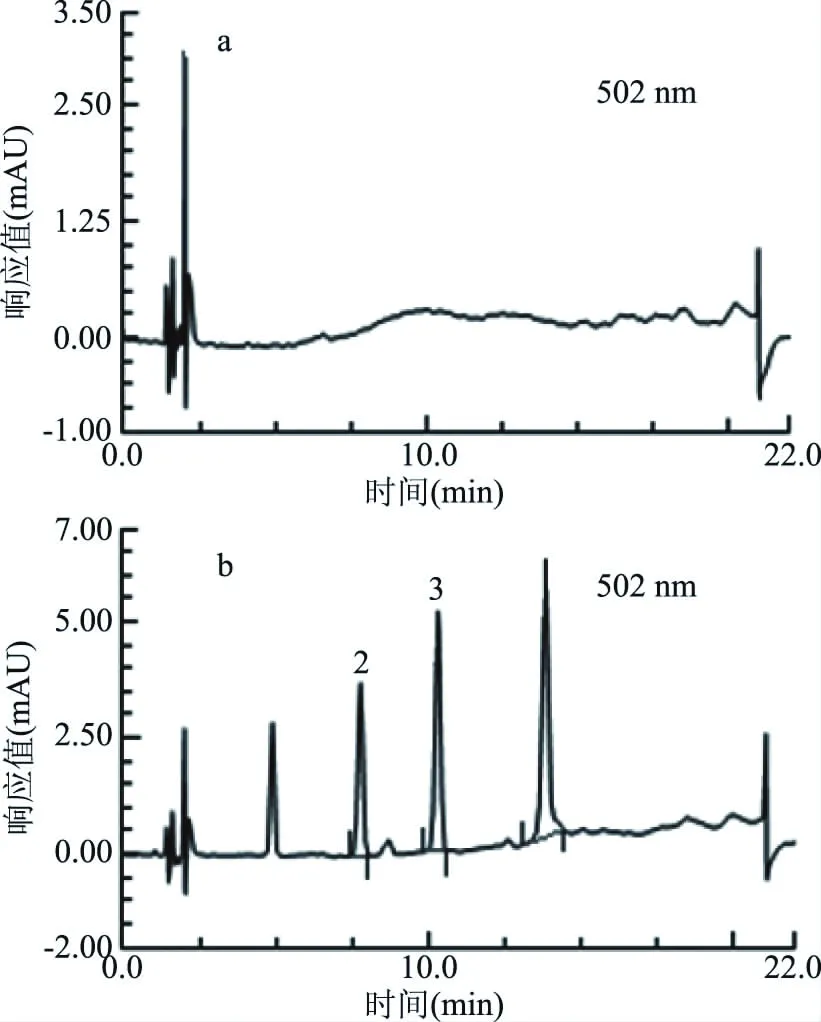
图5 B柱处理辣椒粉空白样品(a)和辣椒粉加标样品(b)的色谱图Fig.5 Chromatograms of blank paprika(a) and spiked paprika(b)treated by SPE cartridge B注:2:苏丹红Ⅱ;3:苏丹红Ⅲ。
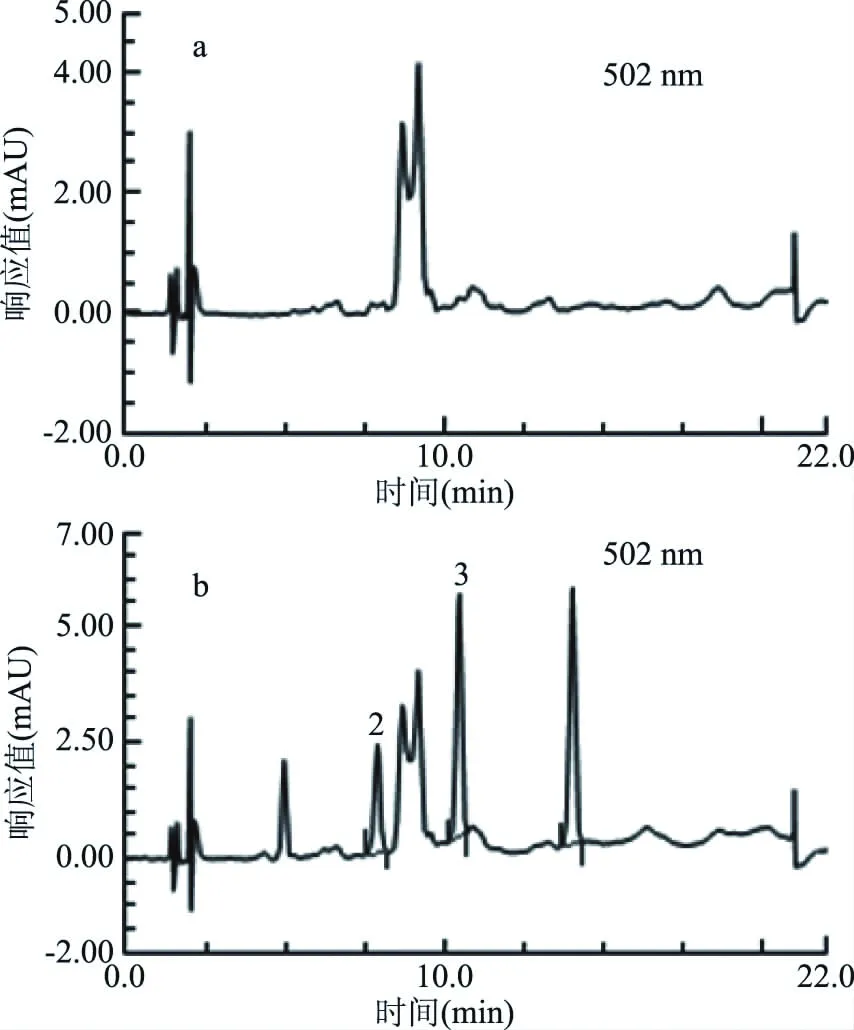
图6 C柱处理辣椒粉空白样品(a)和辣椒粉加标样品(b)的色谱图Fig.6 Chromatograms of blank paprika(a) and spiked paprika(b)treated by SPE cartridge C注:2:苏丹红Ⅱ;3:苏丹红Ⅲ。
3 讨论与结论
实验中所选的三种SPE柱均为商业化苏丹红专用固相萃取柱,与GB/T 19681-2005相比,省去了调整活度的步骤,整个前处理过程所需试剂大大减少,富集目标物也更有针对性。不同SPE柱处理番茄酱加标样品、咸蛋黄加标样品,四种苏丹红加标回收率RSD均小于10%,回收率稳定。
Cleanert Sudan SPE柱(A柱)为单层填料,使用时需控制上样溶液和淋洗溶液的量。当上样液超过10 mL、淋洗液异丙醇—正己烷超过3 mL,苏丹红Ⅱ会随着溶液的流出被洗下,同时苏丹红Ⅰ也有一定程度的损失。对于深色样品如辣椒粉和辣椒酱,需要正己烷多次溶解旋蒸瓶内有色物质,上样量增加;对于高油脂物质,少量的淋洗液不足以洗出填料中的油脂,否则在洗脱时油脂将和苏丹红一起被洗下,未达到净化效果。因此Cleanert Sudan SPE柱适用于浅色、低油脂食品的前处理。ProElut SDH SPE柱(B柱)填料为多种吸附剂按一定比例分两层填装而成,上样时可以同时吸附苏丹红、有色物质、油脂等,对于深色和高油脂物质,随着上样溶液或淋洗溶液的不断增加,填料吸附苏丹红能力稳定,不会产生明显损失,洗脱时目标物被洗下,而其他有色物质仍被吸附,减少了进样过程中杂质的干扰。ProElut SDH SPE柱普遍适用于不同种类食品的前处理。CNW Poly-sery MIP-SDR SPE柱(C柱)为单层填料,在上样和淋洗阶段,苏丹红能够较好地保留在SPE柱上,不受上样溶液和淋洗液体积增大的影响,但是在洗脱阶段,有色干扰物质也会随苏丹红一同被洗脱,因此适用于除辣椒粉以外的大部分食品的前处理。
尽管借助SPE柱的净化,样品溶液中杂质大大减少,但是食品基质复杂,每次进样后仍不可避免的有强保留物质吸附在色谱柱中,因此需要在色谱柱前加保护柱以减少对色谱柱的污染。在检测辣椒粉、辣椒油等颜色特别深和高油脂的样品后,容易造成保护柱或色谱柱的污染和基线的漂移,进而出现后续进样的基线波动大、峰型变宽、有杂峰等问题,因此在检测深色和高油脂样品后,应及时按照乙腈-异丙醇-乙腈的顺序冲洗色谱柱,根据不同色谱柱的维护指南,对于可以反冲的色谱柱采取反向冲洗,将缩短清洗时间和提高清除效果。

