2016年夏秋季南极布兰斯菲尔德海峡威氏棘冰鱼脂肪酸组成及其食性指示研究
吴睿婕 杨清源, 2, 3 朱国平, 2, 3, 4
研究论文
2016年夏秋季南极布兰斯菲尔德海峡威氏棘冰鱼脂肪酸组成及其食性指示研究
吴睿婕1杨清源1, 2, 3朱国平1, 2, 3, 4
(1上海海洋大学海洋科学学院, 上海 201306;2上海海洋大学极地研究中心, 上海 201306;3上海海洋大学大洋渔业资源可持续开发教育部重点实验室极地海洋生态系统研究室, 上海 201306;4国家远洋渔业工程技术研究中心, 上海 210306)
作为20世纪70年代末期底拖网渔业的主要捕捞对象以及近年来南极磷虾渔业的兼捕对象之一,威氏棘冰鱼()在海洋捕食者与饵料生物之间的能量流动中起着重要的传递作用,而目前针对该鱼种的营养特性及其食性的研究却十分有限。为此,本研究分析了布兰斯菲尔德海峡威氏棘冰鱼肌肉组织中脂肪酸的含量及其组成,并进一步探讨特征脂肪酸对食性的指示。结果表明,体长范围为4.8—30.7 cm、质量范围为0.3—250.5 g的威氏棘冰鱼肌肉样本中共检测出29种脂肪酸,其中含量较高的脂肪酸包括C16:0,C18:0,C18:1n9c,C20:5n3(EPA)以及C22:6n3(DHA),各类脂肪酸类型含量由高至低依次为多不饱和脂肪酸(PUFA),饱和脂肪酸(SFA)以及单不饱和脂肪酸(MUFA)。威氏棘冰鱼多种特征脂肪酸含量与体长之间不具显著的相关关系,表明其摄食并不随着个体的生长而发生较大的变化。秋冬季威氏棘冰鱼呈现杂食性特性,主要摄食以硅藻为食的生物,如南极磷虾(); 同时对底栖生物和海底碎屑也有一定的摄食,并会摄食一定量的桡足类生物。
威氏棘冰鱼 脂肪酸 食性 布兰斯菲尔德
0 引言
威氏棘冰鱼()棘冰鱼属,为大洋中下层鱼类[1],分布于南极陆架及近海岛屿周边水域,栖息水层为200—800 m[2]。常见于南极海峡、南极半岛之间的茹安维尔群岛周边海域、印度洋的宇航员海、共和海以及普里兹湾[3-5]。作为高纬度南极冰鱼科鱼类[6],威氏棘冰鱼不仅具有良好的营养价值,同时也是估算南极磷虾()消耗量的重要指标之一[7-8]。威氏棘冰鱼曾经是底拖网渔业的主要捕捞对象[9],但近些年来主要以磷虾渔业的兼捕渔获出现,因此再度逐渐为研究人员所重视[10]。自20世纪70年代以来,关于该鱼种的生长及分布等已有不少研究[11-13],但利用脂肪酸分析该鱼种的营养成分和食性的研究则较为有限[14-15]。
脂质是机体的主要能量贮存分子和能量来源之一,也是细胞膜结构和功能的重要物质基础[16]。通过分析海洋动物的脂肪酸组成和含量不仅可以反映出海洋动物的营养等级,还可以推测其摄食喜好和生活史[17]。近年来,脂肪酸常用于跟踪或确认海洋环境中捕食者与饵料生物之间的定性关系。最近,脂肪酸也用于分析影响全球主要生态系统动态的动力进程[18]。考虑到威氏棘冰鱼在生态和商业价值上的重要性,本研究利用布兰斯菲尔德海峡内采集到的威氏棘冰鱼样本,对其肌肉组织进行脂肪酸组成分析,并通过特征脂肪酸对其食性进行分析,从而为评估其在海域生态系统中的价值及生态位提供科学信息。
1 材料及方法
1.1 材料
样本由在南极布兰斯菲尔德海峡水域作业的大型中层磷虾拖网渔船采集,取样时间为2016年2—5月,取样站点如图1中黄点所示。海上随机采集的样本立即冷冻保存在−20°C条件下,运回国内实验室后迅速存入−80°C超低温冰箱中,以便后续分析。

图1 调查区域与站点. SACCF表示南极绕极流南锋,SB为南极绕极流南端
Fig.1. The study area with showing the sampling locations. SACCF: Southern Antarctic Circumpolar Current Front; SB: Southern Boundary of Antarctic Circumpolar Current
1.2 方法
1.2.1 样本处理
在实验室中将样本解冻后,首先测定其体长(L)和质量(W)等生物学信息。选用精度为1 mm的钢尺测量体长,质量通过精度为1 g的电子秤测量。取样本背鳍附近肌肉保存于标记好的塑料瓶中,用于后续脂肪酸测定和分析。
1.2.2 脂肪酸的提取
将提取出的肌肉用去离子水清洗后进行冷冻干燥,将冷冻干燥24 h后的样本研磨成粉。称量0.2 g粉末样品置于干燥试管中,加入15 mL三氯甲烷-甲醇溶液(溶液体积比为2∶1)浸泡20 h以上,离心后取上层清液。再加入10 mL三氯甲烷-甲醇溶液润洗残渣,离心取上层清液,将两次离心得到的上清液混合后加入4 mL浓度为0.9%的氯化钠溶液,静止2 h。取下层清液置于圆底烧瓶中进行水浴蒸发,得到粗脂质。
1.2.3 脂肪酸甲酯化
在圆底烧瓶中加入4 mL氢氧化钾-甲醇溶液(0.5 mol·L–1),混合后连接水浴回流装置(100°C),水浴加热5—10 min,加入4 mL三氟化硼-甲醇溶液煮沸25—30 min,再加入4 mL正乙烷回流萃取2 min。冷却后加入10—15 mL饱和氯化钠溶液,摇晃分层后静止放置1—2 h。用注射器吸取一定量的正乙烷层。将得到的正乙烷层利用气相色谱质谱联用仪(安捷伦5977AA)在特定条件(色谱柱为HP-88; 控温程序: 125°C条件下保持0 min,以8°C·min–1升到145°C,保持26 min,再以2°C·min–1升到220°C,保持1 min; 分流比为10∶1)下测定。
1.2.4 指标的测定与计算
以37种脂肪酸混标及内标十九烷酸甲酯标品作为标准,通过对比保留时间对脂肪酸进行定性分析,采用内标法[19]对脂肪酸进行定量分析。脂肪酸含量使用以下内标法公式得出其质量分数,并用单位干质量的威氏棘冰鱼肌肉组织中每种脂肪酸的含量表示:

其中,为待测样品中组分的含量(mg·g–1);A为组分的峰面积;为样品的质量;19为待测样品中加入内标物的质量;19为待测样品中内标物的峰面积;F为组分与内标物的校正因子之比,称为相对校正因子。
1.2.5 指示食性的特征脂肪酸
特征脂肪酸有指示生物食性的作用,并结合已有研究(表1),分析肌肉中特征脂肪酸组成与月份和体长间的关系,进一步探究样本的食性。
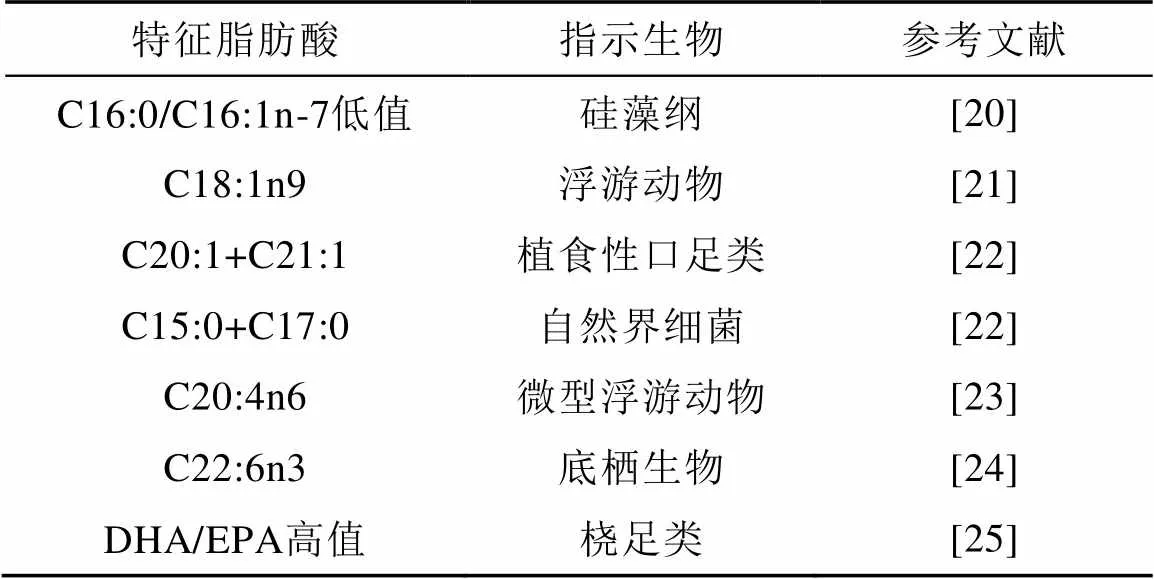
表1 特征脂肪酸及其指示生物(类型)
1.3 数据处理
使用幂函数分析威氏棘冰鱼体长-质量关系,采用单因子方差分析检验该关系是否显著。使用回归分析检验不同脂肪酸与体长的线性关系。首先利用Shapiro-Wilk检验分析脂肪酸含量数据是否符合正态分布; 若不符合,则将数据转换成对数形式后再进行检验,以使得数据符合正态分布。利用多元方差分析检验脂肪酸含量随月份和体长是否有显著性差异。差异性水平a=0.05。脂肪酸含量结果以平均数±标准偏差的形式表示。
2 结果与分析
2.1 基础生物学信息
威氏棘冰鱼样本体长范围为4.8—30.7 cm,平均体长为(12.38±7.0) cm,质量范围为0.3— 250.5 g,平均质量为(23.4±20.5) g。体长-质量关系为=0.00123.5996(2=0.9724,=42,<0.01)(为质量,为体长,为样本数) (图2)。

图2 威氏棘冰鱼体长-质量关系
Fig.2. The relationship between standard length and wet weight of
2.2 脂肪酸组成
威氏棘冰鱼肌肉组织中共检测出29种脂肪酸(表2),其中棕榈酸(C16:0)、硬脂酸(C18:0)、油酸(C18:1n9c)、二十碳五烯酸(C20:5n3,EPA)和二十二碳六烯酸(C22:6n3,DHA)共占总脂肪酸含量的75%,其含量分别为(21.65±5.92) mg·g−1、(11.54±6.91) mg·g−1、(6.69±2.74) mg·g−1、(13.51± 5.70) mg·g−1和(22.21±10.57) mg·g−1,这5种脂肪酸为威氏棘冰鱼肌肉样本的主要脂肪酸成分; 饱和脂肪酸(SFA)共9种,其总含量为(38.93±10.53) mg·g−1;单不饱和脂肪酸(MUFA)9种,其总含量为(13.49± 5.68) mg·g−1; 多不饱和脂肪酸(PUFA)11种,其总含量为(47.58±10.49) mg·g−1。PUFA和SFA的含量明显高于MUFA; PUFA/SFA含量范围为0.387— 3.733 mg·g–1,平均值为(1.38±0.67) mg·g−1。n-3类脂肪酸含量范围为9.71— 61.09 mg·g−1,平均值为(38.01±13.53) mg·g−1,明显高于n-6类脂肪酸含量的平均值(8.92±6.99) mg·g−1。DHA平均含量为(22.20±10.56) mg·g−1,显著高于EPA的平均含量(13.50±5.70) mg·g−1。
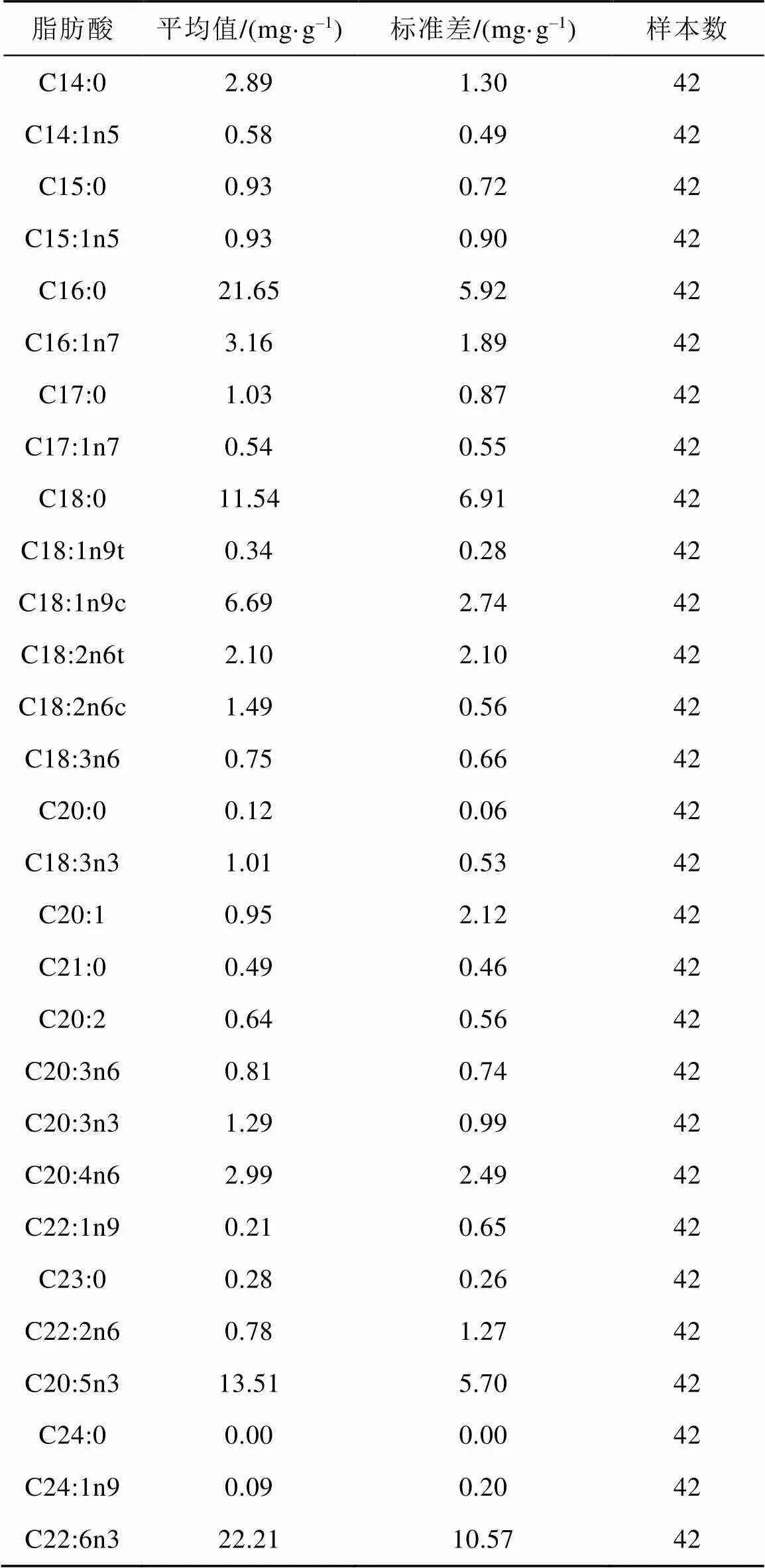
表2 威氏棘冰鱼脂肪酸含量
由质量分数百分比来看,威氏棘冰鱼肌肉中饱和脂肪酸占总脂肪酸含量的37%,含量由高至低依次为C16:0(21.6%)、C18:0(11.54%)、C14:0(2.89%)、C17:0(1.03%)、C15:0(0.93%)、C21:0(0.49%)、C23:0(0.28%)、C20:0(0.12%)和C24:0(0.01%); 单不饱和脂肪酸占总脂肪酸含量的17%,含量由高至低依次为C18:1n9c(6.69%)、C16:1n7(3.16%)、C20:1(0.95%)、C15:1n5(0.93%)、C14:1n5(0.58%)、C17:1n7(0.54%)、C18:1n9t (0.34%)、C22:1n9(0.21%)和C24:1n9(0.09%); 多不饱和脂肪酸占总脂肪酸含量的46%,含量由高至低依次为C22:6n3(22.21%)、C20:5n3(13.51%)、C20:4n6(2.99%)、C18:2n6t(2.10%)、C18:2n6c (1.49%)、C20:3n3(1.29%)、C18:3n3(1.01%)、C20:3n6(0.81%)、C22:2n6(0.78%)、C18:3n6(0.75%)和C20:2(0.64%)。PUFA占总脂肪酸含量百分比最高,其次为SFA和MUFA,这一结果也与脂肪酸含量结果相符合。SFA与不饱和脂肪酸(UFA)的质量分数比为0.587。
2.3 特征脂肪酸及食性指示
对具有食性指示的脂肪酸进行多元方差分析可知,各月份和体长与特征脂肪酸组成间均不存在显著性差异(表3)。通过对比分析各特征脂肪酸质量与月份的变化关系(表4)可以看出,5月C20: 5n3出现最高值,其平均含量为18.88 mg·g–1。C22: 6n3含量最高值出现在2月,平均含量为(28.91±5.64) mg·g–1。C18: 1n9和C16:1n7的峰值均出现在2月,其平均含量分别为(8.48±1.42) mg·g–1、(2.31±0.27) mg·g–1。C14:0和C20:4n6的变化趋于一致,即于4月出现最高值,其平均含量分别为(1.98±0.31) mg·g–1、(2.06±0.58) mg·g–1。PUFA/SFA的值最高出现在2月,其平均含量为(1.61±0.06) mg·g–1,且含量随月份推进而减少,这一结果也与C22:6n3(DHA)的变化趋势一致。由特征脂肪酸构成来看,威氏棘冰鱼肌肉中n-3类多不饱和脂肪酸与n-6类多不饱和脂肪酸质量分数比为4.26,所有个体的DHA/EPA比值均大于1。此外,威氏棘冰鱼体内含有一定量的Σ(C15+C17)和C20:6n3,表明其对浮游细菌和底栖生物有一定的摄食。因威氏棘冰鱼肌肉样本含有高含量的C20:5n3,且C16:1与C16:0的比值均大于0.15,指示威氏棘冰鱼以硅藻为主要摄食对象或主要以摄食硅藻的饵料生物为食。同时,因为威氏棘冰鱼肌肉含有较高含量的C22:6n3、C18:1n9及一定量的Σ(C20:0+C22:0),指示其还会摄食一定量的桡足类生物。

表3 威氏棘冰鱼脂肪酸含量与月份及体长之间关系的多元方差分析

表4 威氏棘冰鱼主要特征脂肪酸含量月变化
3 讨论
3.1 脂肪酸组成
在本研究中,威氏棘冰鱼的肌肉组织中共含有29种脂肪酸,其中SFA和MUFA各9种,PUFA 11种。Nichols等[26]分析了4种具有商业价值的南极和次南极鱼类脂肪酸组成,与本研究相同的脂肪酸为C14:0,C15:0,C18:0,C14:1n5,C20:4n6,C22:6n3和C20:5n3等15种,且两个研究中C16:0,C18:1n9c,C20:5n3,C22:6n3这四种脂肪酸的含量均较高。作为必需脂肪酸,EPA和DHA对维持鱼类的正常生长有着重要的作用。本研究中,EPA和DHA的含量较高,占多不饱和脂肪酸的55%,且n-3型多不饱和脂肪酸含量高于n-6型多不饱和脂肪酸(n-3/n-6=7.57±6)。由于n-3/n-6是鱼油相对营养价值的重要指标,高含量的n-3/n-6证明了该鱼种具有较高的营养价值[27]。同时,EPA和DHA作为食物中主要的营养来源,也可以作为补充多不饱和脂肪酸的指标,这也可以表明威氏棘冰鱼是n-3脂肪酸的良好来源。威氏棘冰鱼肌肉样本中脂肪酸组成的另一个特征是饱和脂肪酸的含量较高,其中棕榈酸和硬脂酸含量占了饱和脂肪酸的89%。现有研究证明,硬脂酸和n-3多不饱和脂肪酸对人体的作用具有相同效果[28]。棕榈酸可以降低血清中胆固醇含量, 棕榈酸和油酸可以代替膳食中的月桂酸和肉豆蔻酸,可能对治疗血栓有益[29]。由此可知,威氏棘冰鱼具有较高的营养价值。
3.2 特征脂肪酸及食性指示
鱼体内脂肪酸来源于鱼类摄食和自身合成[30]。对高营养级杂食性鱼类来说,鉴于饵料来源的复杂化和多样化,为了获取更多的必需脂肪酸,鱼类也有自己的摄食喜好[31]。由于鱼类的脂肪酸组成在很大程度上取决于其摄食对象的脂肪酸特征[18],且特征脂肪酸具有指示食性的作用,鱼类的脂肪酸组成和含量便可较好地指示它们的食物来源。本研究中,威氏棘冰鱼肌肉样本中含有较高含量的C16:1n-7/C16:0,这一结果通常用于指示硅藻纲[20],且游泳动物体内高含量的C22:6n3,意味着它们的饵料生物主要以硅藻为食[22]。由此,本研究推测,威氏棘冰鱼饵料来源主要包含以硅藻为食的生物或其自身直接摄食硅藻。已有研究证明,桡足类体内DHA含量较高,EPA含量较低; 而枝角类体内EPA含量较高,DHA含量较低[25]。本研究中威氏棘冰鱼肌肉样本中DHA含量高于EPA,这一结果可以指示威氏棘冰鱼摄食较多的桡足类。此外,在威氏棘冰鱼肌肉样本中还发现了其他类型的特征脂肪酸,如C15:0和C17:0,这类脂肪酸通常被认为用于指示自然界中细菌的特征脂肪酸,该来源可能来自于沉降在海底的生物有机碎屑[23]。威氏棘冰鱼肌肉样本也含有一定量的C20:4n6脂肪酸,而C20:4n6通常被用来指示微型浮游生物,同时还可以指示大型藻类和浮游动物,如纤毛虫[24]等,但本研究中肌肉样本中C20:4n6含量较低,表明威氏棘冰鱼可能对微型浮游生物和大型藻类有极为少量的摄食。Pakhomov等[32]对在科什莫纳夫托夫海采集到的威氏棘冰鱼胃含物成分进行了研究,发现南极磷虾占威氏棘冰鱼胃含物的90%,其余成分为一些南极鱼类,如灯笼鱼科[5],且威氏棘冰鱼个体在不同生活史阶段摄食无明显差异。在南极海域中,南极磷虾的主要摄食对象为硅藻及其他藻类[33-34]。这一研究结果与本研究推断大致相同,即威氏棘冰鱼属于典型的杂食性鱼类,主要摄食以硅藻为食的生物,如南极磷虾,或者其自身直接摄食硅藻; 同时对底栖生物和海底碎屑也会有一定的摄食,并会摄食一定的桡足类生物。
考虑到特征脂肪酸C16:1n7[20]和C22:6n3[22]可以用来指示硅藻,且C20:4n6可以用做指示底栖生物食性[35]。除5月(=1)外,本研究中指示硅藻的特征脂肪酸C16:1n7和C22:6n3含量随着月份的增加而逐渐降低,而指示底栖食性的C20:4n6随着月份推进而增加。这表明威氏棘冰鱼对硅藻的摄食随月份逐渐下降,而对底栖生物的摄食则逐月增加。造成上述变化的原因可能是: 夏季阳光充足,藻类暴发,南极磷虾得以大量繁殖,而随着秋季的到来,海水温度降低,藻类生长速度减缓,仅以藻类为食不能为南极磷虾提供正常生长所需营养,所以磷虾肌肉中一些指示藻类的特征脂肪酸含量降低[36],进而影响到主要以南极磷虾为食的威氏棘冰鱼肌肉中相关特征脂肪酸含量也随之降低。进入秋季,为了维持正常的生长,威氏棘冰鱼也会摄食一些底栖生物或者游泳鱼类以补充所需营养。
致谢 感谢南极磷虾渔业科学观察员以及南极磷虾渔船“福荣海”轮和“龙腾”轮在样本收集过程中提供的帮助。本研究还得到了上海海洋大学大学生创新项目以及优秀本科生进实验室项目的部分资助。
1 Nelson J S. Fishes of the world [M]. 3rd ed. New York: John Wiley & Sons Inc., 1994.
2 Kock K H. Antarctic Fish and Fisheries[M]. Cambridge: Cambridge University Press, 1992.
3 Kock K H, Pshenichnov L, Jones C D, et al. Joinville-D’Urville Islands (subarea 48.1)-A former fishing ground for the spiny icefish (), at the tip of the Antarctic Peninsula – revisited[J]. CCAMLR Science, 2004, 11: 1-20.
4 Kailola P J, Williams M J, Stewart P C, et al. Australian fisheries resources[M]. Canberra: Bureau of Resource Sciences, Department of Primary Industries and Energy and the Fisheries Research and Development Corporation, 1993.
5 IWAMI T, KOCK K H. Channichthyidae[M]//GON O, HEEMSTRA P C. Fishes of the Southern Ocean. Grahamstown: J.L.B. Smith Institute of Ichthyology, 1990: 381-389.
6 KOCK K H, GRÖGER J, JONES C D. Interannual variability in the feeding of ice fish (Notothenioidei, Channichthyidae) in the southern Scotia Arc and the Antarctic Peninsula region (CCAMLR Subareas 48.1 and 48.2)[J]. Polar Biology, 2013, 36(10): 1451-1462.
7 PAKHOMOV E A, SHUMATOVA A A. Feeding and estimation of daily ration of Wilson’s glassfish,, of the Indian sector of Antarctica[J]. Journal of Ichthyology, 1992, 32(7): 56-70.
8 Budge S M, Parrish C C, Mckenzie C H. Fatty acid composition of phytoplankton,settling particulate matter and sediments at a sheltered bivalve aquaculture site[J]. Marine Chemistry, 2001, 76(4): 285-303.
9 Kock K H, Pshenichnov L, Jones C D, et al. The biology of the spiny icefishRegan, 1914[J]. Polar Biology, 2008, 31(3): 381-393.
10 Rembiszewski J M, Krzeptowsk i M, Linkowski T B. Fishes as by-catch of fisheries of krill (Dana) (Euphausiaceae, Crustacea)[J]. Polish Acrchives of Hydrobiology, 1978, 25(3): 677-695.
11 Gerasimchook V V, Trotsenko B C. On the ecology ofRegan 1914 (Channichthyidae, Perciformes)[J]. Antarctic, 1988, 27: 191-202.
12 Slosarczyk W. Contribution to the early life history of Channichthyidae from the Bransfield Strait and South Georgia (Antarctica)[C]//Kullander S O, Fernhol m B. Proceedings of the VthEuropean Congress of Ichthyology. Stockholm: Swedish Museum of Natural History, 1985: 427-433.
13 Kuhn t, Zizka V M A, müNSTER J, et al.Lighten up the dark: metazoan parasites as indicators for the ecology of Antarctic crocodile icefish (Channichthyidae) from the north-west Antarctic Peninsula[J]. Peer J, 2018, 6: e4638.
14 DANIELS R A, LIPPS J H. Predation on foraminifera by Antarctic fish[J]. Journal of Foraminiferal Research, 1978, 8(2): 110-113.
15 KOCK K H. Antarctic icefishes (Channichthyidae): A unique family of fishes. A review, Part 1[J]. Polar Biology, 2005, 28(11): 862-895.
16 RAINUZZO J R, REITAN K I, OLSEN Y. The significance of lipids at early stages of marine fish: a review[J]. Aquaculture, 1997, 155(1/2/3/4): 103-115.
17 AUEL H, HARJES M, DA ROCHA R, et al. Lipid biomarkers indicate different ecological niches and trophic relationships of the Arctic hyperiid amphipodsand[J]. Polar Biology, 2002, 25: 374-383.
18 DALSGAARD J, ST JOHN M, KATTNER G, et al. Fatty acid trophic markers in the pelagic marine environment[M]//SOUTHWARD A J, TYLER P A, YOUNG C M, et al. Advances in Marine Biology. London: Academic Press, 2003: 225-340.
19 中华人民共和国国家质量监督检验检疫总局. 中国国家标准化管理委员, GB/T 22223-2008 食品中总脂肪、饱和脂肪(酸)、不饱和脂肪(酸)的测定水解提取-气相色谱法[S]. 北京: 中国标准出版社, 2008.
20 PARRISH C C, ABRAJANO T A, BUDGE S M, et al. Lipid and Phenolic Biomarkers in Marine Ecosystems: Analysis and Applications[M]. Berlin, Heidelberg: Springer, 2000: 193-223.
21 ROSSI S, SABATÉS A, LATASA M, et al. Lipid biomarkers and trophic linkages between phytoplankton, zooplankton and anchovy () larvae in the NW Mediterranean[J]. Journal of Plankton Research, 2006, 28(6): 551-562.
22 刘梦坛, 李超伦, 孙松. 脂肪酸对中华哲水蚤摄食两种海洋微藻的指示作用[J]. 生态学报, 2011, 31(4): 933-942.
23 SARGENT J R, PARKES R J, MUELLER-HARVEY I, et al. Lipid biomarkers in marine ecology[M]//SLEIGH M A. Microbes in the sea. New York: Wiley and Sons, 1987: 119-138.
24 Pond D W, Bell M V, Harris R P, et al. Microplanktonic polyunsaturated fatty acid markers: a mesocosm trial[J]. Estuarine Coastal & Shelf Science, 1998, 46(2): 61-67.
25 PERSSON J, VREDE T. Polyunsaturated fatty acids in zooplankton: variation due to taxonomy and trophic position[J]. Freshwater Biology, 2006, 51: 887-900.
26 NICHOLS D S, WILLIAMS D, DUNSTAN G A, et al. Fatty acid composition of Antarctic and temperate fish of commercial interest[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1994, 107(2): 357-363.
27 SIMOPOULOS A P. Omega-3 fatty acids in inflammation and autoimmune diseases[J]. Journal of the American College of Nutrition, 2002, 21(6): 495-505.
28 陈银基, 鞠兴荣, 周光宏. 饱和脂肪酸分类与生理功能[J]. 中国油脂, 2008, 33(3): 35-39.
29 王国蕊. 海洋酸化对大型海藻活性代谢产物影响的研究[D]. 青岛: 青岛科技大学, 2018.
30 彭士明, 李云莉, 施兆鸿,等. 海水鱼类亲体必需脂肪酸营养的研究进展[J]. 海洋渔业, 2016, 38(1): 98-106.
31 张乐, 蒲新明, 梁彦娟, 等; 必需脂肪酸在海洋食物链中的作用[J]. 海洋科学, 2009, 33(4): 66-71.
32 PAKHOMOV Y A, TSEYTLIN V B. Diet of seven species of Antarctic fishes and estimation of their daily rations[J]. Journal of Ichthyology, 1992, 32(5): 31-41.
33 HABERMAN K L, QUETIN L B, ROSS R M. Diet of the Antarctic krill (Dana)[J]. Journal of Experimental Marine Biology and Ecology, 2003, 283(1/2): 79-95.
34 朱国平, 朱小艳. 南极磷虾种群生物学研究进展Ⅲ—摄食[J]. 水生生物学报, 2014, 38(6): 1152-1160
35 STOWASSER G, POND D W, COLLINS M A. Using fatty acid analysis to elucidate the feeding habits of Southern Ocean mesopelagic fish[J]. Marine biology, 2009, 156(11): 2289-2302.
36 聂玉晨, 张波, 赵宪勇, 等.南极磷虾()脂肪与蛋白含量的季节变化[J]. 渔业科学进展, 2016, 37(3): 1-8.
FATTY ACID COMPOSITION OF SPINY ICEFISH () IN THE BRANSFIELD STRAIT, ANTARCTIC DURING SUMMER - AUTUMN 2016 AND ITS IMPLICATION TO DIET
Wu Ruijie1, Yang Qingyuan1, 2, 3, Zhu Guoping1, 2, 3, 4
(1College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China;2Center for Polar Research, Shanghai Ocean University, Shanghai 201306, China;3Polar Marine Ecosystem Group, Key Laboratory of Sustainable Exploitation of Oceanic Fisheries resources, Ministry of Education, Shanghai 201306, China;4National Engineering research Center for Oceanic Fisheries, Shanghai 201306, China)
Spiny icefish () plays an important role in the transfer of energy between marine predators and prey organisms, and is the target species of the demersal trawl fishery late 1970s and is one of bycatch species for the Antarctic krill fishery in recent years. However, information on its diet and nutritional characteristics are very limited. We analyzed the content and composition of fatty acids in muscle tissues of spiny icefish collected from the Bransfield Strait, and further explored the diet of spiny icefish using marker fatty acids. Standard lengths of fish samples ranged from 4.8 to 30.7 cm and wet weights ranged from 0.3 to 250.5 g. We found 29 fatty acids, of which C16:0, C18:0, C18:1 n9c, C20:5 n3 (EPA) and C22:6 n3 (DHA), were dominant; polyunsaturated fatty acid was the most abundant, followed by saturated fatty acids, and monounsaturated fatty acids were the least abundant. There was no statistically significant correlation between fish size and marker fatty acids, indicating that the diet of spiny icefish was not varied with ontogeny. Spiny icefish is omnivorous, and feed mainly on diatoms and Antarctic krill () during autumn and winter, some benthic organisms, copepods and seabed debris are fed by this species.
spiny icefish, fatty acid, feeding habit, Bransfield Strait
2018 年12 月收到来稿, 2019 年5 月收到修改稿
国家自然科学基金(41776185)、国家重点研发计划(2018YFC1406801)和自然资源部极地办协同创新平台建设项目资助
吴睿婕,女,1999 年生。本科生,主要从事海洋生物学研究。E-mail:wuu779r@163.com
朱国平, E-mail: gpzhu@shou.edu.cn
10. 13679/j.jdyj.20190001

