三种食药用菌多酚含量测定及抗氧化活性比较
,*,*
(1.广东工业大学轻工化工学院,广东广州 510006;2.广东药科大学医药化工学院,广东中山 528458)
食药用菌因为具有营养保健的双重功效,逐渐受到越来越多人的重视,同时也成为大健康产业不可或缺的一部分[1]。食药用菌营养成分极其丰富,包括多糖、蛋白质、多肽、氨基酸、脂肪酸、核苷酸、维生素、微量元素等[2-4],其中也包括8种人体必需氨基酸等[5]。此外,食药用菌中萜类、甾体类、皂苷、黄酮、酚酸等抗炎活性成分不断被发现[6-8]。食药用菌也具有多种生物医学功能,比如免疫调节、预防心血管疾病、抗炎、抗氧化、抗肿瘤等生理功能[9-11]。
松茸是口蘑科真菌松口蘑的子实体,是一种名贵的野生食、药用真菌[12]。猴头菇,因其形状似猴子而得名,又称猴头蘑。其肉质细嫩,营养丰富,是文明中外的食药兼用真菌[13]。杏鲍菇,属伞菌目,侧耳科,侧耳属[14],其菌肉肥厚,质地鲜嫩,口感脆滑、爽口,是近年来开发栽培成功的集药用、食用、食疗一体的珍稀食用菌[15]。目前,就食药用菌功效成分的研究主要集中在多糖、氨基酸等初级代谢产物方面[16-17],而对其具有多种药理活性的多酚等次级代谢产物研究需要进一步探究[18]。
多酚是常见的营养物质抗氧化剂,主要从水果、蔬菜、茶叶、咖啡、菇类及中草药中提取[19-20]。多酚类物质可通过直接清除自由基、抑制氧化酶系、络合金属离子等机理达到抗氧化作用[21-23]。多酚类物质在食药用菌中的含量也因品种的不同而不尽相同,且不同提取方法对其提取率影响较大。另一方面,目前Folin-酚测多酚的方法以及DPPH自由基清除的方法并没有一个标准的规程。
本文选取松茸、猴头菇、杏鲍菇三种食药用菌,采取浸提和热回流两种提取方式分别提取其子实体的多酚,通过改进的Folin-酚测试方法测定提取物多酚含量,采用DPPH和ABTS法测试其清除自由基的能力,并以MTT法对UVB所致的HaCaT细胞光损伤的防护作用进行评价,以期为食药用菌在功能食品方面的开发利用提供一定的理论依据和技术参考。
1 材料与方法
1.1 材料与仪器
松茸、杏鲍菇、猴头菇子实体各1000 g 广州清平市场;人永生化表皮细胞(HaCaT细胞) 中国医学科学院;胎牛血清(FBS)、DMEM培养液、0.25%胰酶、青霉素、链霉素、磷酸缓冲溶液(PBS,pH=7.4) 美国Gibco公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、二甲基亚砜(DMSO)、焦性没食子酸 阿拉丁试剂有限公司;噻唑蓝(MTT) 美国Bio Basic Inc公司;福林酚(Folin-Ciocalteu)试剂 上海荔达生物科技有限公司;碳酸钠、过硫酸钾、乙醇均为分析纯 广州化学试剂厂。
Lambda25型紫外可见分光光度计 珀金埃尔默仪器有限公司;SpectraMax Paradigm型多功能酶标仪 美谷分子仪器有限公司;CO2培养箱 赛默飞世尔科技有限公司;CL-1000M UVB型紫外交联仪 美国UVP仪器有限公司;TC-15套式恒温器 海宁市新华医疗器械厂;GT OIC-T20超声仪 广东固特超声股份有限公司;TD5A-WS台式低速离心机 湘仪集团。
1.2 实验方法
1.2.1 多酚提取及供试品的制备 猴头菇、杏鲍菇、松茸子实体经50 ℃干燥箱中干燥至恒重,粉碎并过24目筛,分别称取其粉末2份,各3.0 g,精密称定于250 mL圆底烧瓶中,加入70%乙醇50 mL,记录总重。分别浸泡提取24 h和采用回流温度90 ℃、时间1.5 h进行提取,提取后将剩余部分补加溶剂至原重,用定性中速滤纸过滤,即得多酚浸提样品液和热回流提取样品液。猴头菇样品液直接作为供试品待测,猴头菇、松茸样品液各稀释2倍作为供试品待测。
1.2.2 猴头菇浸提取样品液多酚测定条件的考察 以猴头菇浸提取样品液为例进行方法学考察,其余5种样品多酚测定均适合此检测方法。参考Flion-酚测多酚的方法[24],分别对显色温度、显色时间、碳酸钠及Flion-酚用量按以下方法进行了优化。
1.2.2.1 检测波长的确定 于2支20 mL容量瓶中分别加入浓度0.1 mg/mL焦性没食子酸标准品和猴头菇浸提取供试品1.0 mL,10% Na2CO3溶液2.4 mL,Folin-酚试剂1.0 mL,快速摇匀,加去离子水定容,40 ℃水浴静置反应30 min。在500~900 nm波长范围内扫描,以确定最大吸收波长。
1.2.2.2 温度和时间的确定 于4支20 mL容量瓶中分别加入猴头菇浸提取供试品1.0 mL,10% Na2CO3溶液2.4 mL,Folin-酚试剂1 mL,快速摇匀,加去离子水定容。分别静置于25、40、50、60 ℃水浴锅中反应,前期每隔15 min测定一次,第30 min后每30 min测定一次,用紫外可见分光光度计测试A760,测试至180 min,以确定最佳显色温度和时间。
1.2.2.3 碳酸钠和Flion-酚体积用量比例的确定 于8支20 mL容量瓶中各加入猴头菇浸提取供试品1.0 mL,Folin-酚试剂各1.0 mL,以0.5∶1、1∶1、1.5∶1、2∶1、2.5∶1、3∶1、3.5∶1、4∶1的比例加入10% Na2CO3溶液,快速摇匀,加去离子水定容,置40 ℃水浴加热反应30 min,测定A760,以确定二者体积用量最佳比例。
1.2.2.4 Flion-酚用量的确定 于8支20 mL容量瓶中各加入猴头菇浸提取供试品1.0 mL,分别加入10% Na2CO3溶液1.2、1.6、2.0、2.4、2.8、3.2、4.0、4.8 mL,按2∶1比例分别加入Folin-酚试剂0.6、0.8、1.0、1.2、1.4、1.6、2.0、2.4 mL,快速摇匀,加去离子水定容,置40 ℃水浴加热反应30 min,测定A760,以确定Flion-酚用量。
1.2.3 猴头菇浸提取样品液多酚测定的方法学考察 以猴头菇浸提取样品液为例,进行多酚测定的方法学考察。
没食子酸标准溶液的配制:准确称取焦性没食子酸 6.0、8.0、10.0、12.0、14.0、16.0 mg,溶解在去离子水中,分别转入100 mL的容量瓶中,用去离子水定容,摇匀,得质量浓度为0.06、0.08、0.1、0.12、0.14、0.16 mg/mL的标准品溶液,静置待测。
1.2.3.1 线性关系考察 精密量取浓度0.06、0.08、0.1、0.12、0.14、0.16 mg/mL焦性没食子酸标准品溶液各1.0 mL,按照前面确定的最适量及最适比例加入各试剂,即10% Na2CO3溶液3.0 mL,Folin-酚试剂1.5 mL,加去离子水定容到20 mL容量瓶中,迅速摇匀,置40 ℃水浴锅中显色30 min,测A760,以考察线性关系。
1.2.3.2 精密度实验 取浓度0.1 mg/mL焦性没食子酸标准品溶液1.0 mL,依次加入10% Na2CO3溶液3.0 mL,Folin-酚试剂1.5 mL,加去离子水定容到20 mL容量瓶中,迅速摇匀,置40 ℃水浴锅中显色反应30 min,760 nm波长下连续测定6次OD值,以考察仪器精密度。
1.2.3.3 稳定性实验 取待测供试品1.0 mL,按“精密度实验”项下方法操作,显色完成后待测液置于室温,分别于0、30、60、90、120、150 min测定A760,以考察显示液稳定性。
1.2.3.4 重复性实验 取同一待测样品6份,按照“1.2.1”项下方法制备供试品。分别取1.0 mL,依法显色测定A760,以考察方法重复性。
1.2.3.5 回收率实验 取已知总酚含量的猴头菇粉末9份,每份约1.5 g,精密称定,分别按1∶0.8、1∶1、1∶1.2加入一定量的焦性没食子酸标准品。按照“1.2.1”项下浸提取方法制备供试品。分别取供试品1.0 mL,按照前面确定的最适量及最适比例加入各试剂,显色测定A760,以考察方法的准确度。
1.2.3.6 三种食药用菌多酚含量的测定 精确量取三种食药用菌子实体的多酚浸提和热回流提取供试品各1.0 mL,每个供试品各取3份,10% Na2CO3溶液3.0 mL,Folin-酚试剂1.5 mL,快速摇匀,加去离子水定容到20 mL容量瓶中,40 ℃避光反应30 min,反应完全后,利用紫外-可见分光光度计,在760 nm下测定体系吸光值,根据没食子酸标准品所得标准曲线得到供试品中多酚质量浓度,按照式(1)计算子实体总多酚的含量。
子实体多酚含量(mg/g)=(50×C×N)/3
式(1)
式中,C为供试品多酚质量浓度(mg/mL),N为样品稀释倍数(猴头菇N=1;杏鲍菇,松茸N=2)。
1.2.4 抗氧化性测定 首先取三种食药用菌子实体的浸提样品液和热回流提取样品液各2 mL,然后加适量去离子水,冷冻干燥,计差重计算各样品液的提取物浓度。
1.2.4.1 DPPH自由基清除能力的测定 用70%乙醇分别对上述两种提取方法中得到的样品液作3倍、6倍、12倍、24倍、48倍、96倍稀释,各取100 μL加100 μL 0.15 mmol/L DPPH自由基乙醇溶液作为实验组,100 μL 70%乙醇加100 μL 0.15 mmol/L的DPPH自由基乙醇溶液作为对照组,混合反应60 min(3倍稀释样品反应平衡,并验证DPPH耗尽),使用酶标仪在517 nm波长处测定其吸光度。
按公式(2)计算各样品的 DPPH自由基清除率。
式(2)
式中,A样品为各浓度样品60 min时的吸光度值;A平衡为最大浓度样品60 min时的吸光度值(此时,反应平衡,验证DPPH耗尽);A对照为对照组60 min时的吸光度值。
1.2.4.2 ABTS自由基清除能力的测定 ABTS自由基参考文献[25]方法配制并有改进。用70%乙醇分别对上述两种提取方法中得到的样品液作4倍、8倍、16倍、32倍、64倍、128倍稀释,各取100 μL加100 μL ABTS自由基溶液作为实验组,100 μL 70%乙醇加100 μL ABTS自由基溶液作为对照组,混合反应6 min(4倍稀释样品反应平衡,并验证ABTS耗尽),使用酶标仪在734 nm波长处测定其吸光度。按照公式(3)计算各样品的ABTS自由基清除率。
式(3)
式中,A样品为各浓度样品6 min时的吸光度值;A平衡为最大浓度样品6 min时的吸光度值(此时,反应平衡,验证ABTS耗尽);A对照为对照组6 min时的吸光度值。
1.2.5 热回流提取样品液对细胞光损伤防护能力的评价 为进一步验证采用热回流方式提取多酚的抗氧化效果,分别取猴头菇、杏鲍菇、松茸热回流提取样品液,经浓缩冷冻干燥,获得提取物冻干粉,用生物级DMSO配制成50 mg/mL 的母液,备用。HaCaT细胞用含10% FBS及1%双抗的DMEM高糖培养基培养。
取对数生长期的HaCaT细胞,用0.25%的胰酶消化,完全培养基终止吹打后以1000 r/min离心5 min,制备单细胞悬浮液并计数,以8000/孔96孔板,每孔100 μL,于37 ℃ 5% CO2培养箱中培养。12 h待细胞贴壁后,分为空白对照组、UVB损伤组、猴头菇热回流样高剂量100 μg/mL+UVB组、猴头菇热回流样低剂量10 μg/mL+UVB组、杏鲍菇热回流样高剂量100 μg/mL+UVB组、杏鲍菇热回流样低剂量10 μg/mL+UVB组、松茸热回流样高剂量100 μg/mL+UVB组、松茸热回流样低剂量10 μg/mL+UVB组,每组6个复孔,轻轻吸去上清液,以100 μL/孔药物干预,空白对照组和UVB损伤组不做任何处理。继续培养48 h后,弃掉培养基,用PBS(pH=7.4)清洗2次,除空白组外,其它各组加30 μL PBS(pH=7.4),UVB损伤组、药物防护组用紫外交联仪给予50 mJ/cm2光剂量损伤细胞,空白组用锡箔纸覆盖不给予UVB损伤,更换100 μL/孔10% FBS继续培养24 h。各组均加含0.5 mg/mL MTT的DMEM基础培养基100 μL/孔,于培养箱中作用4 h后,小心弃掉上清液,各孔均加150 μL DMSO,于摇床避光低速摇晃5 min,用酶标仪检测490 nm处的吸光度值。按公式(4)计算各组的细胞存活率。

式(4)
式中,A空白为空白对照组的吸光度值;A实验为UVB损伤组或提取物防护组的吸光度值;A调零为未种细胞,且全程同法处理孔的吸光度值。
1.3 数据处理
采用 Microsoft Excel 2016 软件进行常规数据处理,并用GraphPad Prism 5.0 软件作图、求IC50值及t检验分析,P<0.05为差异显著。实验平行3次。
2 结果与分析
2.1 多酚测定条件的考察
通过“1.2.2”节的方法,分别对显色温度、显色时间、碳酸钠及Flion-酚用量等条件进行了考察,结果见图1~图4。

图1 样品(A)和没食子酸标准液(B)波长扫描Fig.1 Spectral absorption curve of sample(A)and standard gallic acid solution(B)

图2 温度和时间对反应的影响Fig.2 Effect of temperature and time on absorbance
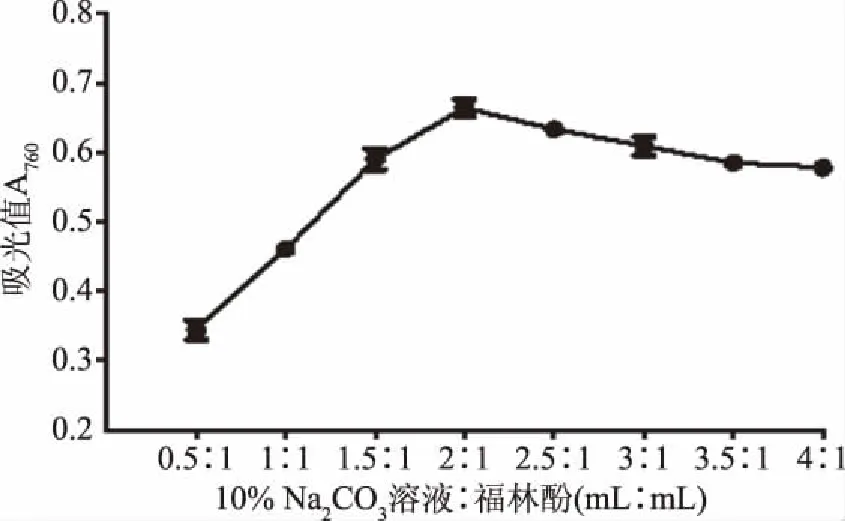
图3 碳酸钠与福林酚体积用量比对反应的影响Fig.3 Effects of ratio of sodium carbonate to Folin volume on absorbance
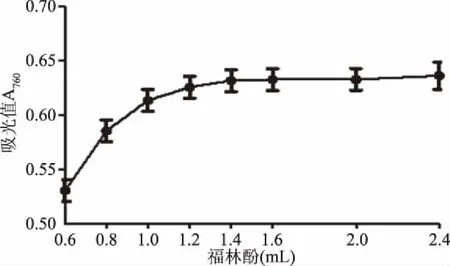
图4 福林酚用量对反应的影响Fig.4 Effects of volumes of Folin on absorbance
从图1是没食子酸工作液与供试品溶液分别和Folin-酚试剂显色的全波长扫描图,发现两者均在760 nm处有最大吸收,故选检测波长为760 nm。
从图2可以看出,40 ℃显色,反应30 min时,吸光度值达到最大,吸光度值为0.618。50~60 ℃显色30 min时,吸光度值降低,当显色温度温度大于40 ℃,吸光值随着温度的增加而降低。反应温度在25~40 ℃范围内时,吸光度值随着温度的增加而升高,说明一定温度的升高可以加快显色进程,但是温度过高造成显色体系不稳定。结合显色的程度及反应体系的整体稳定性,确定显色温度为40 ℃,显色时间为30 min。
从图3可以看出,10% Na2CO3溶液与Folin-酚试剂比例增加到2∶1时,吸光度值最大,确定碳酸钠与Flion-酚比例为2∶1。
从图4可以看出,当Folin-酚试剂用量达到1.4 mL后,吸光度值增加不明显,1.6 mL趋于稳定,所以选取中间值即Folin-酚试剂的用量为1.5 mL,选取10% Na2CO3溶液的用量为3.0 mL。
2.2 多酚测定方法学考察结果
通过“1.2.3”的方法,分别对多酚测定方法的线性关系、精密度、稳定性、重复性等进行了考察。线性关系考察实验,以标品质量浓度为横坐标,OD值为纵坐标绘制标准曲线,求得线性回归方程为Y=5.2971X-0.1324,R2=0.9992,表明焦性没食子酸在0.06~0.16 mg/mL范内呈良好的线性关系。精密度实验显示,连续6次测试的OD值分别为0.403、0.401、0.405、0.402、0.404、0.403,RSD值为0.35%,表明仪器精密度良好;稳定性实验显示,0~150 min测试的OD值分别为0.618、0.617、0.618、0.617、0.615、0.607,RSD值为0.69%,表明待测显色液在150 min内稳定;重复性实验显示,6份同法提取样品的OD值分别为0.615、0.639、0.618、0.631、0.627、0.625,RSD值为1.39%,表明本方法重复性良好;回收率实验结果(表1)显示,平均回收率为99.36%,RSD值为2.84%,表明改进的Folin-酚测试方法准确可靠,可用于样品多酚含量的测定。
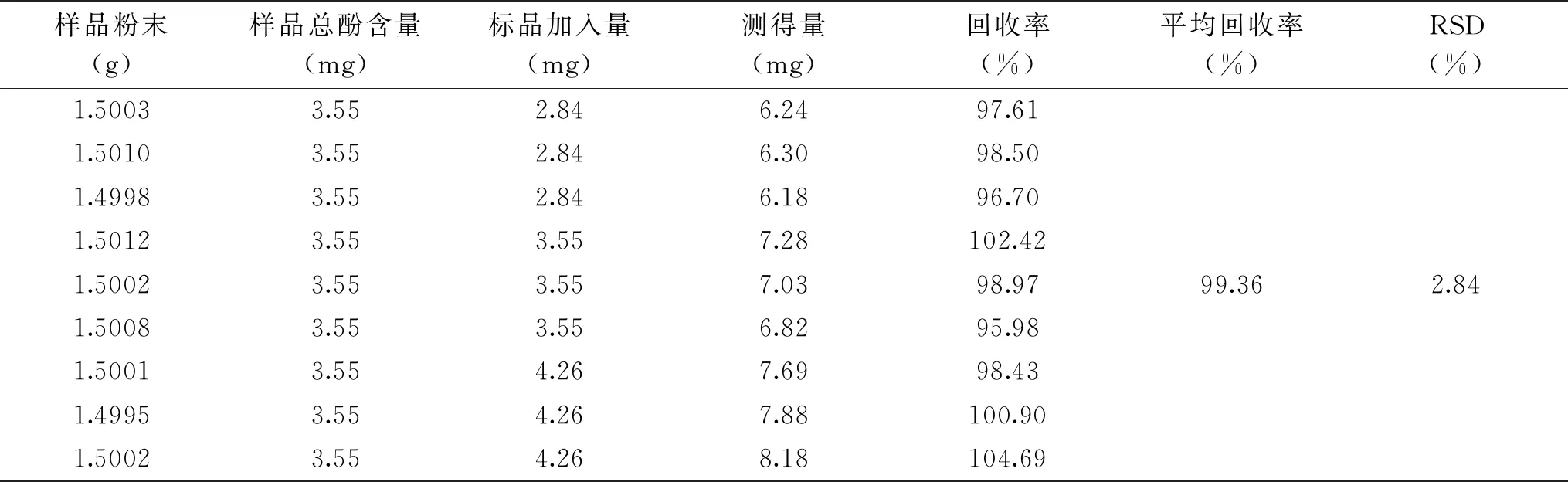
表1 回收率实验结果(n=9)Table 1 Recovery results(n=9)
2.3 多酚含量比较
通过优化的Flion-酚法分别对猴头菇、杏鲍菇、松茸三种食药用菌子实体提取样品液进行了多酚测定,结果见表2。

表2 三种食药用菌多酚含量比较Table 2 Comparison of total phenolic contents of three edible and medicinal
结果显示在同种提取条件下,松茸多酚含量比杏鲍菇多酚与猴头菇多酚含量高;而两种提取方式相比,热回流提取方式下的松茸多酚含量较高,表明其提取效果较好。
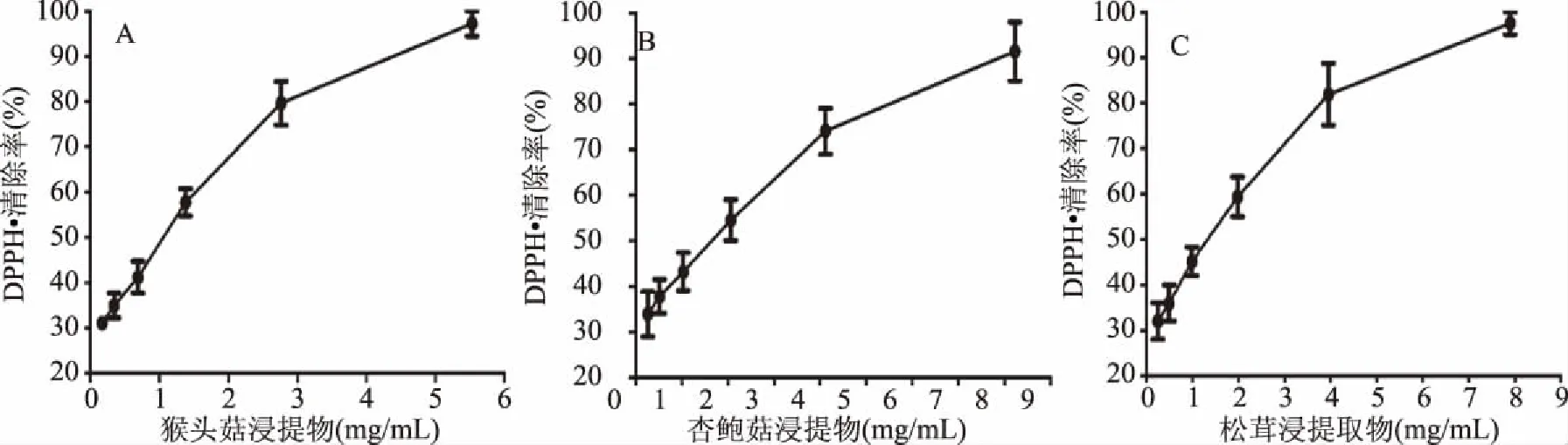
图5 浸提提取方式的三种食药用菌提取物清除DPPH自由基清除率曲线Fig.5 DPPH free radical scavenging rate of three edible and medicinal fungi by soaking extraction
2.4 清除DPPH自由基的IC50值
计算出来的各样品液提取物浓度,如表3所示。不同浓度样品溶液的DPPH自由基清除率实验结果见图5、图6。提取物清除DPPH自由基的IC50值结果如表4所示。

表3 三种食药用菌提取物的质量浓度Table 3 Mass concentration of three edible
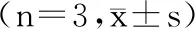
表4 各提取物清除DPPH自由基的IC50值Table 4 IC50 values of DPPH free
结果显示,回流法制备的提取物清除DPPH自由基的能力强于浸提法,三种食药用菌中,以松茸回流提取物清除DPPH自由基的IC50值最小,为(0.534±0.03) mg/mL。
2.5 清除ABTS自由基的IC50值
不同浓度样品溶液的ABTS自由基清除率实验结果见图7、图8。提取物清除ABTS自由基的IC50值结果如表5所示。
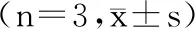
表5 各提取物清除ABTS自由基的IC50值Table 5 IC50 values of ABTS free
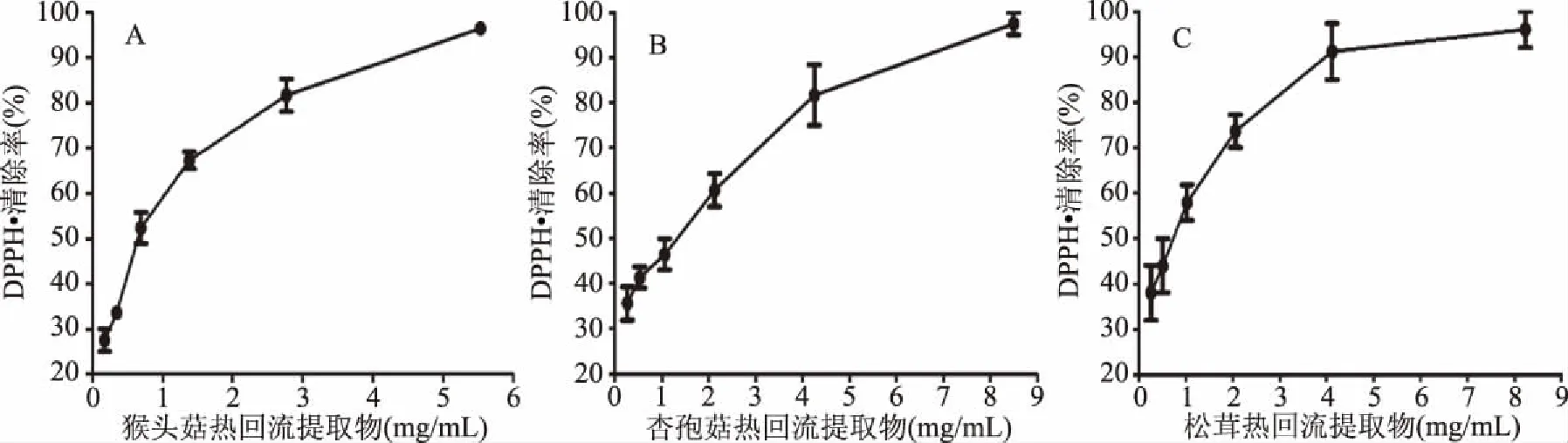
图6 热回流提取方式的三种食药用菌提取物清除DPPH自由基清除率曲线Fig.6 DPPH free radical scavenging rate of three edible and medicinal fungi by heated reflux extraction

图7 浸提提取方式的三种食药用菌提取物清除ABTS自由基清除率曲线Fig.7 ABTS+· scavenging rate of three edible and medicinal fungi by soaking extraction

图8 热回流提取方式的三种食药用菌提取物清除ABTS自由基清除率曲线Fig.8 ABTS+· scavenging rate of three edible and medicinal fungi by heated reflux extraction
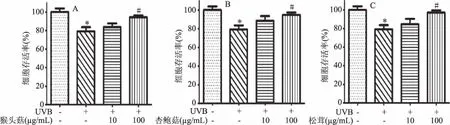
图9 三种食药用菌提取物对UVB所致的HaCaT细胞光损伤的防护作用Fig.9 Protective effects of three edible and medicinal fungi extracts on photodamage of HaCaT cells induced by UVB注:与正常组比较,*表示P<0.05;与模型组比较,#表示P<0.05。
结果显示,回流法制备的提取物清除ABTS自由基的能力强于浸提法,三种食药用菌中,以松茸回流提取物清除ABTS自由基的IC50值最小,为(0.271±0.01) mg/mL。
2.6 细胞光损伤防护作用结果
防护作用见图9。采用热回流提取方式得到的提取物进行UVB损伤药物预保护实验。结果表明,与空白组相比,UVB组细胞增殖率显著降低(P<0.05);三种食药用菌提取物剂量达100 μg/mL时,均可显著(P<0.05)提高细胞存活率,猴头菇、杏鲍菇、松茸提取物作用细胞存活率分别为(94.23%±3.79%)、(94.605%±4.91%)、(97.814%±3.05%),三种药物作用下均可以提高细胞存活率,多酚成分涉及具体作用机制需研究者进一步进行研究。
3 结论
本文通过改进的Folin-酚法测定了三种食药用菌子实体的多酚含量,结果表明,热回流法提取多酚的效果优于浸提法,三种食药用菌中以松茸多酚含量最高。通过DPPH和ABTS法对比了不同提取方法和不同食药用菌提取物体外清除自由基的能力,结果表明,采用热回流法的提取物对DPPH和ABTS自由基的清除能力强于浸提法,三种食药用菌相比,以热回流法提取的松茸提取物清除自由基的能力最强。提取物多酚含量与体外清除DPPH和ABTS自由基的能力呈正相关。热回流提取法得到的杏鲍菇、猴头菇、松茸提取物能够有效的预防UVB所致的HaCaT细胞光损伤,多酚成分涉及具体作用机制需进一步进行研究。本文为食药用菌在抗氧化功能食品方面的开发利用提供了一定的理论依据和技术参考。

