人工纳米颗粒对海洋渔业生物的毒性效应及水产品质量安全影响研究进展
丁怡丹,黄翠玲,朱琳,冯娟,夏斌,*,赵信国,孙雪梅,陈碧鹃,曲克明
1. 青岛大学环境科学与工程学院,青岛 266071 2. 中国水产科学研究院黄海水产研究所,农业农村部极地渔业开发重点实验室,青岛 266071 3. 通标标准技术服务(青岛)有限公司,青岛 266101 4. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室,青岛 266237
纳米材料具有特殊的催化、光电和抗菌等性能,被广泛应用于污水处理、化妆品和抗菌剂等不同领域。根据纳米技术消费类产品库存(Nanotechnology Consumer Products Inventory)统计,自2005年以来,纳米材料的种类和数量呈指数增长,在2015年已多达1 800余种[1],生产总量达到数百万t[2],预计到2020年将增加到3 400种[3],到2024年全球纳米技术市场价值可达到1 250亿美元[4]。人工纳米颗粒(engineered nanoparticles, ENPs)是指在三维空间中至少有一维处于纳米尺度范围(1~100 nm)的人工材料。根据组成成分,ENPs可分为:碳纳米颗粒物(单壁纳米碳管(SWCNTs)、多壁纳米碳管(MWCNTs)和富勒烯(C60)等)、单质金属纳米颗粒物(纳米Ag、Fe和Au等)、金属氧化物纳米颗粒物(纳米CuO、ZnO、TiO2和SiO2等)、量子点(quantum dots, QDs)及纳米聚合物(聚苯乙烯、聚乙烯等)等。在纳米产品的生产过程、使用阶段和废弃时ENPs均可释放到环境中[5],根据模型预测,近岸海域ENPs含量已达到mg·L-1的级别,并且其浓度会随着排放量的增加呈指数上升[6-8]。此外,ENPs会对海洋生物产生毒性效应,从而危害海洋生态系统的健康和稳定。因此,ENPs已成为海洋环境中的新型污染物[9]。
海洋渔业资源是人类重要的粮食和优质蛋白质的来源[10]。根据中华人民共和国农业农村部渔业渔政管理局最新发布的《2020中国渔业统计年鉴》,2019年我国海洋水产品产量为3 282.5万t,水产品加工总产值为4 464.6亿元[11]。ENPs会对海洋渔业生物产生一系列有害的生理影响,包括降低孵化率[12]、抑制新陈代谢[13]、阻碍胚胎发育[14]和影响免疫功能[15]等,并会沿着食物链发生传递和生物放大作用,引发了人们对于海洋水产品质量安全的关注和担忧。本文通过对国内外研究成果的归纳和总结,分析海洋环境中ENPs的来源和环境行为以及对海洋渔业生物的毒性效应,并探讨了ENPs在食物链中的传递和对水产品质量安全的潜在影响。并根据目前所面对的问题,对未来的研究工作做出展望。
1 ENPs的来源(Sources of ENPs)
1.1 个人护理用品
个人护理用品中常见的ENPs种类有Ag ENPs、ZnO ENP和TiO2ENPs等。Ag ENPs由于其优越的抗菌性能被广泛应用在牙膏等护理产品中[16]。ZnO ENPs[17]和TiO2ENPs[18]有良好的光学特性,可以吸收和散射紫外线,因此,常添加在防晒类化妆品中来隔绝紫外线,从而达到保护皮肤的目的[19-20]。随着社会经济发展和人们生活水平的提高,个人护理用品的产量和消费量不断地增加,导致对海洋环境的不断污染。据报道,预计每年约有4 000~6 000 t防晒霜被排放到海洋珊瑚礁区域,这些防晒霜中的TiO2ENPs会在水介质中发生分散和团聚行为[19],对栖息在海洋环境中的珊瑚群落和渔业生物产生危害[21]。此外,防晒霜中TiO2ENPs表面的无机涂层通常为氧化铝,当其进入到生物体内,会被消化系统的酸性介质溶解,从而使ENPs活性增强,对生物产生更大的损害[22]。
1.2 工业和城市污水
ENPs进入环境的过程主要与其迁移和转化过程有关,这个过程主要发生在城市污水处理厂中[23],最终ENPs被排放到海洋环境中。防晒霜等个人护理用品中的ENPs会随着人类生活污水进入到污水处理厂[24]。此外,有研究人员在城市径流和污水处理厂中也检测到了来自建筑外墙涂料中的TiO2ENPs[25-26]、Ag ENPs[27-28]和ZnO ENPs[29],证明了建筑外墙涂料会随着使用年限增加而老化脱落,随雨水等排入污水处理厂。研究还发现,在污水处理过程中,这些来自于日常生产生活的ENPs会与其他污染物相互吸附形成团聚体[30],这些团聚物大部分将累积在活性污泥中[31],小部分会随污水处理尾水进入到海洋环境中[12]。
1.3 防污涂料
污损生物附着会造成海洋建筑物(如平台和码头)、船舶等发生表面腐蚀,大大缩短建筑物和船舶的使用年限,增加昂贵的维护费用。为了防止生物污损,海洋建筑物会使用防污涂料,而纳米材料是其中重要的有效成分。海洋防污涂料中常见的纳米材料包括SiO2ENPs、TiO2ENPs、ZnO ENPs和碳纳米管等。不同种类的纳米材料添加到防污涂料中发挥的功能也不尽相同,ZnO ENPs具有较好的着色性、防腐性和发光性[32],CuO ENPs则具有良好的抗菌性,TiO2ENPs、Al2O3ENPs和SiO2ENPs可提高涂料的抗老化性,TiO2ENPs、Cr2O3ENPs和Fe2O3ENPs等具有良好的静电屏蔽性能,可使涂膜表面不沾附尘污,提高装饰性能。防污涂料会随着使用时间的增加出现不同程度的腐蚀、风化和老化,最终会进入到海洋环境中。
1.4 大气沉降
大气中ENPs的主要来源分为点源排放和非点源排放[33]。ENPs的点源一般是污水处理厂、垃圾焚烧厂和填埋厂等[34],非点源是指服装、个人护理用品和清洗剂等用品在使用或洗涤过程中的磨损排放以及汽车尾气等[35]。相对于水环境和土壤环境来说,排入大气中的纳米颗粒数量较少,而它们却可以进入其他环境中,并与该环境介质发生相互作用。目前已在大气环境中检测到了含Hg、Fe、Pb和Zn的纳米颗粒[36-38],这些大气中的纳米颗粒主要通过降水进入水环境[39-40],最终汇聚在海洋环境中。
2 ENPs在海洋中的环境行为(Environmental behavior of ENPs in ocean)
ENPs进入海洋环境后会发生一系列复杂的环境行为,并且可能会在生物、物理和化学等因素作用下发生转化。目前已有研究报道了ENPs在淡水中的环境行为[41],但是海洋环境相对于淡水更加复杂。高离子强度、低有机物含量、弱碱性水质以及潮流、潮汐、风浪等因素使得ENPs在海洋环境中的行为不同于淡水环境(图1),进而导致ENPs对海洋生物的毒性效应及致毒机制发生改变[42]。因此,研究ENPs在海洋生态环境中的环境行为就显得尤为重要。
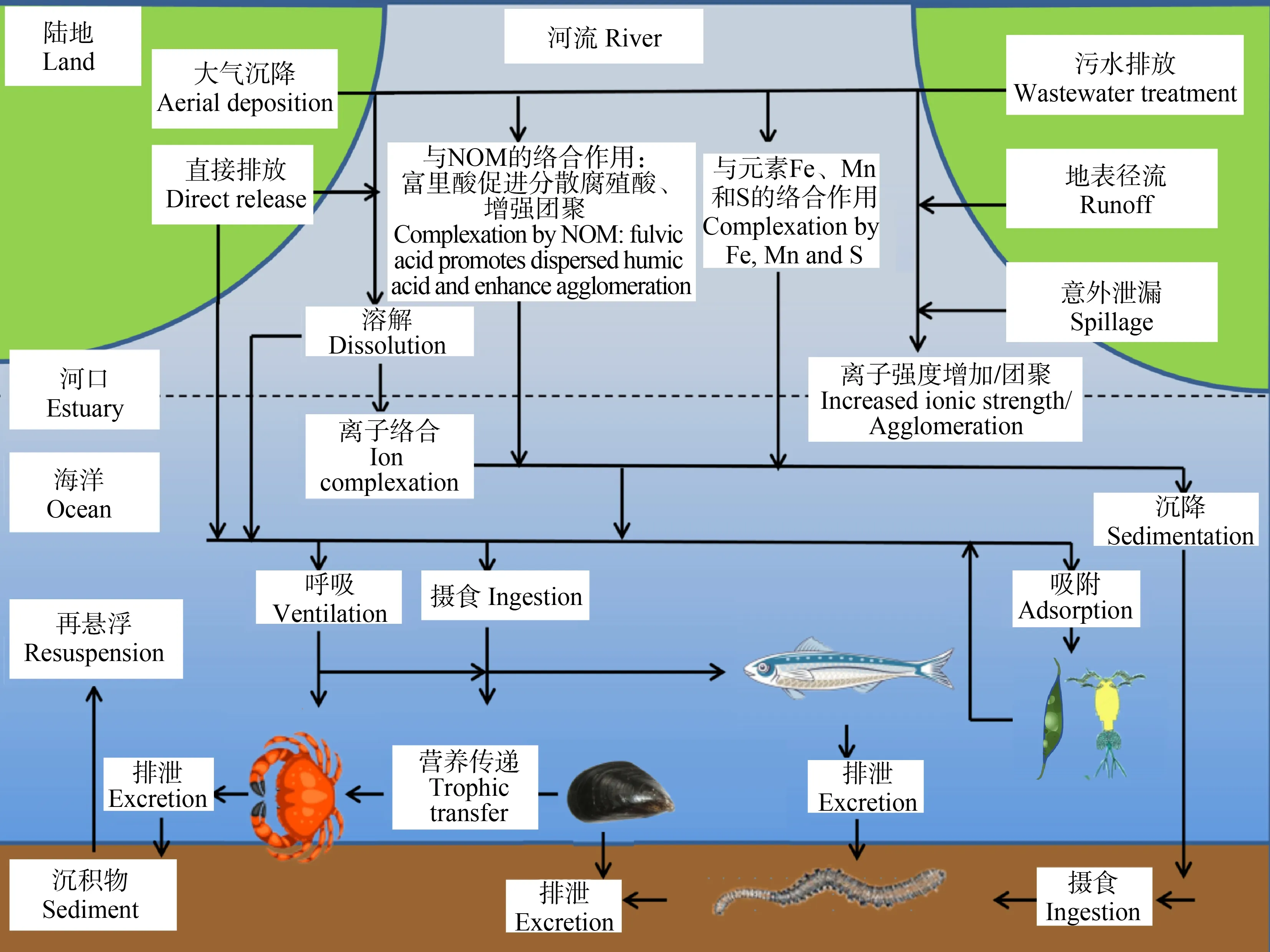
图1 人工纳米颗粒(ENPs)在海洋环境中的环境地球化学过程[43]注:NOM为天然有机质。Fig. 1 Environmental geochemistry process of engineered nanoparticles (ENPs) in marine environment[43]Note: NOM means natural organic matter.
2.1 溶解性
一些金属及金属氧化物ENPs可以在水介质中释放金属离子,但是它们的溶解程度不尽相同。例如,CeO2ENPs在水介质中几乎是不溶的[44],Cu ENPs能够释放Cu2+[45],Ag ENPs能够释放Ag+[46]。ENPs的溶解性主要受到其粒径大小、性质、涂层和环境因素(盐度、pH等)的影响。在海水中,尺寸越小的ENPs溶解性能越好,如纳米级ZnO的溶解性是微米级ZnO的2倍[47]。ENPs的形状也会影响其溶解性,这主要与比表面积的大小有关,比表面积越大的ENPs溶解性能越好。此外,海水盐度变化也会影响ENPs的溶解性,如盐度增加会促进CuO和ZnO NPs的团聚,从而降低其溶解性[48]。pH也会对ENPs的溶解性产生影响。在pH为4~9的范围内,随着pH的降低,Ag ENPs释放Ag+的能力增强[49]。CuO和Cu ENPs的离子释放量:pH 4 ≥ pH 7 > pH 11[50]。Ag2O ENPs在海洋酸化条件下会进一步溶解释放Ag+,并且颗粒粒径越小,离子释放能力越强[51]
2.2 团聚性
ENPs在水介质中易于团聚,其团聚性强弱与溶液的离子强度、pH和天然有机质(NOM)密切相关[52]。海水具有高离子强度,因而降低了颗粒的电泳迁移率,促进了ENPs的团聚[53]。pH也会影响ENPs的团聚性。pH接近Al2O3ENPs悬浮液的等电点时颗粒悬浮性减弱,远离等电点时悬浮性增强,这可能是ENPs之间静电作用力不同引起的[54]。在pH为5~8范围内,随着pH增加,Fe2O3ENPs的团聚性增强[55]。pH降低远离Cu ENPs等电点时,Cu ENPs的粒径减小,悬浮性能增强[56]。此外,NOM会影响ENPs的团聚性。如NOM会增加CeO2ENPs的表面电荷,从而增强颗粒间的静电排斥,导致ENPs的团聚性降低[57]。不同分子量的NOM对ENPs团聚的影响也不尽相同。如低分子量的富里酸会增加胶体的流动性,而高分子量的腐殖酸会增加团聚[58]。ENPs的团聚速率也会发生变化,与自身浓度和表面电荷等因素有关,高浓度的ENPs会快速发生团聚,而二价阳离子(如Ca2+)可以改变被NOM包裹的ENPs所带的表面电荷,从而加速ENPs的团聚[59]。
3 ENPs对海洋渔业生物的毒性(Toxicity of ENPs to marine fisheries)
3.1 鱼类
研究表明,ENPs会对鱼类的胚胎发育产生不利影响(表1)。在ZnO ENPs暴露下,海水青鳉(Oryziasmelastigma)胚胎[12]和诸氏鲻虾虎鱼(Mugilogobiuschulae)胚胎[60]的死亡率升高,心率加快,孵化时间延长,孵化率降低,畸形率增加,虾虎鱼畸形特征多表现为脊柱弯曲。ENPs暴露会导致鱼类生理活动和行为能力受到影响。例如,TiO2ENPs会改变虹鳟鱼(Oncorhynchusmykiss)的运动行为,如降低高速游泳的时间比例,这可能与鳃损伤和呼吸压力有关[61],还可能会引起肝细胞微量脂肪过量和脂沉积,严重影响脑中的Cu2+和Zn2+水平[62]。Ates等[63]研究了不同盐度条件下CuO ENPs对杂色鲤(Cyprinodonvariegatus)生理活动的影响,结果发现不论盐度条件如何变化,CuO ENPs暴露均会改变鱼的行为,造成粘液分泌增加、活动量减少和平衡性变差等;且在低盐度条件下,鱼体组织中Cu的富集量更高,CuO ENPs暴露导致的氧化损伤更强。ZnO NPs抑制了美国红鱼(Sciaenopsocellatus)单核巨噬细胞的活性,并且随着ZnO NPs暴露时间的延长和浓度的增加,细胞活性进一步降低,氧化应激可能是诱发细胞凋亡的主要途径[64]。ENPs会在鱼类的不同器官中富集。有研究发现TiO2ENPs主要富集在鲳鲹(Trachinotuscarolinus)[65]的肝脏、肾脏和鳃部,少量会进入到肌肉中。与以上研究结果相反,Wang等[66]发现长期暴露于ZnO ENPs(80 mg·kg-1)并没有影响海水青鳉(Oryziasmelastigma)的生长,反而增强了海水青鳉的抗氧化能力。
3.2 贝类
ENPs在进入水体之后会发生团聚并沉降,最终进入到沉积物当中,因此贝类作为底栖生物更易受到ENPs的威胁(表1)。ENPs进入贝类生物体后会在其组织中富集。地中海贻贝(Mytilusgalloprovincialis)在10 μg·L-1Ag ENP中暴露15 d后,发现ENPs在鳃和消化腺中发生积累[67]。1 mg·L-1的CuO ENPs进入到紫贻贝(Mytilusedulis)体内,大约有63%的Cu会富集在鳃中,28%富集在消化腺中,9%富集在外套膜中[68]。Trevisan等[69]将太平洋牡蛎(Crassostreagigas)暴露在4 mg·L-1ZnO ENPs悬浮液中,24 h和48 h后也发现了ZnO ENPs在消化腺中积累。ENPs暴露会导致贝类产生脂质过氧化,并对其免疫功能造成影响。已有研究发现,在环境浓度下(1 μg·L-1),TiO2ENPs(15~60 nm)会造成紫贻贝消化腺丙二醛(MDA)含量上升,免疫功能降低[70];1 mg·L-1TiO2ENPs(22 nm)暴露后,紫贻贝血细胞内的中性脂质含量增加,溶酶体稳定性降低[71]。菲律宾蛤仔(Ruditapesphilippinarum)在ZnO ENPs暴露下出现氧化应激反应,过氧化氢酶和超氧化物歧化酶活性增加,谷胱甘肽S转移酶活性下降[72]。环境预测浓度TiO2ENPs(1 mg·L-1)会对栉孔扇贝(Chlamysfarreri)产生氧化损伤和神经毒性[73]。

续表1分类Classification物种Species污染物Pollutant污染物浓度Pollutant concentrations毒性效应Effects参考文献References甲壳类Crustacea三疣梭子蟹Portunus trituberculatusCuO ENPs滨蟹Carcinus maenasCu ENPs短沟对虾Penaeus semisulcatusZnO ENPs南美白对虾Litopenaeus vannameiAg ENPs20、40 mg·L-1富集含量从高到低依次为:鳃、血淋巴、肌肉、肝胰腺、心脏和胃The contents of enrichment from high to low were: gill, hemolymph, muscle, hepatopancreas, heart and stomach[74]0、20.0、29.9、44.8、67.0、100 mg·L-1CuO ENPs浓度越高,死亡率越高;具有急性毒性,96 h的半致死浓度为49 mg·L-1The higher of CuO ENPs concentration, the higher mortality; they have acute toxicity and the half lethal concentra-tion of 96 h is 49 mg·L-1[75]0.2、1 mg·L-1主要富集在鳃、肝胰腺和螯肌中;铜纳米组死亡率(21%)低于铜离子组(54%)They were mainly enriched in the gills, hepatopancreas and chelates; the mortality of copper nano group (21%) was lower than copper ion group (54%)[78]20、40、60、80、100 mg·L-1增强短沟对虾的免疫活性Immune activity of Penaeus semisulcatus were en-hanced[62]0.5、5、20 μg·L-1感染白斑综合症病毒的对虾,注射Ag ENPs后存活率(80%)高于未注射组(10%)Shrimp infected with leukoplakia virus, the survival rate after injection of Ag ENPs (80%) was higher than that of the un-injected group (10%)[63]
3.3 甲壳类
ENPs也会在虾蟹体内发生富集(表1)。CuO ENPs在三疣梭子蟹(Portunustrituberculatus)各组织中的富集含量从高到低依次为鳃>血淋巴>肌肉>肝胰腺>心脏和胃。三疣梭子蟹鳃对CuO ENPs的富集作用远高于其他组织。除血淋巴外,随着CuO ENPs浓度的增高,不同组织的CuO ENPs残留量有一定程度的增加[74]。CuO ENPs对三疣梭子蟹具有急性毒性,96 h的半致死浓度为49 mg·L-1[75]。滨蟹(Carcinusmaenas)暴露在Cu ENPs水体中,其富集含量最高的器官为鳃,其次是肝胰腺,在螯肌中富集量最低[76]。但也有研究发现,ENPs会增强生物的活性和抗病毒能力。例如,生物合成ZnO ENPs通过水介质暴露和食物暴露均可以增强短沟对虾(Penaeussemisulcatus)的免疫活性[77]。感染白斑综合征病毒(white spot syndrome virus, WSSV)的南美白对虾(Litopenaeusvannamei),在注射Ag ENPs 96 h后,与未注射组相比,存活率由10%提升到了80%,证明Ag ENPs可作为抗病毒药物治疗水产养殖生物的疾病[78]。
4 ENPs在海洋食物链中的传递(Trophic transfer of ENPs in the marine food chain)
高营养级生物会通过摄食其他暴露在污染物中的低营养级生物而对污染物产生富集作用。大量研究表明,ENPs可以对海洋细菌、植物和动物等不同营养级生物产生毒性效应,并在生物体中发生富集作用,这就意味着ENPs可以通过捕食关系在海洋食物链中发生传递[79],进而对整个海洋生态系统和人类健康产生潜在危害。ENPs在海洋环境中的环境行为和食物链传递过程,如图2所示。目前,关于ENPs在水生食物链,特别是海洋渔业食物链中的营养传递研究还非常有限。Ferry等[80]建立了由海水、沉积物、海草、蜗牛、硬壳蛤、虾、鱼和生物膜组成的微宇宙生态系统,研究Au ENPs从河口到海洋食物网的迁移行为。经过12 d后,在植物、动物、生物膜、沉积物和海水中能回收到84.4%的Au ENPs,其中,单位质量硬壳蛤富集的ENPs含量最高,表明Au ENPs可以从水体迁移到海洋食物网中。Conway等[81]研究了CeO2ENPs在海洋食物链(球等鞭金藻(Isochrysisgalbana)—紫贻贝(Mytilusedulis))中的营养传递,紫贻贝通过摄食CeO2ENPs暴露后的微藻从而对ENPs产生富集作用,但是大约99%的CeO2ENPs又被紫贻贝以粪便的形式排出体外。有研究表明,ENPs通过食物链传递时会发生生物放大效应。Wang等[82]证实TiO2NPs可通过食物链从新月菱形藻(Nitzschiaclosterium)向栉孔扇贝转移,并在扇贝的鳃、消化腺和外套膜中观察到生物放大现象。但也有研究者认为,纳米颗粒在食物链传递过程中不会发生生物放大效应。Wang等[83]研究发现,TiO2ENPs能够通过食物链从沙蚕(Perinereisaibuhitensis)转移到大菱鲆(Scophthalmusmaximus)体内,随着沙蚕体内Ti含量的增加,大菱鲆幼鱼体内累积的Ti含量也逐渐增加,但其生物放大系数(biological magnification factor, BMF)<1,表明并未发生生物放大效应。究其原因可能是由于ENPs在不同生物中富集的靶器官存在差异,富集在贝类鳃、消化腺和外套膜中的ENPs不易被排出,而进入鱼体的ENPs又通过消化道直接排出,导致BMF值较低,未发生生物放大现象。
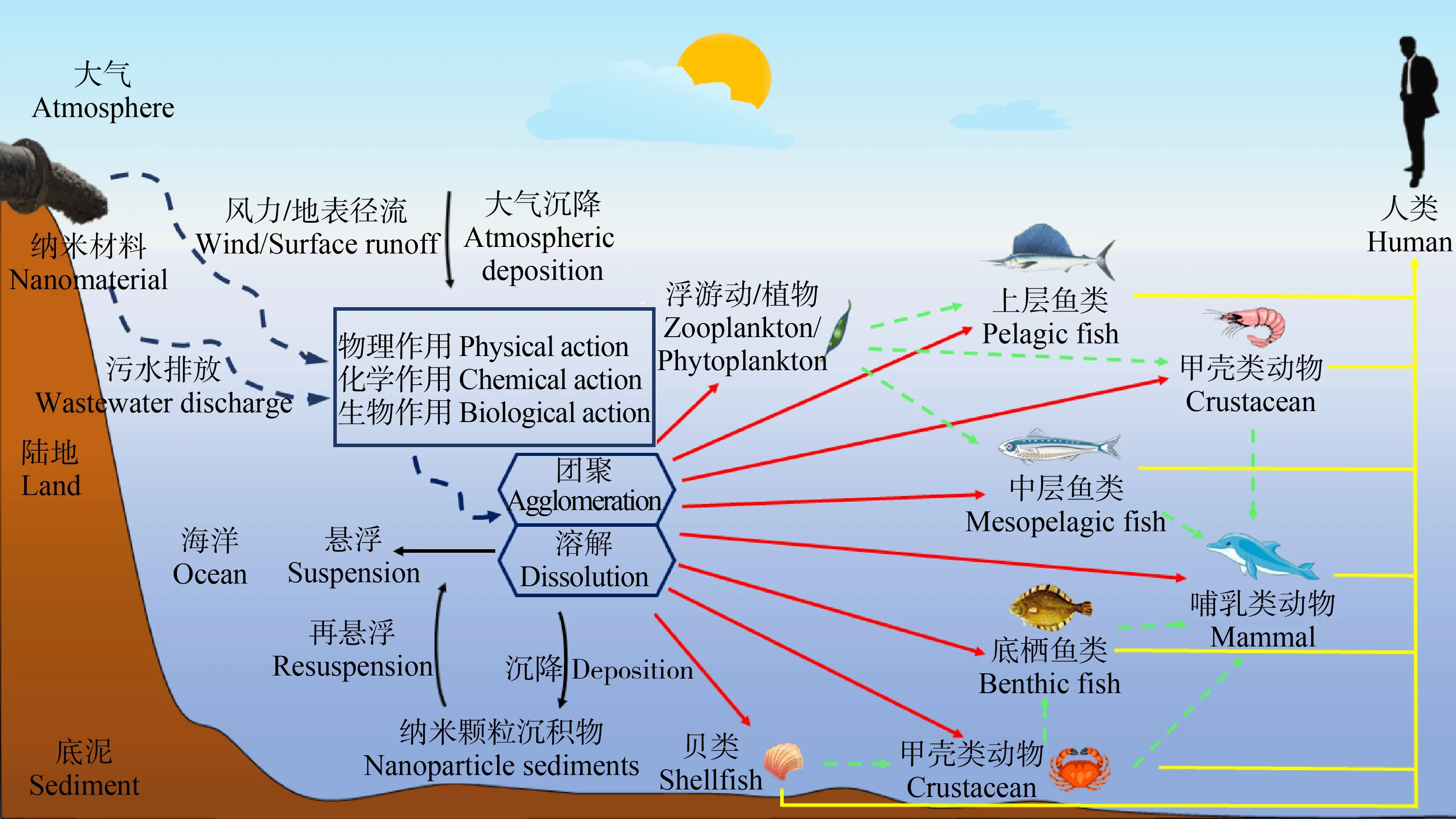
图2 人工纳米颗粒(ENPs)的海洋环境行为及其在海洋渔业食物网中的传递注:黑色箭头表示ENPs在海洋环境中的环境行为;红色箭头表示生物体直接摄入ENPs;绿色虚线箭头表示间接摄入ENPs(潜在的营养转移);黄色箭头表示人类通过食用海产品摄入ENPs。Fig. 2 The marine environment behavior of engineered nanoparticles (ENPs) and its transmission in the food webs of marine fisheriesNote: Black arrows indicate the fate of ENPs in the marine environment; the red arrows indicate the direct uptake of ENPs; green dotted arrows indicate indirect uptake of ENPs (potential trophic transfer); the yellow arrows indicate that human consume the ENPs through eating seafood.
5 ENPs的致毒机制(Toxicity mechanisms of ENPs)
ENPs的毒性效应通常可以分为直接毒性和间接毒性。前者是指ENPs本身刺激生物体而产生的毒性反应;后者是指由于ENPs的其他特性造成的毒性效应,例如,金属纳米材料溶解产生的离子对生物的毒性效应。目前,ENPs的致毒机制还不十分清楚,可能的致毒机制主要包括尺寸效应、离子效应和氧化损伤等,这主要由ENPs的自身性质决定。
5.1 尺寸效应
粒径是ENPs最显著的特征,也是ENPs进入生物体并产生毒性效应的关键因素。ENPs的尺寸会影响其进入细胞的方式[84],较小粒径的ENPs能够直接穿过细胞膜进入到胞内,较大粒径的ENPs会对细胞膜的通透性产生损伤[85]。大粒径的ENPs也会通过内吞作用[86]和主动运输[87]等方式进入到胞内。进入到细胞的ENPs会与生物大分子等细胞内物质发生相互作用[88]。细胞通过内吞作用吸收纳米颗粒依赖于纳米颗粒的尺寸,因此,尺寸对于纳米颗粒在细胞中的分布和引发细胞的毒理效应发挥着重要作用。从材料本身的性质来讲,ENPs的尺寸越小,其比表面积就越大,与生物器官接触的活性点就越多,产生的毒性越大。Ag ENPs对细菌的毒性效应就与其粒径显著相关,粒径越小其抑菌作用越强[89]。TiO2ENPs的毒性也随着尺寸的减小而急剧增加[90]。暴露在1 mg·L-1Cu ENPs中的滨蟹(Carcinusmaenas),7 d后其死亡率为20%,由于Cu ENPs在水体中不易溶解产生Cu2+,因此,其毒性是由纳米颗粒的尺寸效应造成的[76]。ZnO ENPs对海水青鳉(Oryziasmelastigma)胚胎死亡率和心率的影响显著大于Zn2+,这表明ZnO ENPs的毒性主要来自尺寸效应[12]。
5.2 离子效应
大多数金属及其氧化物ENPs(纳米CuO、Ag和ZnO等)在水相中具有一定的溶解性[91],1 mg·L-1的金属ENPs释放出的金属离子可达到“微克”级[92]。金属ENPs进入生物体内后会在生物体内释放出金属离子,从而对生物产生毒性[93],影响其正常生长发育。已有研究表明,ENPs释放的金属离子在其毒性效应中起着非常重要的作用[94]。一方面ENPs自身溶解出来的金属离子对细胞造成一定的毒害作用;另一方面ENPs溶出的金属离子更容易透过被ENPs破坏的细胞膜或者细胞壁,而进入到细胞内,从而增强ENPs的毒性[95]。相对于Cu ENPs,Cu2+的暴露可导致虹鳟鱼对牛磺胆酸的嗅觉反应增强,导致行为及生活习性受到干扰,这可能与嗅觉感觉神经元离子稳态被破坏有关[96]。因此,在评价这些ENPs的毒性效应时,必须考虑易溶解ENPs释放的金属离子对毒性的贡献。
5.3 氧化损伤
活性氧自由基(ROS)的产生及氧化应激反应通常被认为是ENPs的主要致毒机制。相比于常规颗粒,ENPs比表面积大,粒子数目多,更易生成具有高反应能力的自由基,诱导细胞发生氧化损伤和炎症反应,激活免疫系统中一些分子的合成和释放。ENPs对细胞产生损伤的过程可以分为3个阶段[86]。(1)低水平的氧化胁迫。转录因子(Nrf2)调节抗氧化防御系统,包括氧化酶和解毒酶等来抵抗氧化胁迫;ZnO ENPs可诱导斑马鱼肠中的MDA含量增高,随着时间的延长,组织中谷胱甘肽过氧化物酶(GSH-PX)和谷胱甘肽S转移酶(GST)活性呈先升高后下降的趋势[97]。TiO2ENPs处理虹鱒后,鳃和肠道中Na+K+-ATPase的活性显著性下降,鳃中谷胱甘肽(GSH)水平显著性上升[98]。NiO ENPs暴露对牡蛎的鳃和消化腺组织产生了氧化损伤,与鳃相比,消化腺受到的氧化损伤更为严重,抗氧化酶系统在1 mg·L-1和10 mg·L-1的NiO ENPs胁迫时产生显著性应答,成为响应纳米颗粒暴露的重要防线[99]。(2)高水平的氧化胁迫。没有被清除的ROS会刺激细胞中敏感性的酶类,使其产生保护性的促炎反应;刘林等[97]发现ZnO ENPs能诱导斑马鱼肠组织产生氧化应激作用,使组织中抗氧化酶活性发生变化,诱导肠中细胞凋亡相关基因的表达,并且能对肠组织结构造成损伤。研究表明,彩虹鱼(Oncorhynchusmykiss)暴露在TiO2ENPs悬浮液中14 d后,鳃部发生病变,鳃和肠中Na+和K+失衡,ATP酶活性降低,且大脑酶活性也呈现降低趋势[62]。Au ENPs进入紫贻贝(Mytilusedulis)后产生了氧化应激反应[100],抑制了硫氧化蛋白酶的活性[101],降低了溶酶体膜的稳定性[102]。(3)最高水平的氧化胁迫。ROS会导致细胞膜脂质过氧化、线粒体损伤以及细胞功能丧失,最终引起细胞凋亡。ZnO ENPs进入美国红鱼单核巨噬细胞(MO/MФ)内,会引起细胞内ROS升高,并诱发细胞凋亡[64]。C60纳米颗粒导致大口黑鲈(Largemouthbass)的鳃部和脑部发生了严重的氧化损伤以及肝中基因表达发生变化[103]。
6 ENPs对海洋水产品质量安全的潜在影响(Potential impact of ENPs on the quality and safety of seafood)
海洋水产品是我国居民获取优质蛋白质的主要来源之一。实验证明,ENPs会通过摄食等方式在海洋贝类、虾类、蟹类和鱼类等生物体内富集,并对其生理健康造成损害。ENPs还可以随着食物链转移,从而对更高营养级生物和人类造成潜在影响。随着ENPs的生产和消费数量呈指数级增长,未来几十年,环境中ENPs浓度可能会持续升高,从而对海洋生态系统和人类健康造成更大程度的影响。
ENPs对水产品质量安全的潜在影响主要包括以下3个方面。(1)ENPs本身对水产品质量安全造成影响。ENPs进入生物体内后,会在其组织内富集,并且可随食物链转移,人类食用富集ENPs的水产品后可能会导致ENPs在人体内残留,进而可能会对人体健康产生影响。Li等[104]通过体外模型证实了食物中的CeO2ENPs、CuO ENPs和ZnO ENPs进入人体后,可被肠道细胞吸收并运输到肝细胞,从而导致肠道细胞和肝细胞发生坏死。这表明,ENPs具有通过食物转移到人体的功能,具有对人体造成永久性损害的潜在风险。Henson等[105]建立了人肠道细胞三维模型,研究发现,Cu ENPs在人肠道细胞中几乎不溶,细胞毒性主要来自被吸收的Cu ENPs。(2)ENPs释放重金属离子的风险。金属类人工纳米颗粒进入到生物体内,会释放重金属离子并在生物体内富集,对水产品质量安全产生影响。人类食用后可能会导致重金属在人体内富集并对健康造成损害。Gliga等[106]发现,10 nm的Ag ENPs会导致人肺上皮SV-40细胞活性降低,产生细胞毒性,造成DNA损伤,其毒性主要由于ENPs所释放的Ag离子造成。同样地,Ag ENPs所释放的Ag离子会导致人肺上皮A549细胞活性降低,并且这种细胞毒性随着Ag离子释放率增加而增大,当Ag离子释放率由39%增加至69%时,细胞存活率由92%降至54%[107]。ZnO ENPs释放的Zn离子会诱导人脐静脉内皮细胞(HUVECs)产生显著的内质网应激反应,并导致细胞凋亡[108]。(3)ENPs富集其他污染物及病原微生物的风险。ENPs进入到海洋环境中,由于其结构特性可能会吸附其他污染物,比如有机污染物[109]、重金属[110]、放射性元素、潜在有毒物质[111]和多氯化合物[112]等,它们会以颗粒-污染物的复合形式进入到海洋渔业生物体内,从而增加了ENPs的生物有效性及其对生物的毒性,最终对人体健康产生危害[113]。有些病原微生物也可能会以ENPs为载体,进而随着ENPs进入生物体内导致水产品病害。当人类处理或进食这些携带污染物和病原微生物的水产品时,可能也会被感染而发病。
7 结语与展望(Conclusion and future)
ENPs的海洋环境效应已经引起了国内外的广泛关注。研究表明,ENPs被海洋渔业生物摄入后,会在其体内各组织中富集,对其生长发育、摄食和行为造成影响,并引起氧化应激、生殖毒性、免疫毒性和DNA损伤等毒性效应。同时,ENPs会沿着海洋食物链,从低营养级生物向高营养级生物传递,发生生物放大作用,对整个海洋生态系统造成威胁。但是,目前的研究对于准确评估ENPs对海洋渔业资源的影响和风险还远远不够,因此,下一步的研究工作可以在以下方面开展。
(1)目前,采用单颗粒-电感耦合等离子体质谱(SP-ICP-MS)可以原位检测环境中ENPs的浓度[114-115]。但是在进行纳米毒性研究时,采用的实验浓度大多是高于环境浓度的,没有考虑到ENPs在海洋环境中的实际含量,这将导致无法真实、准确和客观地评价ENPs的海洋生态环境风险。因此,应加强环境浓度ENPs对海洋渔业生物的毒性效应研究。
(2)关于ENPs对海洋生物的毒性效应研究,大多是在个体、组织、细胞和分子层面上,还应进一步应用组学的研究技术,如基因组学、蛋白质组学和代谢组学,从基因组、蛋白质组和代谢组水平明确与ENPs毒性关系密切的生物学通路,将传统毒理学和现代组学进行整合分析,阐明ENPs对海洋生物的致毒机制。
(3)目前的研究主要集中于ENPs对海洋生物的毒性效应方面,但是关于ENPs对海洋水产品质量安全影响的研究还很少。基于我国居民的水产品膳食摄入量,应分析暴露途径和暴露人群情况,对海洋水产品中的ENPs开展危害识别、危害描述和暴露评估分析,建立ENPs的水产品食用安全风险评估体系,明确ENPs的海洋环境限量标准值,并将其纳入到海洋环境质量评价标准中,制定相应的法律法规,从而有效降低ENPs的海洋生态风险。

